高中化学人教版必修1第二章 化学物质及其变化离子反应第1课时(共34张ppt)
文档属性
| 名称 | 高中化学人教版必修1第二章 化学物质及其变化离子反应第1课时(共34张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 09:55:33 | ||
图片预览










文档简介
(共34张PPT)
第二节 离子反应
第1课时酸碱盐在水溶液中的电离
高一化学 必修一
学习目标
1、理解电解质、非电解质和电离的概念及基本原理,认识化学现象的本质。
2、获得物质导电性实验的基础知识基本技能,能设计并完成一些化学实验。
3、了解强电解质及弱电解质的概念及常见类型。
铜线
实验表明:金属(铜、铁)能导电。
金属能导电的原因是什么?
金属中的自由电子在外加电场作用下,定向移动形成电流。
灯泡发光
合作探究
蔗糖溶液
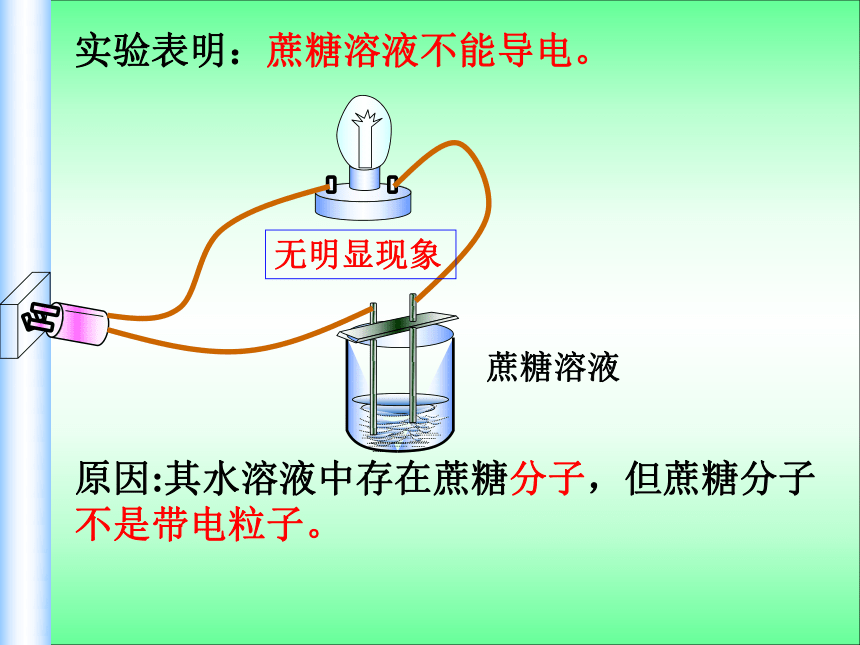
实验表明:蔗糖溶液不能导电。
原因:其水溶液中存在蔗糖分子,但蔗糖分子不是带电粒子。
无明显现象
NaCl
Na+
Cl-
NaCl固体
由阴离子和阳离子构成的离子化合物
实验表明:NaCl固体不导电。
原因:虽有带电粒子(钠离子和氯离子),但其不能自由移动。
无明显现象
NaCl 溶液
实验表明:NaCl溶液能导电。
原因:NaCl在水中电离产生Na+和Cl—,在电场作用下定向移动产生电流。
灯泡发光
根据初中所学的知识,酸、碱、盐在水溶液中能导电的原因是什么?
其原因是酸、碱、盐等在水中给出能自由移动的离子。
想一想:
物质导电的条件是什么?
有自由移动的带电粒子
?
[问题] 下列物质中哪些能导电?思考导电原因?
硫酸溶液、NaOH溶液、NaCl固体、
NaCl溶液、石墨、 蔗糖溶液、酒精溶液、
K2SO4溶液、Cu。
1、电离:物质溶于水后或受热熔化时,离解成能够自由移动的离子的过程。
一、酸、碱、盐在水溶液中的电离
2、电解质和非电解质
电解质:在水溶液里或熔融状态下能导电的 化合物。如H2SO4 、NaOH等
非电解质:在水溶液和熔融状态下都不能导电的化合物。如蔗糖、酒精等
1.金属和NaOH溶液能够导电,它们是电解质吗?
2.硫酸钡难溶于水,它的水溶液几乎不导电,是否是电解质?
3.SO2溶于水生成H2SO3,溶液也导电,SO2为什么不是电解质吗?
思考与交流
概念剖析
1.电解质应该是化合物。
Cu(单质),硝酸钾溶液(混和物)不是电解质。
2.电解质的导电条件:水溶液或熔化状态。
电解质本身未必能导电,如HCl气体、NaCl固体。
3.电解质导电必须是用化合物本身能电离出自由移动的离子而导电。
CO2水溶液导电,是因为CO2与H2O反应生成H2CO3而导电,H2CO3是电解质,CO2不是电解质。
4.电解质主要包括:酸、碱、盐、水,其次金属氧化物。如:硫酸、NaOH、CaCO3、水、 CaO
5.大多数有机物、非金属氧化物是非电解质。CH3CH2OH 、 SO3 、 CO2
√
×
×
×
×
×
×
学以致用
判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质。
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质。
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质。
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质。
5、BaSO4难溶于水,所以BaSO4是非电解质。
6、电解质都能够导电,能导电的物质都是电解质。
7、非电解质都不能导电,不能导电的物质不一定是非电解质。
2、下列物质中哪些能导电?哪些是电解质?哪些是非电解质?
①银 ② HCl ③盐酸 ④KOH(熔融)⑤ BaSO4
⑥ NaCl晶体 ⑦NaOH水溶液 ⑧酒精 ⑨ CO2 ⑩蔗糖
电解质:
能导电:
非电解质:
① ③ ④ ⑦
② ④ ⑤ ⑥
⑧ ⑨⑩
Cl-
H+
液 面
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
HCl电离的结果
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COO-
液 面
CH3COO-
CH3COO-
CH3COO-
H+
H+
H+
H+
H+
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COO-
CH3COOH电离的结果
⑴强电解质:在水溶液里全部电离成离子的电解质。
强弱电解质的本质区别是:
能否完全电离,即电离程度
3、强电解质和弱电解质
⑵弱电解质:在水溶液里只有部分分子电离成离子的电解质。
金属氧化物:
少数盐:醋酸铅、HgCl2等
H2O是极弱电解质。
常见的强电解质:
强酸:
HCl、HBr、HI、H2SO4、HNO3、HClO4等。
强碱:
NaOH、KOH、Ba(OH)2、Ca(OH)2等
绝大多数盐:
NaCl、NH4Cl、Fe(NO3)3、BaSO4等
Na2O等
常见的弱电解质:
弱酸:
HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:
NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
物质
混合物
纯净物
化合物
单质
电解质
非电解质
再议物质分类:
不是电解质
也不是非电解质
NH3
多数有机物:
非金属氧化物:
如酒精、蔗糖、CH4
如CO2、SO2
1.CH3COOH
2. H2SO3
3. Ca(OH)2
4. Cu(OH)2
5.CaCl2
6. NaHCO3
7. NaHSO4
8.HClO
9.BaSO4
练习:判断强弱电解质。
4、电离方程式
书写电离方程式的步骤:
1、阴阳离子部分拆开写,但原子团不能拆,例如有NO3-、SO42-、OH-、NH4+、CO32-等 。
2、构成物质的原子或原子团的个数在书写成离子时为系数。
NaCl=Na+ + Cl-
3. 电离及电离方程式
NaCl =
HCl =
HNO3 =
H2SO4 =
Ba(OH)2 =
NaOH =
CuSO4 =
NH4Cl =
Na+ + Cl-
H+ + Cl-
H+ + NO3-
2H+ + SO42-
Ba2+ + 2OH-
Na+ + OH-
Cu2+ + SO42-
NH4+ + Cl-
注意:酸、碱、盐的电离(水溶液中)
①完全电离用“=”,部分电离用“ ”
②强酸一步完全电离,弱酸分步部分电离。
③强碱、绝大部分盐一步完全电离,弱碱
一步部分电离。
④要遵守质量守恒和电荷守恒两大定律。
【练习】写出下列三组物质的电离方程式,归纳出酸、碱、盐的本质定义。
1、HCl 、H2SO4、HNO3
2、NaOH、KOH、Ba(OH)2
3、Na2SO4、NH4NO3、CaCl2
HCl = H+ + Cl-
HNO3 = H+ + NO3-
H2SO4 = 2H+ + SO42-
Ba(OH)2 = 2OH- + Ba2+
NaOH = OH- + Na+
KOH = OH- + K+
Na2SO4 = 2Na+ + SO42-
NH4NO3 = NH4+ + NO3-
CaCl2 = Ca2+ + 2Cl-
酸:电离时产生的阳离子全部是H+的化合物
碱:电离时产生的阴离子全部是OH-的化合物
盐:电离时能产生金属阳离子(或铵根离子)和酸根离子的化合物
弱酸的电离:
CH3COOH
H2S
练习:
写出下列电离方程式
K2CO3 =
NaOH=
HNO3=
2K++CO32-
Na++OH-
H++NO3-
H++CH3COO -
H++HS-
HS-
H++S2-
一可逆,二分步电离
整理归纳
强电解质 弱电解质
定义
物质类别
电离程度
电离方程式
溶液中溶质存在形式
强酸、强碱、绝大多数盐
在水溶液中完全 电离的电解质
在水溶液中不完全电离的电解质
完全
不完全
用“=”表示
只有离子
既有离子,又有分子
弱酸、弱碱、水等
用“ ”表示
我们学了些什么?
电解质和非电解质;强电解质和弱电解质;电离和电离方程式的书写;酸、碱、盐的定义,你都记住了吗?
①③④⑤⑥⑦⑨⑩?
①⑤⑦⑨⑩
②⑧?
【当堂检测】
本课栏目开关
知识回顾区
学习探究区
自我检测区
本课栏目开关
知识回顾区
学习探究区
自我检测区
【当堂检测】
本课栏目开关
知识回顾区
学习探究区
自我检测区
本课栏目开关
知识回顾区
学习探究区
自我检测区
②④⑥⑦⑧
②④
④
⑦⑧
⑦
⑥
本课栏目开关
知识回顾区
学习探究区
自我检测区
不能
HCl是酸,液态时不电离,只在水溶液中电离
能
能电离出Na+和Cl-
不能
Fe是单质
不能
电解质在固态时不电离
本课栏目开关
知识回顾区
学习探究区
自我检测区
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第二节 离子反应
第1课时酸碱盐在水溶液中的电离
高一化学 必修一
学习目标
1、理解电解质、非电解质和电离的概念及基本原理,认识化学现象的本质。
2、获得物质导电性实验的基础知识基本技能,能设计并完成一些化学实验。
3、了解强电解质及弱电解质的概念及常见类型。
铜线
实验表明:金属(铜、铁)能导电。
金属能导电的原因是什么?
金属中的自由电子在外加电场作用下,定向移动形成电流。
灯泡发光
合作探究
蔗糖溶液
实验表明:蔗糖溶液不能导电。
原因:其水溶液中存在蔗糖分子,但蔗糖分子不是带电粒子。
无明显现象
NaCl
Na+
Cl-
NaCl固体
由阴离子和阳离子构成的离子化合物
实验表明:NaCl固体不导电。
原因:虽有带电粒子(钠离子和氯离子),但其不能自由移动。
无明显现象
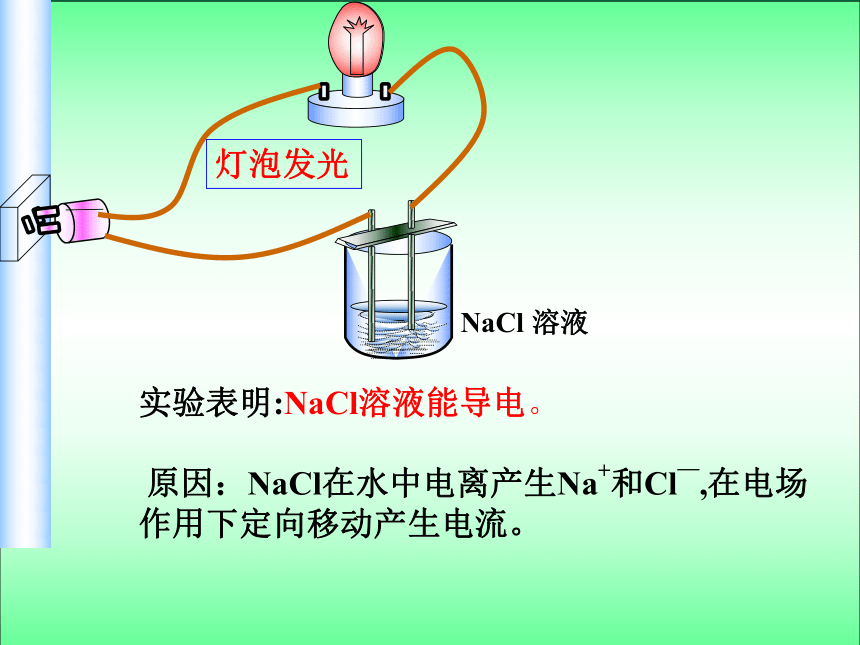
NaCl 溶液
实验表明:NaCl溶液能导电。
原因:NaCl在水中电离产生Na+和Cl—,在电场作用下定向移动产生电流。
灯泡发光
根据初中所学的知识,酸、碱、盐在水溶液中能导电的原因是什么?
其原因是酸、碱、盐等在水中给出能自由移动的离子。
想一想:
物质导电的条件是什么?
有自由移动的带电粒子
?
[问题] 下列物质中哪些能导电?思考导电原因?
硫酸溶液、NaOH溶液、NaCl固体、
NaCl溶液、石墨、 蔗糖溶液、酒精溶液、
K2SO4溶液、Cu。
1、电离:物质溶于水后或受热熔化时,离解成能够自由移动的离子的过程。
一、酸、碱、盐在水溶液中的电离
2、电解质和非电解质
电解质:在水溶液里或熔融状态下能导电的 化合物。如H2SO4 、NaOH等
非电解质:在水溶液和熔融状态下都不能导电的化合物。如蔗糖、酒精等
1.金属和NaOH溶液能够导电,它们是电解质吗?
2.硫酸钡难溶于水,它的水溶液几乎不导电,是否是电解质?
3.SO2溶于水生成H2SO3,溶液也导电,SO2为什么不是电解质吗?
思考与交流
概念剖析
1.电解质应该是化合物。
Cu(单质),硝酸钾溶液(混和物)不是电解质。
2.电解质的导电条件:水溶液或熔化状态。
电解质本身未必能导电,如HCl气体、NaCl固体。
3.电解质导电必须是用化合物本身能电离出自由移动的离子而导电。
CO2水溶液导电,是因为CO2与H2O反应生成H2CO3而导电,H2CO3是电解质,CO2不是电解质。
4.电解质主要包括:酸、碱、盐、水,其次金属氧化物。如:硫酸、NaOH、CaCO3、水、 CaO
5.大多数有机物、非金属氧化物是非电解质。CH3CH2OH 、 SO3 、 CO2
√
×
×
×
×
×
×
学以致用
判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质。
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质。
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质。
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质。
5、BaSO4难溶于水,所以BaSO4是非电解质。
6、电解质都能够导电,能导电的物质都是电解质。
7、非电解质都不能导电,不能导电的物质不一定是非电解质。
2、下列物质中哪些能导电?哪些是电解质?哪些是非电解质?
①银 ② HCl ③盐酸 ④KOH(熔融)⑤ BaSO4
⑥ NaCl晶体 ⑦NaOH水溶液 ⑧酒精 ⑨ CO2 ⑩蔗糖
电解质:
能导电:
非电解质:
① ③ ④ ⑦
② ④ ⑤ ⑥
⑧ ⑨⑩
Cl-
H+
液 面
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
HCl电离的结果
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COO-
液 面
CH3COO-
CH3COO-
CH3COO-
H+
H+
H+
H+
H+
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COO-
CH3COOH电离的结果
⑴强电解质:在水溶液里全部电离成离子的电解质。
强弱电解质的本质区别是:
能否完全电离,即电离程度
3、强电解质和弱电解质
⑵弱电解质:在水溶液里只有部分分子电离成离子的电解质。
金属氧化物:
少数盐:醋酸铅、HgCl2等
H2O是极弱电解质。
常见的强电解质:
强酸:
HCl、HBr、HI、H2SO4、HNO3、HClO4等。
强碱:
NaOH、KOH、Ba(OH)2、Ca(OH)2等
绝大多数盐:
NaCl、NH4Cl、Fe(NO3)3、BaSO4等
Na2O等
常见的弱电解质:
弱酸:
HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:
NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
物质
混合物
纯净物
化合物
单质
电解质
非电解质
再议物质分类:
不是电解质
也不是非电解质
NH3
多数有机物:
非金属氧化物:
如酒精、蔗糖、CH4
如CO2、SO2
1.CH3COOH
2. H2SO3
3. Ca(OH)2
4. Cu(OH)2
5.CaCl2
6. NaHCO3
7. NaHSO4
8.HClO
9.BaSO4
练习:判断强弱电解质。
4、电离方程式
书写电离方程式的步骤:
1、阴阳离子部分拆开写,但原子团不能拆,例如有NO3-、SO42-、OH-、NH4+、CO32-等 。
2、构成物质的原子或原子团的个数在书写成离子时为系数。
NaCl=Na+ + Cl-
3. 电离及电离方程式
NaCl =
HCl =
HNO3 =
H2SO4 =
Ba(OH)2 =
NaOH =
CuSO4 =
NH4Cl =
Na+ + Cl-
H+ + Cl-
H+ + NO3-
2H+ + SO42-
Ba2+ + 2OH-
Na+ + OH-
Cu2+ + SO42-
NH4+ + Cl-
注意:酸、碱、盐的电离(水溶液中)
①完全电离用“=”,部分电离用“ ”
②强酸一步完全电离,弱酸分步部分电离。
③强碱、绝大部分盐一步完全电离,弱碱
一步部分电离。
④要遵守质量守恒和电荷守恒两大定律。
【练习】写出下列三组物质的电离方程式,归纳出酸、碱、盐的本质定义。
1、HCl 、H2SO4、HNO3
2、NaOH、KOH、Ba(OH)2
3、Na2SO4、NH4NO3、CaCl2
HCl = H+ + Cl-
HNO3 = H+ + NO3-
H2SO4 = 2H+ + SO42-
Ba(OH)2 = 2OH- + Ba2+
NaOH = OH- + Na+
KOH = OH- + K+
Na2SO4 = 2Na+ + SO42-
NH4NO3 = NH4+ + NO3-
CaCl2 = Ca2+ + 2Cl-
酸:电离时产生的阳离子全部是H+的化合物
碱:电离时产生的阴离子全部是OH-的化合物
盐:电离时能产生金属阳离子(或铵根离子)和酸根离子的化合物
弱酸的电离:
CH3COOH
H2S
练习:
写出下列电离方程式
K2CO3 =
NaOH=
HNO3=
2K++CO32-
Na++OH-
H++NO3-
H++CH3COO -
H++HS-
HS-
H++S2-
一可逆,二分步电离
整理归纳
强电解质 弱电解质
定义
物质类别
电离程度
电离方程式
溶液中溶质存在形式
强酸、强碱、绝大多数盐
在水溶液中完全 电离的电解质
在水溶液中不完全电离的电解质
完全
不完全
用“=”表示
只有离子
既有离子,又有分子
弱酸、弱碱、水等
用“ ”表示
我们学了些什么?
电解质和非电解质;强电解质和弱电解质;电离和电离方程式的书写;酸、碱、盐的定义,你都记住了吗?
①③④⑤⑥⑦⑨⑩?
①⑤⑦⑨⑩
②⑧?
【当堂检测】
本课栏目开关
知识回顾区
学习探究区
自我检测区
本课栏目开关
知识回顾区
学习探究区
自我检测区
【当堂检测】
本课栏目开关
知识回顾区
学习探究区
自我检测区
本课栏目开关
知识回顾区
学习探究区
自我检测区
②④⑥⑦⑧
②④
④
⑦⑧
⑦
⑥
本课栏目开关
知识回顾区
学习探究区
自我检测区
不能
HCl是酸,液态时不电离,只在水溶液中电离
能
能电离出Na+和Cl-
不能
Fe是单质
不能
电解质在固态时不电离
本课栏目开关
知识回顾区
学习探究区
自我检测区
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
