高中化学人教版必修1第二章 化学物质及其变化第二节离子反应第2课时(共38张ppt)
文档属性
| 名称 | 高中化学人教版必修1第二章 化学物质及其变化第二节离子反应第2课时(共38张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 00:00:00 | ||
图片预览










文档简介
(共38张PPT)
第2课时 离子反应及其发生的条件
高一化学 人教版 必修一
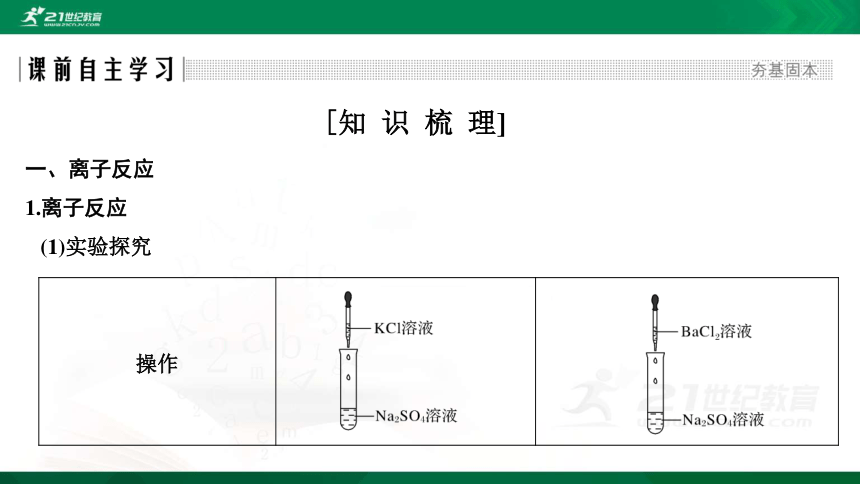
一、离子反应
1.离子反应
(1)实验探究
[知 识 梳 理]
操作
(2)概念:有_________参加或有_________生成的化学反应。
(3)实质:反应物的某些离子的浓度_________。
无明显现象
产生白色沉淀
BaSO4
离子
离子
减小
2.离子方程式
(1)概念:用实际参加反应的_____________来表示反应的式子。
(2)书写步骤
离子符号
易溶于水且易电离
原子个数和电荷总数
H++OH-===H2O
【自主思考】
1.H++OH-===H2O能表示所有的强酸和强碱发生的反应吗?
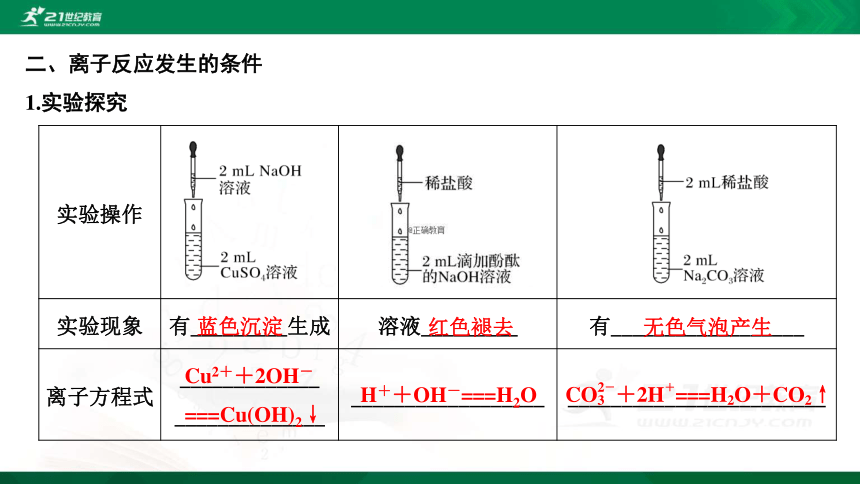
二、离子反应发生的条件
1.实验探究
实验操作
实验现象 有_________生成 溶液_________ 有__________________
离子方程式 _____________
______________ __________________ ________________________
蓝色沉淀
红色褪去
无色气泡产生
Cu2++2OH-
===Cu(OH)2↓
H++OH-===H2O
2.复分解型离子反应发生的条件
【自主思考】
2.根据复分解反应发生的条件分析离子反应发生后的结果是什么?
提示 复分解反应发生的条件是:生成沉淀、放出气体或生成水(具备上述条件之一即可);因此离子反应发生后导致溶液中某些离子浓度明显减小。
难溶
难电离
挥发性
[效 果 自 测]
答案 (1)√ (2)× (3)× (4)√ (5)×
2.下列不能发生离子反应的是________。
①NaCl溶液与AgNO3溶液
②KNO3溶液与NaOH溶液
③稀硫酸与BaCl2溶液
④盐酸与Na2CO3溶液
⑤Na2CO3溶液与Ca(OH)2溶液
⑥NaOH溶液与稀HNO3溶液
⑦锌与CuSO4溶液
⑧稀H2SO4和NaCl溶液
⑨Na2SO4溶液和CuCl2溶液
解析 复分解型离子反应的条件是a.生成难溶或微溶物质;b.生成难电离物质(弱酸、弱碱、H2O);c.生成挥发性物质(或气体)。三者满足其一即可发生离子反应,其中①③⑤分别生成AgCl沉淀、BaSO4沉淀、CaCO3沉淀,⑥生成H2O,④生成CO2,⑦Zn与Cu2+发生置换反应,故①③④⑤⑥⑦都能发生离子反应,②⑧⑨不符合离子反应的条件,不能发生离子反应。
答案 ②⑧⑨
3.根据离子方程式的书写步骤写出CaCO3与稀盐酸反应的离子方程式。
CaCO3+2HCl===CaCl2+2H2O+CO2
CaCO3+2H++2Cl-===Ca2++ 2Cl- +H2O+CO2↑
CaCO3+2H + ===Ca2++H2O+CO2↑
4.下列各组中的两个反应,可用同一离子方程式表示的是( )
A.CaCO3和HCl、K2CO3和HCl
B.BaCl2和H2SO4、Ba(OH)2和H2SO4
C.HCl和Na2CO3、HCl和NaHCO3
D.NaOH和H2SO4、Ba(OH)2和HNO3
答案 D
提示 CaCO3难溶于水,不能拆为离子。
2.AgNO3溶液和Cu反应的离子方程式写成Cu+Ag+===Cu2++Ag正确吗?为什么?
提示 错误。该离子方程式电荷不守恒。
【点拨提升】
1.离子方程式书写及判断的核心
在书写离子方程式和判断离子方程式的正误时要从“两易”“两等”和“两查”入手:
3.书写离子方程式时的拆分原则:
(1)强酸、强碱和易溶于水的盐改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。
(2)改写微溶物时要看清题目要求:①作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。
②作为生成物,一般写化学式(标↓号),如石灰水和石灰乳:石灰水写成离子形式而石灰乳则写化学式。
(3)氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写NH3(标↑号)。
【典题例证1】 能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D.碳酸钙溶于稀盐酸中:CaCO3+2H+===Ca2++H2O+CO2↑
答案 D
解析 某个离子方程式书写是否正确应遵循客观事实。A项反应不能发生,因为Cu的金属活动性弱,不能置换出氢气;B项忽视了所有阴、阳离子均参加了反应;C项反应生成的H2CO3不稳定,分解成CO2和H2O;D项正确。
答案 D
探究二、离子反应发生的条件及离子大量共存问题
【探究讨论】
1.电解质在溶液中混合一定能发生反应吗?
提示 不一定。若不能形成沉淀、气体或难电离物质,则不能发生反应。
2.Cl-和哪种阳离子不能在溶液中大量共存?
提示 与Ag+不能在溶液中大量共存。
【点拨提升】
1.离子反应发生的条件
2.离子不能大量共存的两类情况
(1)能发生复分解反应。
①生成难溶或微溶的物质。如生成BaSO4、AgCl、CaCO3、CaSO4、Ag2SO4、BaCO3、MgCO3、Fe(OH)3等。
②生成难电离的物质。如生成CH3COOH、HClO、H2O、NH3·H2O等。
③生成挥发性物质(气体)。如生成CO2、SO2、H2S等。只要具备上述三个条件中的一个,则离子不能大量共存。
(2)能发生置换反应:金属单质与金属阳离子之间的置换反应,如Fe与CuSO4溶液的反应,实际上是Fe与Cu2+之间的置换反应。
答案 C
答案 A
答案 B
解析 单质、氧化物、难溶于水的物质、难电离的物质不能写成离子形式,B、D均错误;C项还生成氢氧化镁沉淀。
答案 A
3.能用离子方程式H++OH-===H2O表示的化学反应是( )
A.Cu(OH)2(s)和H2SO4(aq)的反应
B.澄清石灰水和HCl(aq)的反应
C.KOH(aq)和Na2SO4的反应
D.Ba(OH)2(aq)和H2SO4(aq)的反应
解析 A中Cu(OH)2(s)不溶于水,离子方程式中应写成化学式形式;C中KOH(aq)和Na2SO4不能发生复分解反应;D中除了有水生成还有难溶于水的BaSO4沉淀生成。
答案 B
答案 C
5.用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
(1)FeSO4溶液(CuSO4):所加试剂:________,
离子方程式:________________________________________________。
(2)Cu(Mg):所加试剂:________,
离子方程式:_________________________________________________。
(3)CO(CO2):所加试剂:________,
离子方程式:___________________________________________________。
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第2课时 离子反应及其发生的条件
高一化学 人教版 必修一
一、离子反应
1.离子反应
(1)实验探究
[知 识 梳 理]
操作
(2)概念:有_________参加或有_________生成的化学反应。
(3)实质:反应物的某些离子的浓度_________。
无明显现象
产生白色沉淀
BaSO4
离子
离子
减小
2.离子方程式
(1)概念:用实际参加反应的_____________来表示反应的式子。
(2)书写步骤
离子符号
易溶于水且易电离
原子个数和电荷总数
H++OH-===H2O
【自主思考】
1.H++OH-===H2O能表示所有的强酸和强碱发生的反应吗?
二、离子反应发生的条件
1.实验探究
实验操作
实验现象 有_________生成 溶液_________ 有__________________
离子方程式 _____________
______________ __________________ ________________________
蓝色沉淀
红色褪去
无色气泡产生
Cu2++2OH-
===Cu(OH)2↓
H++OH-===H2O
2.复分解型离子反应发生的条件
【自主思考】
2.根据复分解反应发生的条件分析离子反应发生后的结果是什么?
提示 复分解反应发生的条件是:生成沉淀、放出气体或生成水(具备上述条件之一即可);因此离子反应发生后导致溶液中某些离子浓度明显减小。
难溶
难电离
挥发性
[效 果 自 测]
答案 (1)√ (2)× (3)× (4)√ (5)×
2.下列不能发生离子反应的是________。
①NaCl溶液与AgNO3溶液
②KNO3溶液与NaOH溶液
③稀硫酸与BaCl2溶液
④盐酸与Na2CO3溶液
⑤Na2CO3溶液与Ca(OH)2溶液
⑥NaOH溶液与稀HNO3溶液
⑦锌与CuSO4溶液
⑧稀H2SO4和NaCl溶液
⑨Na2SO4溶液和CuCl2溶液
解析 复分解型离子反应的条件是a.生成难溶或微溶物质;b.生成难电离物质(弱酸、弱碱、H2O);c.生成挥发性物质(或气体)。三者满足其一即可发生离子反应,其中①③⑤分别生成AgCl沉淀、BaSO4沉淀、CaCO3沉淀,⑥生成H2O,④生成CO2,⑦Zn与Cu2+发生置换反应,故①③④⑤⑥⑦都能发生离子反应,②⑧⑨不符合离子反应的条件,不能发生离子反应。
答案 ②⑧⑨
3.根据离子方程式的书写步骤写出CaCO3与稀盐酸反应的离子方程式。
CaCO3+2HCl===CaCl2+2H2O+CO2
CaCO3+2H++2Cl-===Ca2++ 2Cl- +H2O+CO2↑
CaCO3+2H + ===Ca2++H2O+CO2↑
4.下列各组中的两个反应,可用同一离子方程式表示的是( )
A.CaCO3和HCl、K2CO3和HCl
B.BaCl2和H2SO4、Ba(OH)2和H2SO4
C.HCl和Na2CO3、HCl和NaHCO3
D.NaOH和H2SO4、Ba(OH)2和HNO3
答案 D
提示 CaCO3难溶于水,不能拆为离子。
2.AgNO3溶液和Cu反应的离子方程式写成Cu+Ag+===Cu2++Ag正确吗?为什么?
提示 错误。该离子方程式电荷不守恒。
【点拨提升】
1.离子方程式书写及判断的核心
在书写离子方程式和判断离子方程式的正误时要从“两易”“两等”和“两查”入手:
3.书写离子方程式时的拆分原则:
(1)强酸、强碱和易溶于水的盐改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。
(2)改写微溶物时要看清题目要求:①作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。
②作为生成物,一般写化学式(标↓号),如石灰水和石灰乳:石灰水写成离子形式而石灰乳则写化学式。
(3)氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写NH3(标↑号)。
【典题例证1】 能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C.铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D.碳酸钙溶于稀盐酸中:CaCO3+2H+===Ca2++H2O+CO2↑
答案 D
解析 某个离子方程式书写是否正确应遵循客观事实。A项反应不能发生,因为Cu的金属活动性弱,不能置换出氢气;B项忽视了所有阴、阳离子均参加了反应;C项反应生成的H2CO3不稳定,分解成CO2和H2O;D项正确。
答案 D
探究二、离子反应发生的条件及离子大量共存问题
【探究讨论】
1.电解质在溶液中混合一定能发生反应吗?
提示 不一定。若不能形成沉淀、气体或难电离物质,则不能发生反应。
2.Cl-和哪种阳离子不能在溶液中大量共存?
提示 与Ag+不能在溶液中大量共存。
【点拨提升】
1.离子反应发生的条件
2.离子不能大量共存的两类情况
(1)能发生复分解反应。
①生成难溶或微溶的物质。如生成BaSO4、AgCl、CaCO3、CaSO4、Ag2SO4、BaCO3、MgCO3、Fe(OH)3等。
②生成难电离的物质。如生成CH3COOH、HClO、H2O、NH3·H2O等。
③生成挥发性物质(气体)。如生成CO2、SO2、H2S等。只要具备上述三个条件中的一个,则离子不能大量共存。
(2)能发生置换反应:金属单质与金属阳离子之间的置换反应,如Fe与CuSO4溶液的反应,实际上是Fe与Cu2+之间的置换反应。
答案 C
答案 A
答案 B
解析 单质、氧化物、难溶于水的物质、难电离的物质不能写成离子形式,B、D均错误;C项还生成氢氧化镁沉淀。
答案 A
3.能用离子方程式H++OH-===H2O表示的化学反应是( )
A.Cu(OH)2(s)和H2SO4(aq)的反应
B.澄清石灰水和HCl(aq)的反应
C.KOH(aq)和Na2SO4的反应
D.Ba(OH)2(aq)和H2SO4(aq)的反应
解析 A中Cu(OH)2(s)不溶于水,离子方程式中应写成化学式形式;C中KOH(aq)和Na2SO4不能发生复分解反应;D中除了有水生成还有难溶于水的BaSO4沉淀生成。
答案 B
答案 C
5.用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
(1)FeSO4溶液(CuSO4):所加试剂:________,
离子方程式:________________________________________________。
(2)Cu(Mg):所加试剂:________,
离子方程式:_________________________________________________。
(3)CO(CO2):所加试剂:________,
离子方程式:___________________________________________________。
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
