高中化学人教版必修1第二章第三节 氧化还原反应氧还反应第2课时(共22张ppt)
文档属性
| 名称 | 高中化学人教版必修1第二章第三节 氧化还原反应氧还反应第2课时(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 09:59:10 | ||
图片预览








文档简介
(共22张PPT)
§2.3 氧化还原反应
(第2课时 氧化剂和还原剂)
人教版 必修一
(1)氧化还原反应的特征:
反应前后有元素化合价升降
知识回顾
(2)氧化还原反应的实质是:
电子的转移(得失或偏移)
【复习1】
在反应 MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
Cl
Mn
氧化
还原
氧化
还原
+4 -1 +2 0
氧化剂:在氧化还原反应中,所含元素化合价降低的反应物。氧化剂被还原,发生还原反应。
还原剂:在氧化还原反应中,所含元素化合价升高的反应物。还原剂被氧化,发生氧化反应。
还原产物:氧化剂中元素化合价降低以后得到的产物。
氧化产物:还原剂中元素化合价升高以后得到的产物。
氧化剂 还原剂 还原产物 氧化产物
+2 0 0 +1
化合价降低
化合价升高
CuO + H2 === Cu + H2O
被氧化(氧化反应)
被还原(还原反应)
一.氧化剂和还原剂
1.基本定义:
+2 0 0 +1
化合价降低
化合价升高
CuO + H2 === Cu + H2O
被氧化(氧化反应)
被还原(还原反应)
从电子转移的角度(本质)理解:
氧化剂:所含元素得到电子(或电子对偏向)的反应物。
还原剂:所含元素失去电子(或电子对偏离)的反应物。
氧化剂 还原剂 还原产物 氧化产物
氧化剂具有氧化性,即物质得电子(电子偏向)、化合价降低的性质。
还原剂具有还原性,即物质失电子(电子偏离)、化合价升高的性质。
结论:最高价态……只具氧化性 最低价态……只具还原性
中间价态……兼有氧化性和还原性
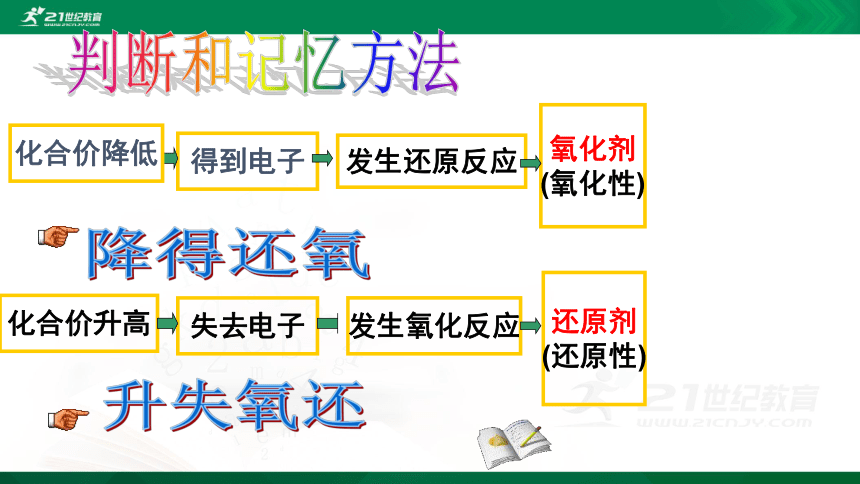
失2e-
得2e-
氧化剂
(氧化性)
得到电子
发生还原反应
还原剂
(还原性)
失去电子
化合价升高
发生氧化反应
化合价降低
降得还氧
升失氧还
判断和记忆方法
①活泼的非金属单质如:卤素单质、 O2等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸性KMnO4。
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。
常见的氧化剂有:
常见的还原剂有:
二、氧化性和还原性
1.氧化性和还原性
(1)氧化性:氧化剂所表现出__________的性质。
(2)还原性:还原剂所表现出__________的性质。
2.氧化性、还原性和元素化合价之间的关系
得电子
失电子
还原
氧化
还原
氧化
练习:从化合价角度分析下列微粒的性质
在Fe3+、Fe2+、Al3+、H+、S、Zn、Cl-等粒子中只有氧化性的是 ,只有还原性的是 ,兼有氧化性和还原性的是 。
Fe3+、Al3+、H+
Zn、Cl-
Fe2+、S
高价氧化低价还,中间价态两性全。
元素常见化合价:
Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1
Al:0 ,+3 Cl:-1 ,0, +1, +5, +7
① Fe2O3 + 3CO 2Fe + 3CO2
② SO2 + 2H2S == 2H2O + 3S
③ Zn + 2HCl == ZnCl2 + H2↑
④ 2KClO3 2KCl+3O2↑
还原剂 氧化剂 氧化产物 还原产物
氧化剂 还原剂 还原产物 氧化产物
氧化剂 还原剂 还原产物与氧化产物
还原剂与氧化剂 还原产物 氧化产物
练习:1. 指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物。
氧化剂 + 还原剂 → 还原产物 + 氧化产物
还原产物
氧化产物
还原反应
氧化反应
化合价降低
化合价升高
得电子
失电子
同时存在
数目相等
数目相等
同时发生
同时存在
(氧化性)
氧化剂
还原剂(还原性)
被还原
被氧化
化价升降须相等,电子转移要守恒。
+2 0 0 +1
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
CuO + H2 === Cu + H2O
重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)
双线桥表示法
得电子,化合价降低,被还原(还原反应)
失电子,化合价升高,被氧化(氧化反应)
氧化剂 + 还原剂 → 还原产物 + 氧化产物
用双线桥应注意的事项:
正确判断各反应物、生成物各元素的化合价及其变化
两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
电子符号用“e-”来表示
得失电子总数表示:原子个数 × 每个原子得失电子数
注意:反应中失去电子的总数等于得到电子的总数
氧化还原反应的表示:
(氧化还原反应、 化合价升降、电子转移和总数)
单线桥表示法
表明反应中化合价变化的元素原子间的电子转移情况。 ①单线桥法表示电子转移的基本步骤
总结: 氧化还原反应中电子转移的表示方法
(1)双线桥法:先标化合价,再看价变化;起止同元素,桥上标变化。
(2)单线桥法:确定变化化合价,计算价态的变化;桥上标明电子数,箭头还原到氧化。
重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
【点拨提升】
1.氧化性和还原性强弱的判断方法
(1)根据氧化还原反应的方向判断
氧化还原两性比,剂强于产物之性。
MnO2+4HCl = MnCl2+Cl2 +2H2O
1.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物.
2Na + Cl2 == 2NaCl
CuO + C 2Cu+CO2
高温
2KMnO4 = K2MnO4+MnO2+O2
随堂练习(一)
氧化剂 还原剂 还原产物 氧化产物
还原剂 氧化剂 还原产物和氧化产物
还原剂和氧化剂 还原产物 还原产物 氧化产物
氧化剂 还原剂 还原产物 氧化产物
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+ H2O
B.CaCO3+2HCl=2NaCl+CO2 +H2O
C.2KMnO4=K2MnO4+MnO2+O2
D.Ca(OH)2+CO2=CaCO3 + H2O
2.下列变化需要加入还原剂的是( )
A.Fe2O3 Fe B.C CO2
C.NaCO3 CO2 D.Al Al2O3
C
A
随堂练习(二)
3.关于氧化还原反应,下列说法正确的是( )
A.被氧化的物质是还原剂 B.氧化剂被氧化,还原剂被还原
C.失去电子后化合价降低的物质是还原剂 D.氧化剂失去电子,化合价升高
解析 依据概念关系判断:还原剂—失电子—化合价升高—被氧化—发生氧化反应—得到氧化产物;氧化剂—得电子—化合价降低—被还原—发生还原反应—得到还原产物。氧化剂被还原,还原剂被氧化,B项错误;失去电子后化合价升高的物质是还原剂,C项错误;氧化剂得到电子,化合价降低,D项错误。
答案 A
作业:
分别用双线桥和单线桥表示下列氧化还原反应的电子转移情况。
① MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
② Cu + 2H2SO4(浓) = CuSO4 + SO2 ↑+2H2O
③ SO2 + 2H2S == 2H2O + 3S
④ 3Cl2 + 8NH3 == 6NH4Cl + N2
⑤ Cl2 + 2NaOH = NaClO + NaCl + H2O
⑥ S + 2KNO3 + 3C = K2S + N2↑ + CO2↑
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
§2.3 氧化还原反应
(第2课时 氧化剂和还原剂)
人教版 必修一
(1)氧化还原反应的特征:
反应前后有元素化合价升降
知识回顾
(2)氧化还原反应的实质是:
电子的转移(得失或偏移)
【复习1】
在反应 MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
Cl
Mn
氧化
还原
氧化
还原
+4 -1 +2 0
氧化剂:在氧化还原反应中,所含元素化合价降低的反应物。氧化剂被还原,发生还原反应。
还原剂:在氧化还原反应中,所含元素化合价升高的反应物。还原剂被氧化,发生氧化反应。
还原产物:氧化剂中元素化合价降低以后得到的产物。
氧化产物:还原剂中元素化合价升高以后得到的产物。
氧化剂 还原剂 还原产物 氧化产物
+2 0 0 +1
化合价降低
化合价升高
CuO + H2 === Cu + H2O
被氧化(氧化反应)
被还原(还原反应)
一.氧化剂和还原剂
1.基本定义:
+2 0 0 +1
化合价降低
化合价升高
CuO + H2 === Cu + H2O
被氧化(氧化反应)
被还原(还原反应)
从电子转移的角度(本质)理解:
氧化剂:所含元素得到电子(或电子对偏向)的反应物。
还原剂:所含元素失去电子(或电子对偏离)的反应物。
氧化剂 还原剂 还原产物 氧化产物
氧化剂具有氧化性,即物质得电子(电子偏向)、化合价降低的性质。
还原剂具有还原性,即物质失电子(电子偏离)、化合价升高的性质。
结论:最高价态……只具氧化性 最低价态……只具还原性
中间价态……兼有氧化性和还原性
失2e-
得2e-
氧化剂
(氧化性)
得到电子
发生还原反应
还原剂
(还原性)
失去电子
化合价升高
发生氧化反应
化合价降低
降得还氧
升失氧还
判断和记忆方法
①活泼的非金属单质如:卤素单质、 O2等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、HNO3、酸性KMnO4。
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。
常见的氧化剂有:
常见的还原剂有:
二、氧化性和还原性
1.氧化性和还原性
(1)氧化性:氧化剂所表现出__________的性质。
(2)还原性:还原剂所表现出__________的性质。
2.氧化性、还原性和元素化合价之间的关系
得电子
失电子
还原
氧化
还原
氧化
练习:从化合价角度分析下列微粒的性质
在Fe3+、Fe2+、Al3+、H+、S、Zn、Cl-等粒子中只有氧化性的是 ,只有还原性的是 ,兼有氧化性和还原性的是 。
Fe3+、Al3+、H+
Zn、Cl-
Fe2+、S
高价氧化低价还,中间价态两性全。
元素常见化合价:
Fe:0, +2, +3 S:-2, 0 ,+4, +6 H:0 ,+1
Al:0 ,+3 Cl:-1 ,0, +1, +5, +7
① Fe2O3 + 3CO 2Fe + 3CO2
② SO2 + 2H2S == 2H2O + 3S
③ Zn + 2HCl == ZnCl2 + H2↑
④ 2KClO3 2KCl+3O2↑
还原剂 氧化剂 氧化产物 还原产物
氧化剂 还原剂 还原产物 氧化产物
氧化剂 还原剂 还原产物与氧化产物
还原剂与氧化剂 还原产物 氧化产物
练习:1. 指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物。
氧化剂 + 还原剂 → 还原产物 + 氧化产物
还原产物
氧化产物
还原反应
氧化反应
化合价降低
化合价升高
得电子
失电子
同时存在
数目相等
数目相等
同时发生
同时存在
(氧化性)
氧化剂
还原剂(还原性)
被还原
被氧化
化价升降须相等,电子转移要守恒。
+2 0 0 +1
得2e-,化合价降低,被还原
失2e-,化合价升高,被氧化
CuO + H2 === Cu + H2O
重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)
双线桥表示法
得电子,化合价降低,被还原(还原反应)
失电子,化合价升高,被氧化(氧化反应)
氧化剂 + 还原剂 → 还原产物 + 氧化产物
用双线桥应注意的事项:
正确判断各反应物、生成物各元素的化合价及其变化
两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
电子符号用“e-”来表示
得失电子总数表示:原子个数 × 每个原子得失电子数
注意:反应中失去电子的总数等于得到电子的总数
氧化还原反应的表示:
(氧化还原反应、 化合价升降、电子转移和总数)
单线桥表示法
表明反应中化合价变化的元素原子间的电子转移情况。 ①单线桥法表示电子转移的基本步骤
总结: 氧化还原反应中电子转移的表示方法
(1)双线桥法:先标化合价,再看价变化;起止同元素,桥上标变化。
(2)单线桥法:确定变化化合价,计算价态的变化;桥上标明电子数,箭头还原到氧化。
重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
【点拨提升】
1.氧化性和还原性强弱的判断方法
(1)根据氧化还原反应的方向判断
氧化还原两性比,剂强于产物之性。
MnO2+4HCl = MnCl2+Cl2 +2H2O
1.指出下列反应中的氧化剂和还原剂,氧化产物和还原产物.
2Na + Cl2 == 2NaCl
CuO + C 2Cu+CO2
高温
2KMnO4 = K2MnO4+MnO2+O2
随堂练习(一)
氧化剂 还原剂 还原产物 氧化产物
还原剂 氧化剂 还原产物和氧化产物
还原剂和氧化剂 还原产物 还原产物 氧化产物
氧化剂 还原剂 还原产物 氧化产物
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl=CuCl2+ H2O
B.CaCO3+2HCl=2NaCl+CO2 +H2O
C.2KMnO4=K2MnO4+MnO2+O2
D.Ca(OH)2+CO2=CaCO3 + H2O
2.下列变化需要加入还原剂的是( )
A.Fe2O3 Fe B.C CO2
C.NaCO3 CO2 D.Al Al2O3
C
A
随堂练习(二)
3.关于氧化还原反应,下列说法正确的是( )
A.被氧化的物质是还原剂 B.氧化剂被氧化,还原剂被还原
C.失去电子后化合价降低的物质是还原剂 D.氧化剂失去电子,化合价升高
解析 依据概念关系判断:还原剂—失电子—化合价升高—被氧化—发生氧化反应—得到氧化产物;氧化剂—得电子—化合价降低—被还原—发生还原反应—得到还原产物。氧化剂被还原,还原剂被氧化,B项错误;失去电子后化合价升高的物质是还原剂,C项错误;氧化剂得到电子,化合价降低,D项错误。
答案 A
作业:
分别用双线桥和单线桥表示下列氧化还原反应的电子转移情况。
① MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
② Cu + 2H2SO4(浓) = CuSO4 + SO2 ↑+2H2O
③ SO2 + 2H2S == 2H2O + 3S
④ 3Cl2 + 8NH3 == 6NH4Cl + N2
⑤ Cl2 + 2NaOH = NaClO + NaCl + H2O
⑥ S + 2KNO3 + 3C = K2S + N2↑ + CO2↑
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
