高中化学人教版必修1第三章3.1.2金属与酸和水的反应(共21张ppt)
文档属性
| 名称 | 高中化学人教版必修1第三章3.1.2金属与酸和水的反应(共21张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 10:03:08 | ||
图片预览








文档简介
(共21张PPT)
第三章 金属及其化合物
第一节 金属的化学性质
第二课时 金属与酸和水的反应
人教版 必修一
写出下列反应的化学方程式
常温下钠与氧气的反应
2.加热的条件下钠与氧气的反应
3.铝与氧气反应
4.镁与氧气的反应
点燃
2Mg+O2====2MgO
点燃
4Al+3O2====2Al2O3
4Na + O2 ==== 2Na2O
2Na + O2 ==== Na2O2
△
我得意的笑,又得意的笑…
无所谓, 我无所谓…
God !Save me!!
为什么受伤的总是我!
思考:观察此图,你有何看法?
结论:金属活动性顺序表中(H)前面的金属与酸反应产生H2。金属越活泼,与酸反应越剧烈。
分别写出Na、Mg、Al、Fe与盐酸反应的化学方程式,其中哪个最快?哪个最慢?为什么?
2Na+2HCl====2NaCl+H2↑
Fe+2HCl====FeCl2+H2↑
Mg+2HCl====MgCl2+H2↑
最慢
最快
2Al+6HCl===2AlCl3+3H2↑
一、金属与酸的反应
从氧化还有反应的角度分析以上反应
请写出Na、Mg、Al分别与盐酸反应的离子方程式:
2Na + 2H+=2Na++ H2↑
Mg + 2H+=2Mg2++ H2↑
2Al + 6H+= 2Al3+ + 3H2↑
金属元素在化学反应中,化合价升高被氧化,表现出较强的还原性
(1)钠与水的反应
实验步骤:
【实验探究1】
钠所在的位置
钠球的运动和大小变化情况
周围水雾的产生以及响声
溶液颜色的变化情况
观察点
实验现象:
实验结论:
1、用镊子取一小块钠置于滤纸上,吸干表面的煤油,用小刀切绿豆大的一粒,其余放回原瓶。
2、在烧杯中加一半水,滴入1~2滴酚酞试剂,并将切下的钠粒投入烧杯中,盖上玻片,观察实验现象。
二、金属与水的反应
密度比水小
钠与水反应放热,钠的熔点低
产生了气体,推动小球四处游动
钠与水反应剧烈
生成了碱性物质
透过现象
实验·探究
实验结论
1、钠的物理性质:
2、钠与水反应:
3、钠的取用:
4、钠的保存:
5、钠的灭火:
银白色金属,密度小、质地软、熔点低,延展性,良好的导电、导热性。
2Na + 2H2O = 2NaOH + H2↑
现象:浮、熔、游、响、红。
用镊子夹取,用完的钠放回原瓶。
煤油或石蜡油中。
不能用水,只能用干沙盖灭。
1.钠与水反应的化学方程式
______________
2.钠与水反应的离子方程式
_______________
3.用单线桥法表示反应中的电子转移,并标出氧化剂和
还原剂
_________________________
2Na+2H2O====2NaOH+H2↑
2Na+2H2O====2Na++2OH-+H2↑
还原剂
氧化剂
2
e
-
2Na + 2H2O====2NaOH+H2↑
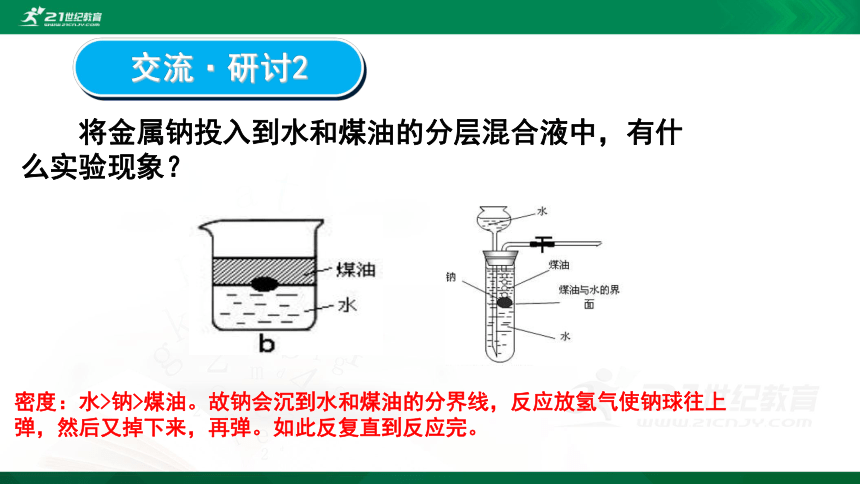
交流·研讨2
将金属钠投入到水和煤油的分层混合液中,有什么实验现象?
密度:水>钠>煤油。故钠会沉到水和煤油的分界线,反应放氢气使钠球往上弹,然后又掉下来,再弹。如此反复直到反应完。
交流·研讨3
(1)将金属钠投到CuSO4溶液中会有什么现象?为什么?
现象:浮、游、熔、响、蓝色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
交流·研讨3
(2)将金属钠投到FeCl3溶液中会有什么现象?为什么?
现象:浮、游、熔、响、红褐色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
注意:钠在盐溶液中,先水后盐
钠在酸溶液中,先酸后水
铁是否与冷水、热水反应?
设计实验验证铁是否与水蒸气反应?
从右图中选择仪器进行组装,验证铁与水蒸气是否反应:
A
B
C
D
E
(2)铁与水蒸气的反应
H2
H2
金属与水反应
2Na+2H2O=2NaOH+H2↑
100℃
2Al+6H2O===2Al(OH)3+3H2 ↑
Mg+2H2O===Mg(OH)2+H2↑
?
金属性越强,越容易与水反应
【小结】
3Fe+4H2O(g)===Fe3O4+4H2
高温
金属与水反应的规律
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
与冷水反应生成碱和氢气
与热水反应生成碱和氢气
高温下与水蒸气反应生成氧化物和氢气
不与水反应
金属性越强,常温下与水反应越强烈。
【总结】
小 结
2、钠与水的反应:
2Na + 2H+=2 Na++ H2↑
金属与酸和水的反应
1、与酸的反应:
Mg + 2H+=2Mg2++ H2↑
2Al + 6H+= 2Al3+ + 3H2↑
2Na + 2H2O = 2Na++ 2OH- + H2↑
现象:浮、熔、游、响、红。
3、铁与水的反应:
3Fe + 4H2O = Fe3O4+ 4H2↑
高温
1.金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是( )
①密度较小 ②熔点较低 ③硬度较小
④还原性强 ⑤该反应生成相应的碱
⑥该反应是放热反应
A.①②③④⑤ B.①②④⑤⑥
C.除③⑥之外 D.全部
B
1.取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,回答:
(1)钠在溶液中反应的实验现象是 ;
(2)反应的化学方程式是 。
【答案】(1)钠浮在液面上,很快熔化成小球,钠球在水
面上四处游动,并发出嘶嘶的响声,溶液中有蓝色沉淀产生
(2)2Na+2H2O====2NaOH+H2↑
2NaOH+CuSO4====Na2SO4+Cu(OH)2↓(蓝色)
3.钠与水反应的现象和钠的下列性质无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
【解析】 钠和水反应时,钠能熔化成小球,说明反应是放热的,同时也说明钠的熔点低,钠浮在水面上,说明钠的密度小于水,与水剧烈反应生成氢氧化钠和氢气,钠表现出强还原性,选C。
【答案】 C
4.将一小块钠投入下列溶液中,既能产生气体又会出现白色沉淀的是( )
A.稀H2SO4 B.氢氧化钠溶液
C.硫酸铜溶液 D.氯化镁溶液
【解析】 A.Na与稀硫酸反应只生成气体,错误;B.Na与氢氧化钠溶液反应只生成气体,错误;C.钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀,气体和硫酸钠,错误;D.钠与氯化镁溶液反应生成氢氧化镁白色沉淀,无色气体和氯化钠,正确;选D。
【答案】 D
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第三章 金属及其化合物
第一节 金属的化学性质
第二课时 金属与酸和水的反应
人教版 必修一
写出下列反应的化学方程式
常温下钠与氧气的反应
2.加热的条件下钠与氧气的反应
3.铝与氧气反应
4.镁与氧气的反应
点燃
2Mg+O2====2MgO
点燃
4Al+3O2====2Al2O3
4Na + O2 ==== 2Na2O
2Na + O2 ==== Na2O2
△
我得意的笑,又得意的笑…
无所谓, 我无所谓…
God !Save me!!
为什么受伤的总是我!
思考:观察此图,你有何看法?
结论:金属活动性顺序表中(H)前面的金属与酸反应产生H2。金属越活泼,与酸反应越剧烈。
分别写出Na、Mg、Al、Fe与盐酸反应的化学方程式,其中哪个最快?哪个最慢?为什么?
2Na+2HCl====2NaCl+H2↑
Fe+2HCl====FeCl2+H2↑
Mg+2HCl====MgCl2+H2↑
最慢
最快
2Al+6HCl===2AlCl3+3H2↑
一、金属与酸的反应
从氧化还有反应的角度分析以上反应
请写出Na、Mg、Al分别与盐酸反应的离子方程式:
2Na + 2H+=2Na++ H2↑
Mg + 2H+=2Mg2++ H2↑
2Al + 6H+= 2Al3+ + 3H2↑
金属元素在化学反应中,化合价升高被氧化,表现出较强的还原性
(1)钠与水的反应
实验步骤:
【实验探究1】
钠所在的位置
钠球的运动和大小变化情况
周围水雾的产生以及响声
溶液颜色的变化情况
观察点
实验现象:
实验结论:
1、用镊子取一小块钠置于滤纸上,吸干表面的煤油,用小刀切绿豆大的一粒,其余放回原瓶。
2、在烧杯中加一半水,滴入1~2滴酚酞试剂,并将切下的钠粒投入烧杯中,盖上玻片,观察实验现象。
二、金属与水的反应
密度比水小
钠与水反应放热,钠的熔点低
产生了气体,推动小球四处游动
钠与水反应剧烈
生成了碱性物质
透过现象
实验·探究
实验结论
1、钠的物理性质:
2、钠与水反应:
3、钠的取用:
4、钠的保存:
5、钠的灭火:
银白色金属,密度小、质地软、熔点低,延展性,良好的导电、导热性。
2Na + 2H2O = 2NaOH + H2↑
现象:浮、熔、游、响、红。
用镊子夹取,用完的钠放回原瓶。
煤油或石蜡油中。
不能用水,只能用干沙盖灭。
1.钠与水反应的化学方程式
______________
2.钠与水反应的离子方程式
_______________
3.用单线桥法表示反应中的电子转移,并标出氧化剂和
还原剂
_________________________
2Na+2H2O====2NaOH+H2↑
2Na+2H2O====2Na++2OH-+H2↑
还原剂
氧化剂
2
e
-
2Na + 2H2O====2NaOH+H2↑
交流·研讨2
将金属钠投入到水和煤油的分层混合液中,有什么实验现象?
密度:水>钠>煤油。故钠会沉到水和煤油的分界线,反应放氢气使钠球往上弹,然后又掉下来,再弹。如此反复直到反应完。
交流·研讨3
(1)将金属钠投到CuSO4溶液中会有什么现象?为什么?
现象:浮、游、熔、响、蓝色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
交流·研讨3
(2)将金属钠投到FeCl3溶液中会有什么现象?为什么?
现象:浮、游、熔、响、红褐色沉淀
反应:2Na + 2H2O = 2NaOH + H2↑
3NaOH + FeCl3 = Fe(OH)3↓+ 3NaCl
注意:钠在盐溶液中,先水后盐
钠在酸溶液中,先酸后水
铁是否与冷水、热水反应?
设计实验验证铁是否与水蒸气反应?
从右图中选择仪器进行组装,验证铁与水蒸气是否反应:
A
B
C
D
E
(2)铁与水蒸气的反应
H2
H2
金属与水反应
2Na+2H2O=2NaOH+H2↑
100℃
2Al+6H2O===2Al(OH)3+3H2 ↑
Mg+2H2O===Mg(OH)2+H2↑
?
金属性越强,越容易与水反应
【小结】
3Fe+4H2O(g)===Fe3O4+4H2
高温
金属与水反应的规律
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
与冷水反应生成碱和氢气
与热水反应生成碱和氢气
高温下与水蒸气反应生成氧化物和氢气
不与水反应
金属性越强,常温下与水反应越强烈。
【总结】
小 结
2、钠与水的反应:
2Na + 2H+=2 Na++ H2↑
金属与酸和水的反应
1、与酸的反应:
Mg + 2H+=2Mg2++ H2↑
2Al + 6H+= 2Al3+ + 3H2↑
2Na + 2H2O = 2Na++ 2OH- + H2↑
现象:浮、熔、游、响、红。
3、铁与水的反应:
3Fe + 4H2O = Fe3O4+ 4H2↑
高温
1.金属钠和水(含几滴酚酞)的反应是一个重要的实验,能从该实验获得的信息中说明金属钠具有的性质是( )
①密度较小 ②熔点较低 ③硬度较小
④还原性强 ⑤该反应生成相应的碱
⑥该反应是放热反应
A.①②③④⑤ B.①②④⑤⑥
C.除③⑥之外 D.全部
B
1.取黄豆粒大小的一块金属钠,用滤纸擦干其表面的煤油,然后加入到硫酸铜溶液中,回答:
(1)钠在溶液中反应的实验现象是 ;
(2)反应的化学方程式是 。
【答案】(1)钠浮在液面上,很快熔化成小球,钠球在水
面上四处游动,并发出嘶嘶的响声,溶液中有蓝色沉淀产生
(2)2Na+2H2O====2NaOH+H2↑
2NaOH+CuSO4====Na2SO4+Cu(OH)2↓(蓝色)
3.钠与水反应的现象和钠的下列性质无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
【解析】 钠和水反应时,钠能熔化成小球,说明反应是放热的,同时也说明钠的熔点低,钠浮在水面上,说明钠的密度小于水,与水剧烈反应生成氢氧化钠和氢气,钠表现出强还原性,选C。
【答案】 C
4.将一小块钠投入下列溶液中,既能产生气体又会出现白色沉淀的是( )
A.稀H2SO4 B.氢氧化钠溶液
C.硫酸铜溶液 D.氯化镁溶液
【解析】 A.Na与稀硫酸反应只生成气体,错误;B.Na与氢氧化钠溶液反应只生成气体,错误;C.钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀,气体和硫酸钠,错误;D.钠与氯化镁溶液反应生成氢氧化镁白色沉淀,无色气体和氯化钠,正确;选D。
【答案】 D
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
