高中化学人教版必修1第三章第一节3.1.3铝与氢氧化钠溶液反应课件(共18张ppt)
文档属性
| 名称 | 高中化学人教版必修1第三章第一节3.1.3铝与氢氧化钠溶液反应课件(共18张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
第三章金属及其化合物
第一节 金属的化学性质
第3课时铝与氢氧化钠溶液的反应
人教版 必修一
知识回顾
1、物理性质
银白色
固态
良好
良好
较小
2、化学性质
Al3+
易失去最外层e-
Al
铝原子易失电子
显较强还原性
是活泼的金属
有气泡冒出
慢慢溶解
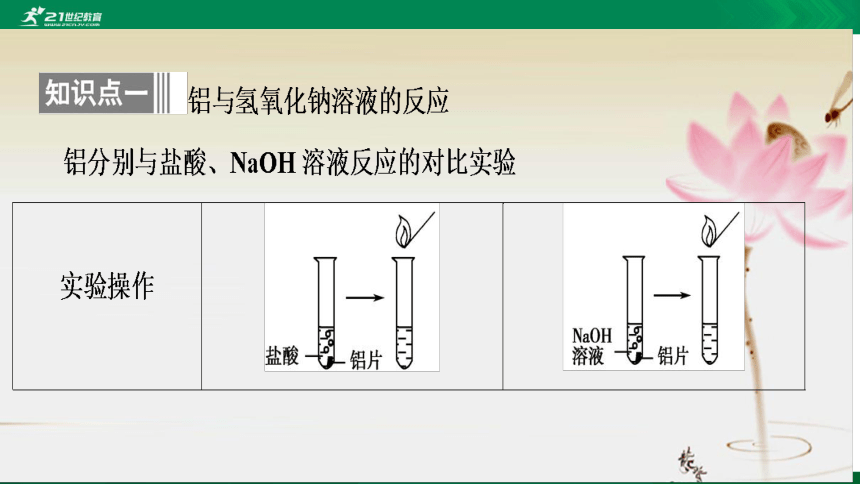
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===
2NaAlO2+3H2↑
2Al+6H+===2Al3++3H2↑
爆鸣
[自我诊断]
判断下列说法正误(正确的打“√”,错误的打“×”)。
(1)铝和盐酸、NaOH溶液的反应中,铝都失去电子。
(2)等体积等浓度的盐酸、NaOH溶液与过量Al反应,产生H2的物质的量相等。
(3)铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2。
(4)等物质的量的Al与足量的盐酸、稀硫酸、KOH溶液反应,产生的H2的物质的量相等。
(5)Al能和一切酸、碱、盐发生反应。
√
√
√
×
×
资料表明:铝盐可能导致人的记忆力丧失。世界卫生组织提出人体每天的摄铝量不应超过1mg/kg体重,一般情况下,一个人每天摄取的铝量绝不会超过这个量。
化学与生活
各物质的粒子数
各物质的物质的量
气体的体积
化学计量数之比=粒子数之比 =物质的量之比
对于气体, 在同温同压下, 化学计量数之比=气体的体积之比
[自我诊断]
判断下列说法正误(正确的打“”,错误的打“×”)。 (1)物质在化学反应中物质的量一定保持不变
(2)化学方程式4Na+O2===2Na2O可表示4 mol钠原子和1 mol氧气分子生成2 mol氧化钠。
(3)根据离子方程式Mg+2H+===Mg2++H2↑可知1 g镁与足量氢离子反应可生成1 mol氢气。
(4)根据化学方程式2Na+2H2O===2NaOH+H2↑可知2 mol钠与足量水反应生成22.4 L氢气。
2CO + O2 = 2CO2
分子个数比
2 : 1 : 2
扩大6.02×1023倍
2×6.02×1023 : 6.02×1023 : 2×6.02×1023
物质的量之比
2mol :1mol : 2mol
质量之比
56g : 32g : 88g
化学计量数之比
2 : 1 : 2
体积之比
2 : 1 : 2
交流·研讨
1、标准状况下,把2.7g铝放入足量NaOH溶液中,铝完全反应。计算:
(1)参加反应的NaOH的物质的量;
(2)产生H2的体积。
/67.2L
0.1mol
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2mol
2mol
3mol
0.1mol
0.15mol
/3. 36L
迁移·应用
2. 完全中和 0.10 mol NaOH 需 H2SO4 的质量是多少?
解法一:
(1)写出有关反应的化学方程式
2NaOH+H2SO4=Na2SO4+2H2O
(2)计量数之比 2 1
(3)相关物质的物质的量 0.1 mol n(H2SO4)
(4)根据原理进行计算
2
1
0.1 mol
n(H2SO4)
=
得出: n(H2SO4)= =0.05 mol
m(H2SO4)=0.05 mol×98 g/mol =4.9 g
1×0.10 mol
2
解法二:
2NaOH+H2SO4=Na2SO4+2H2O
2 mol 98 g
0.1 mol m(H2SO4)
m(H2SO4)= =4.9 g
98 g×0.1 mol
2 mol
1.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O====Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH?====AlO2?+H2?
C.金属铝溶于盐酸中:2Al+6H+====2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+====Fe3++H2?
2.下列有关厨房中铝制品使用合理的是( )
A.盛放食醋 B.烧煮开水
C.用碱水洗涤 D.用金属丝擦洗表面的污垢
C
B
练习
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第三章金属及其化合物
第一节 金属的化学性质
第3课时铝与氢氧化钠溶液的反应
人教版 必修一
知识回顾
1、物理性质
银白色
固态
良好
良好
较小
2、化学性质
Al3+
易失去最外层e-
Al
铝原子易失电子
显较强还原性
是活泼的金属
有气泡冒出
慢慢溶解
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===
2NaAlO2+3H2↑
2Al+6H+===2Al3++3H2↑
爆鸣
[自我诊断]
判断下列说法正误(正确的打“√”,错误的打“×”)。
(1)铝和盐酸、NaOH溶液的反应中,铝都失去电子。
(2)等体积等浓度的盐酸、NaOH溶液与过量Al反应,产生H2的物质的量相等。
(3)铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2。
(4)等物质的量的Al与足量的盐酸、稀硫酸、KOH溶液反应,产生的H2的物质的量相等。
(5)Al能和一切酸、碱、盐发生反应。
√
√
√
×
×
资料表明:铝盐可能导致人的记忆力丧失。世界卫生组织提出人体每天的摄铝量不应超过1mg/kg体重,一般情况下,一个人每天摄取的铝量绝不会超过这个量。
化学与生活
各物质的粒子数
各物质的物质的量
气体的体积
化学计量数之比=粒子数之比 =物质的量之比
对于气体, 在同温同压下, 化学计量数之比=气体的体积之比
[自我诊断]
判断下列说法正误(正确的打“”,错误的打“×”)。 (1)物质在化学反应中物质的量一定保持不变
(2)化学方程式4Na+O2===2Na2O可表示4 mol钠原子和1 mol氧气分子生成2 mol氧化钠。
(3)根据离子方程式Mg+2H+===Mg2++H2↑可知1 g镁与足量氢离子反应可生成1 mol氢气。
(4)根据化学方程式2Na+2H2O===2NaOH+H2↑可知2 mol钠与足量水反应生成22.4 L氢气。
2CO + O2 = 2CO2
分子个数比
2 : 1 : 2
扩大6.02×1023倍
2×6.02×1023 : 6.02×1023 : 2×6.02×1023
物质的量之比
2mol :1mol : 2mol
质量之比
56g : 32g : 88g
化学计量数之比
2 : 1 : 2
体积之比
2 : 1 : 2
交流·研讨
1、标准状况下,把2.7g铝放入足量NaOH溶液中,铝完全反应。计算:
(1)参加反应的NaOH的物质的量;
(2)产生H2的体积。
/67.2L
0.1mol
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
2mol
2mol
3mol
0.1mol
0.15mol
/3. 36L
迁移·应用
2. 完全中和 0.10 mol NaOH 需 H2SO4 的质量是多少?
解法一:
(1)写出有关反应的化学方程式
2NaOH+H2SO4=Na2SO4+2H2O
(2)计量数之比 2 1
(3)相关物质的物质的量 0.1 mol n(H2SO4)
(4)根据原理进行计算
2
1
0.1 mol
n(H2SO4)
=
得出: n(H2SO4)= =0.05 mol
m(H2SO4)=0.05 mol×98 g/mol =4.9 g
1×0.10 mol
2
解法二:
2NaOH+H2SO4=Na2SO4+2H2O
2 mol 98 g
0.1 mol m(H2SO4)
m(H2SO4)= =4.9 g
98 g×0.1 mol
2 mol
1.下列反应的离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O====Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH?====AlO2?+H2?
C.金属铝溶于盐酸中:2Al+6H+====2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+====Fe3++H2?
2.下列有关厨房中铝制品使用合理的是( )
A.盛放食醋 B.烧煮开水
C.用碱水洗涤 D.用金属丝擦洗表面的污垢
C
B
练习
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
