高中化学人教版必修1第三章第二节3.2.1钠的重要化合物课件(共28张ppt)
文档属性
| 名称 | 高中化学人教版必修1第三章第二节3.2.1钠的重要化合物课件(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 10:39:54 | ||
图片预览








文档简介
(共28张PPT)
第二节 几种重要的金属化合物
第1课时:钠的重要化合物
第三章 金属及其化合物
人教版 必修一
2.写出下列变化的化学反应方程式。
①金属钠在空气中表面变暗;
②金属钠在空气中加热;
③金属钠投入纯水中;
④金属铝投入NaOH溶液中
1.为什么多数金属在自然界中都以化合态形式存在?
2Na + O2 = Na2O2
4Na + O2 = 2Na2O
2Na + 2H2O = 2NaOH + H2↑
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
复习·回顾
绝大多数金属的化学性质活泼,在自然界中以化合态的形式存在
钠都可以和哪些物质发生化学反应?
钠和非金属单质的反应(Cl2、O2、S等)、钠与水的反应、与酸反应、与盐溶液反应
复习氢氧化钠的性质:
(4)与盐反应: 3OH- +Fe3+ = Fe(OH)3↓
(3)与酸反应:OH- + H+ = H2O
(2)与酸性氧化物反应: CO2 +2 OH- = CO32-+ H2O
(1)与酸碱指示剂反应:使无色酚酞变红;使紫色石蕊变蓝;
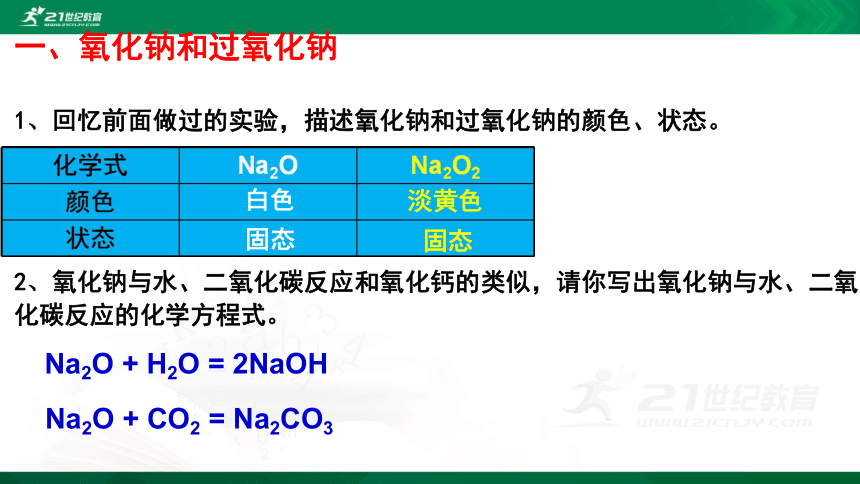
一、氧化钠和过氧化钠
1、回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
白色
淡黄色
固态
固态
Na2O + H2O = 2NaOH
2、氧化钠与水、二氧化碳反应和氧化钙的类似,请你写出氧化钠与水、二氧化碳反应的化学方程式。
Na2O + CO2 = Na2CO3
1、把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象?
实验3-5
滴水 生火,
实验:
吹气能生火
2、取一小块脱脂棉与石棉网上,再取半角匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。观察现象。
现象:
1.有气泡产生,放热,
放出的气体能使带火星的木条复燃,
溶液中滴入酚酞后变红。
2、放热,脱脂棉燃烧起来
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2
实验3-5
过氧化钠与二氧化碳反应的化学方程式:
过氧化钠与水反应的化学方程式:
2Na2O2+2H2O = 4NaOH+O2↑
化合价升高,失去2e-,被氧化
化合价降低,得到2e-,被还原
-1 -2 0
Na2O2既是氧化剂又是还原剂,
Na2O2是强氧化剂。
用途:可做漂白剂 (强氧化性漂白)
O2 是氧化产物 NaOH是还原产物
2Na2O2+2CO2=2Na2CO3 +O2
化合价升高,失去2e-,被氧化
化合价降低,得到2e-,被还原
-1 -2 0
应用:
呼吸面具或潜艇中的供氧剂。
Na2O2既是氧化剂又是还原剂
过氧化钠的用途
过氧化钠的用途
氧化钠与过氧化钠的比较
淡黄色固体
白色固体
-2价 -1价
常温 点燃
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
否
是
Na2O+2HCl=
2NaCl+H2O
2Na2O2 + 4HCl =4NaCl +
2H2O + O2 ↑
二、碳酸钠和碳酸氢钠的性质
碳酸钠俗名纯碱,也叫苏打。碳酸氢钠俗名小苏打。
碳酸钠晶体的化学式是______________ ,
碳酸钠晶体在干燥的空气中容易失去________变成碳酸钠粉末。
碳酸钠和
碳酸氢钠
的性质
科学探究
在水中的电离方程式:
Na2CO3· 10H2O
结晶水
1(1)各取1小匙的Na2CO3 NaHCO3于试管中,观察二者外观上的细小区别,滴加10滴水,振荡,观察,用手摸一摸试管外壁,有什么感觉?
(2)继续向试管内加入约10mL水,振荡,观察、记录现象。
(3)分别加2滴酚酞溶液,
比较溶液颜色。
实验方案
1.Na2CO3和NaHCO3的溶解性和碱性
初步结论
③滴加
酚酞
②加水、
溶解
①称量、
滴水
NaHCO3
Na2CO3
白色粉末,加水结变成晶体;放热明显
细小白色粉末,加水部分溶解;感受不到热量变化
振荡可以溶解完
振荡部分溶解,固体量减小
溶液变红(较深)
溶液变微红色
溶解度大,溶液的碱性比NaHCO3强
溶解度小,溶液的碱性比Na2CO3弱
2.Na2CO3和NaHCO3的热稳定性
—————————
发生反应的化学方程式
NaHCO3
Na2CO3
结论
现象
稳定
不稳定
无明显现象
产生水珠、气体(使澄清石灰水变浑浊)
取等量的碳酸钠和碳酸氢钠(约1g)分别置于两支试管,同时加热,烧杯A和烧杯B的现象。
现象:烧杯A无变化,烧杯B中溶液变浑浊
3、在两根试管中分别加入2mL稀盐酸,将等量(1/3药匙)的碳酸钠和碳酸氢钠加入试管中。
注意:比较反应的剧烈程度。
NaHCO3
Na2CO3
Na2CO3+2HCl=2NaCl+ H2O+CO2↑
CO32 -+2H+= H2O + CO2↑
NaHCO3+HCl=NaCl+ H2O + CO2↑
HCO3-+H+=H2O+CO2 ↑
结论:碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。
2NaHCO3=Na2CO3+H2O+CO2↑
化学式
Na2CO3
NaHCO3
俗名
苏打、纯碱
小苏打
色、态
白色粉末
白色细小晶体
溶解度大小
溶解度:Na2CO3 >NaHCO3
水溶液碱性
碱性(同浓度):Na2CO3>NaHCO3
与酸反应
离子方程式
NaHCO3比Na2CO3快
HCO3-+H+=H2O+CO2↑
热稳定性
热稳定性:Na2CO3>NaHCO3
CO32-+2H+=H2O+CO2↑
碳酸钠和碳酸氢钠的性质比较
想一想:如何区别Na2CO3和NaHCO3?
①加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3
②滴入CaCl2或BaCl2溶液
产生白色沉淀的是Na2CO3
③逐滴滴入稀盐酸
反应较剧烈的是NaHCO3
碳酸钠和碳酸氢钠的相互转变
2NaHCO3 = Na2CO3 + H2O + CO2
△
Na2CO3 + CO2 + H2O = 2NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
固体
溶液
溶液
CO2 + H2O
加OH—或△
NaHCO3
酸式盐
Na2CO3
正盐
碳酸钠和碳酸氢钠的用途
焰色反应
三、
焰色反应 —— 金属或它们的化合物在灼烧时 使火焰呈现特殊的颜色,叫焰色反应(是物理现象,不是化学变化,没有生成新的物质)。
常见金属元素或金属离子的焰色
钠——黄色
钾——紫色(透过蓝色的钴玻璃)
铜——绿色
钙——砖红色
注意:
1)无论是金属的单质还是化合物,其焰色都相同;
2)金属的化合物无论是溶液中还是固体,其焰色相同。
应用—— 可用于鉴别物质中含有哪种金属元素、溶液中含有哪种金属阳离子
是指元素的性质
铯的焰色
钠黄色
铜 绿色
钾紫色
钙砖红色
铷的焰色
锶洋红色
钡黄绿色
小结:
一、过氧化钠
1、与水反应: 2Na2O2+2H2O=4NaOH+O2↑
2、与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2
(有强氧化性、漂白性)
二、碳酸钠和碳酸氢钠
1、与酸反应:CO32- + 2H+ = H2O+CO2↑
HCO3- + H+ = H2O+CO2 ↑
2、受热分解:2NaHCO3==Na2CO3+H2O+CO2 ↑
△
三、焰色反应:钠—黄
钾—紫(蓝色钴玻璃)
练习
1、现有两瓶失去标签的Na2CO3和NaHCO3
固体,你能用几种方法将它们区分开来?
2、在饱和Na2CO3溶液中,吹入CO2气体,
可能会有什么现象?
(Na2CO3+H2O+CO2==2NaHCO3)
答:看状态,溶解性,热稳定性,与酸反
应快慢,强碱溶液等。
答:析出白色晶体(溶解度差别)。
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第二节 几种重要的金属化合物
第1课时:钠的重要化合物
第三章 金属及其化合物
人教版 必修一
2.写出下列变化的化学反应方程式。
①金属钠在空气中表面变暗;
②金属钠在空气中加热;
③金属钠投入纯水中;
④金属铝投入NaOH溶液中
1.为什么多数金属在自然界中都以化合态形式存在?
2Na + O2 = Na2O2
4Na + O2 = 2Na2O
2Na + 2H2O = 2NaOH + H2↑
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
复习·回顾
绝大多数金属的化学性质活泼,在自然界中以化合态的形式存在
钠都可以和哪些物质发生化学反应?
钠和非金属单质的反应(Cl2、O2、S等)、钠与水的反应、与酸反应、与盐溶液反应
复习氢氧化钠的性质:
(4)与盐反应: 3OH- +Fe3+ = Fe(OH)3↓
(3)与酸反应:OH- + H+ = H2O
(2)与酸性氧化物反应: CO2 +2 OH- = CO32-+ H2O
(1)与酸碱指示剂反应:使无色酚酞变红;使紫色石蕊变蓝;
一、氧化钠和过氧化钠
1、回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
白色
淡黄色
固态
固态
Na2O + H2O = 2NaOH
2、氧化钠与水、二氧化碳反应和氧化钙的类似,请你写出氧化钠与水、二氧化碳反应的化学方程式。
Na2O + CO2 = Na2CO3
1、把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象?
实验3-5
滴水 生火,
实验:
吹气能生火
2、取一小块脱脂棉与石棉网上,再取半角匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。观察现象。
现象:
1.有气泡产生,放热,
放出的气体能使带火星的木条复燃,
溶液中滴入酚酞后变红。
2、放热,脱脂棉燃烧起来
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2 =2Na2CO3+O2
实验3-5
过氧化钠与二氧化碳反应的化学方程式:
过氧化钠与水反应的化学方程式:
2Na2O2+2H2O = 4NaOH+O2↑
化合价升高,失去2e-,被氧化
化合价降低,得到2e-,被还原
-1 -2 0
Na2O2既是氧化剂又是还原剂,
Na2O2是强氧化剂。
用途:可做漂白剂 (强氧化性漂白)
O2 是氧化产物 NaOH是还原产物
2Na2O2+2CO2=2Na2CO3 +O2
化合价升高,失去2e-,被氧化
化合价降低,得到2e-,被还原
-1 -2 0
应用:
呼吸面具或潜艇中的供氧剂。
Na2O2既是氧化剂又是还原剂
过氧化钠的用途
过氧化钠的用途
氧化钠与过氧化钠的比较
淡黄色固体
白色固体
-2价 -1价
常温 点燃
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
否
是
Na2O+2HCl=
2NaCl+H2O
2Na2O2 + 4HCl =4NaCl +
2H2O + O2 ↑
二、碳酸钠和碳酸氢钠的性质
碳酸钠俗名纯碱,也叫苏打。碳酸氢钠俗名小苏打。
碳酸钠晶体的化学式是______________ ,
碳酸钠晶体在干燥的空气中容易失去________变成碳酸钠粉末。
碳酸钠和
碳酸氢钠
的性质
科学探究
在水中的电离方程式:
Na2CO3· 10H2O
结晶水
1(1)各取1小匙的Na2CO3 NaHCO3于试管中,观察二者外观上的细小区别,滴加10滴水,振荡,观察,用手摸一摸试管外壁,有什么感觉?
(2)继续向试管内加入约10mL水,振荡,观察、记录现象。
(3)分别加2滴酚酞溶液,
比较溶液颜色。
实验方案
1.Na2CO3和NaHCO3的溶解性和碱性
初步结论
③滴加
酚酞
②加水、
溶解
①称量、
滴水
NaHCO3
Na2CO3
白色粉末,加水结变成晶体;放热明显
细小白色粉末,加水部分溶解;感受不到热量变化
振荡可以溶解完
振荡部分溶解,固体量减小
溶液变红(较深)
溶液变微红色
溶解度大,溶液的碱性比NaHCO3强
溶解度小,溶液的碱性比Na2CO3弱
2.Na2CO3和NaHCO3的热稳定性
—————————
发生反应的化学方程式
NaHCO3
Na2CO3
结论
现象
稳定
不稳定
无明显现象
产生水珠、气体(使澄清石灰水变浑浊)
取等量的碳酸钠和碳酸氢钠(约1g)分别置于两支试管,同时加热,烧杯A和烧杯B的现象。
现象:烧杯A无变化,烧杯B中溶液变浑浊
3、在两根试管中分别加入2mL稀盐酸,将等量(1/3药匙)的碳酸钠和碳酸氢钠加入试管中。
注意:比较反应的剧烈程度。
NaHCO3
Na2CO3
Na2CO3+2HCl=2NaCl+ H2O+CO2↑
CO32 -+2H+= H2O + CO2↑
NaHCO3+HCl=NaCl+ H2O + CO2↑
HCO3-+H+=H2O+CO2 ↑
结论:碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。
2NaHCO3=Na2CO3+H2O+CO2↑
化学式
Na2CO3
NaHCO3
俗名
苏打、纯碱
小苏打
色、态
白色粉末
白色细小晶体
溶解度大小
溶解度:Na2CO3 >NaHCO3
水溶液碱性
碱性(同浓度):Na2CO3>NaHCO3
与酸反应
离子方程式
NaHCO3比Na2CO3快
HCO3-+H+=H2O+CO2↑
热稳定性
热稳定性:Na2CO3>NaHCO3
CO32-+2H+=H2O+CO2↑
碳酸钠和碳酸氢钠的性质比较
想一想:如何区别Na2CO3和NaHCO3?
①加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3
②滴入CaCl2或BaCl2溶液
产生白色沉淀的是Na2CO3
③逐滴滴入稀盐酸
反应较剧烈的是NaHCO3
碳酸钠和碳酸氢钠的相互转变
2NaHCO3 = Na2CO3 + H2O + CO2
△
Na2CO3 + CO2 + H2O = 2NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
固体
溶液
溶液
CO2 + H2O
加OH—或△
NaHCO3
酸式盐
Na2CO3
正盐
碳酸钠和碳酸氢钠的用途
焰色反应
三、
焰色反应 —— 金属或它们的化合物在灼烧时 使火焰呈现特殊的颜色,叫焰色反应(是物理现象,不是化学变化,没有生成新的物质)。
常见金属元素或金属离子的焰色
钠——黄色
钾——紫色(透过蓝色的钴玻璃)
铜——绿色
钙——砖红色
注意:
1)无论是金属的单质还是化合物,其焰色都相同;
2)金属的化合物无论是溶液中还是固体,其焰色相同。
应用—— 可用于鉴别物质中含有哪种金属元素、溶液中含有哪种金属阳离子
是指元素的性质
铯的焰色
钠黄色
铜 绿色
钾紫色
钙砖红色
铷的焰色
锶洋红色
钡黄绿色
小结:
一、过氧化钠
1、与水反应: 2Na2O2+2H2O=4NaOH+O2↑
2、与CO2反应:2Na2O2+2CO2=2Na2CO3 +O2
(有强氧化性、漂白性)
二、碳酸钠和碳酸氢钠
1、与酸反应:CO32- + 2H+ = H2O+CO2↑
HCO3- + H+ = H2O+CO2 ↑
2、受热分解:2NaHCO3==Na2CO3+H2O+CO2 ↑
△
三、焰色反应:钠—黄
钾—紫(蓝色钴玻璃)
练习
1、现有两瓶失去标签的Na2CO3和NaHCO3
固体,你能用几种方法将它们区分开来?
2、在饱和Na2CO3溶液中,吹入CO2气体,
可能会有什么现象?
(Na2CO3+H2O+CO2==2NaHCO3)
答:看状态,溶解性,热稳定性,与酸反
应快慢,强碱溶液等。
答:析出白色晶体(溶解度差别)。
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
