高中化学人教版必修1第四章第一节4.1.1无机非金属材料的主角--硅(共30张ppt)
文档属性
| 名称 | 高中化学人教版必修1第四章第一节4.1.1无机非金属材料的主角--硅(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 10:46:49 | ||
图片预览










文档简介
(共30张PPT)
第四章 非金属及其化合物
4.1无机非金属材料的主角-硅
4.1.1二氧化硅和硅酸
人教版 必修一
科学视野
美国的硅谷——“斯坦福科研工业区”是美国电子和计算机工业中心,位于美国西海岸加利福尼亚州北部旧金山南郊,圣克拉拉县和圣安两城之间的一条长48公里,宽16公里的长条形地带上。由于它集中了全世界90%以上的著名半导体公司,而半导体的基本元件是硅片,所以该地区被称为“硅谷”。
硅谷 silicon valley
胡
你知道吗?
Si元素在地壳中的含量排在第几位?
氧48.6%
硅26.3%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
镁2.00%
氢0.16%
其他1.20%
科学视野
锦绣中华
主要成份:
SiO2
主要成份:
SiO2
硅的存在与分布:硅在地壳中含量第二,硅的氧化物及硅酸盐约占地壳质量的90%以上。没有游离态,只有化合态(因为它是亲氧元素);自然界中分布广泛,是构成矿物和岩石的基本元素。
思考、讨论:C、Si原子结构相似,那么C、Si性质一样吗 ?
C
Si
碳、硅的最外层有四个电子,既不易失去电子,也不易得到电子,所以硅的化学性质不如碳活泼,主要形成四价化合物,碳和硅都是亲氧元素但是硅的亲氧能力更强。因此碳和硅在自然界中存在形式有所不同。
你能画出碳和硅原子结构示意图吗?
一.硅单质
1、存在:
2、物理性质:
导电性介于导体和绝缘体之间。
在自然界中,没有游离态的硅,只有化合态的硅。单质硅有晶体硅和无定形硅两种。
晶体硅的结构类似于金刚石,熔点(1410℃)和沸点都很高,硬度大。
1、存在
二、二氧化硅( SiO2 )
广泛存在于自然界,与其他矿物共同构成了岩石。天然二氧化硅也叫硅石。
一、二氧化硅和硅酸
1、二氧化硅( SiO2)
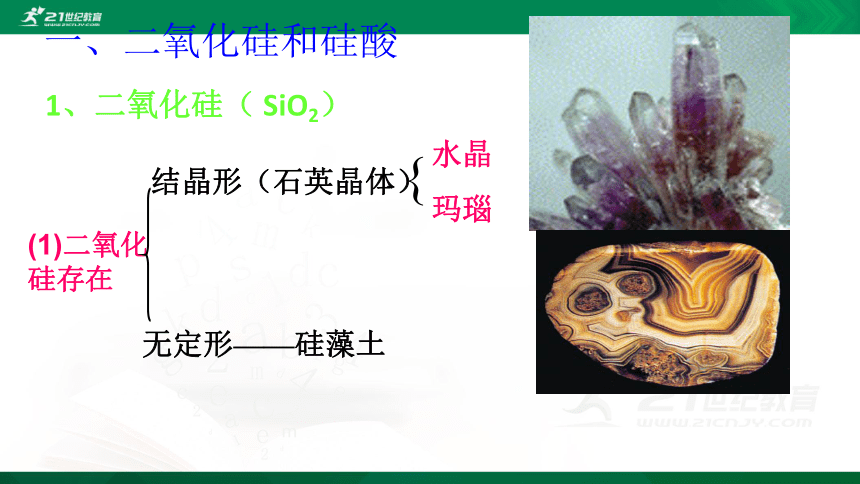
(1)二氧化硅存在
结晶形(石英晶体)
无定形——硅藻土
{
水晶
玛瑙
正四面体
空间网状结构
硅氧原子比例:1 : 2
没有SiO2 分子存在,
只存在硅氧原子
硅原子——
[SiO2]四面体
科学视野
(二)二氧化硅的结构
其性质主要与结构有关:
正四面体空间网状结构
2、二氧化硅的用途:石英制品
现代通信用光缆
光学纤维胃镜
用光导纤维做
无开刀手术
光导纤维手术头灯
二氧化硅的重要用途:光导纤维材料
P76思考与交流
物理性质:熔点高,硬度大,不溶于水,不导电
根据SiO2的存在和应用。分析:
①SiO2有哪些物理性质?
②化学稳定性如何?
化学稳定性:通常情况稳定,不活泼。不与水、酸(除氢氟酸外)发生反应,耐高温、耐腐蚀。
想一想: SiO2属于酸性氧化物,推测它的化学性质。
酸性氧化物 + 水 = 酸
酸性氧化物 + 碱 = 盐 + 水
酸性氧化物 + 碱性氧化物 = 盐
3、二氧化硅的化学性质
(1)酸性氧化物的性质(如同CO2)
高温
SiO2+ CaO ==
CaSiO3
a.与强碱反应生成盐和水
SiO2 + 2NaOH =
Na2SiO3 +H2O
b.与碱性氧化物反应生成盐
(有粘性)
(1)酸性氧化物的性质(如同CO2)
硅酸钠
c.特性——与唯一的酸氢氟酸(HF)反应
SiO2 + 4HF=SiF4 ↑ + 2H2O
(用于雕刻玻璃)
二氧化碳和二氧化硅的物理化学性质及用途比较
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
不反应
SiO2 + 2NaOH = Na2SiO3 +H2O
固态 硅石、石英、水晶、玛瑙、沙子、硅藻土
熔、沸点低, 微溶于水
气 态 空 气
熔点高,硬度大,不溶于水
——
与氢氟酸反应
SiO2 + 4HF=SiF4↑+ 2H2O
人工降雨,灭火等
装饰、石英坩埚、光纤等
高温
1、实验室盛装NaOH
溶液的试剂瓶为什么
用橡胶塞而不用玻璃塞?
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O
想一想
图 4-6 实验室盛放NaOH溶液的试剂瓶
3、某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确?
动动脑筋
2、实验室为什么不用玻璃瓶盛装氢氟酸?
HF能腐蚀玻璃,因此,盛装氢氟酸不 能用
玻璃试剂瓶而要用塑料瓶。
SiO2 + 4HF =SiF4↑+ 2H2O
此反应常用于雕刻玻璃
不正确。因为二氧化硅只跟氢氟酸反应,不跟
其它酸反应,而是属于酸性氧化物。
想一想:怎样设计实验制取H2SiO3呢?
2、硅酸 (H2SiO3)
温馨提示:
CO2+H2O=H2CO3 ,但是SiO2不能与水直接
化合成H2SiO3。
(1)性质:
硅酸是一种白色固体,溶解度很小,而且是一种
弱酸,酸性比H2CO3还弱。
(2)制备:
制取原理:强酸制弱酸
滴入酚酞后溶液变为红色,再滴入稀盐酸,有透明的凝胶产生,溶液红色变浅至无色
Na2SiO3溶液呈碱性,与盐酸反应生成不溶于水的硅酸。
阅读课本P76并
探究实验4-1
Na2SiO3 + 2HCl == 2NaCl + H2SiO3(胶体)
SiO32- + 2H+ == H2SiO3(胶体)
生成的硅酸逐渐聚合而形成硅酸溶胶,经干
燥脱水就形成硅酸干胶,称为“硅胶”。常常用
做干燥剂。
(3)用途
一、SiO2
结构特点
物理性质
化学性质
用 途
①
②
③
④
二、H2SiO3
物理性质
化学性质
用 途
实验室制法
小 结
1、下列各组物质有关性质关系的比较,正确的是
A.溶解性:CO2 B.酸性:H2SiO3 > H2CO3
C.熔点:SiO2 > CO2
D.硬度: SiO2C
课堂练习
2、玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是 ( )
A、烧碱 B、纯碱
C、氢氟酸 D、盐酸
C
看谁做得最好(课后小测)
写出下列的化学方程式:
1、二氧化硅和氢氟酸反应
2、二氧化硅和氧化钙反应
3、二氧化硅和氢氧化钠溶液
4、实验室制取硅酸
5、二氧化碳通入氢氧化钠溶液
SiO2+4HF==SiF4↑+2H2O
SiO2+CaO=高温=CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3+2NaCl
CO2+2NaOH=Na2CO3+H2O
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第四章 非金属及其化合物
4.1无机非金属材料的主角-硅
4.1.1二氧化硅和硅酸
人教版 必修一
科学视野
美国的硅谷——“斯坦福科研工业区”是美国电子和计算机工业中心,位于美国西海岸加利福尼亚州北部旧金山南郊,圣克拉拉县和圣安两城之间的一条长48公里,宽16公里的长条形地带上。由于它集中了全世界90%以上的著名半导体公司,而半导体的基本元件是硅片,所以该地区被称为“硅谷”。
硅谷 silicon valley
胡
你知道吗?
Si元素在地壳中的含量排在第几位?
氧48.6%
硅26.3%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
镁2.00%
氢0.16%
其他1.20%
科学视野
锦绣中华
主要成份:
SiO2
主要成份:
SiO2
硅的存在与分布:硅在地壳中含量第二,硅的氧化物及硅酸盐约占地壳质量的90%以上。没有游离态,只有化合态(因为它是亲氧元素);自然界中分布广泛,是构成矿物和岩石的基本元素。
思考、讨论:C、Si原子结构相似,那么C、Si性质一样吗 ?
C
Si
碳、硅的最外层有四个电子,既不易失去电子,也不易得到电子,所以硅的化学性质不如碳活泼,主要形成四价化合物,碳和硅都是亲氧元素但是硅的亲氧能力更强。因此碳和硅在自然界中存在形式有所不同。
你能画出碳和硅原子结构示意图吗?
一.硅单质
1、存在:
2、物理性质:
导电性介于导体和绝缘体之间。
在自然界中,没有游离态的硅,只有化合态的硅。单质硅有晶体硅和无定形硅两种。
晶体硅的结构类似于金刚石,熔点(1410℃)和沸点都很高,硬度大。
1、存在
二、二氧化硅( SiO2 )
广泛存在于自然界,与其他矿物共同构成了岩石。天然二氧化硅也叫硅石。
一、二氧化硅和硅酸
1、二氧化硅( SiO2)
(1)二氧化硅存在
结晶形(石英晶体)
无定形——硅藻土
{
水晶
玛瑙
正四面体
空间网状结构
硅氧原子比例:1 : 2
没有SiO2 分子存在,
只存在硅氧原子
硅原子——
[SiO2]四面体
科学视野
(二)二氧化硅的结构
其性质主要与结构有关:
正四面体空间网状结构
2、二氧化硅的用途:石英制品
现代通信用光缆
光学纤维胃镜
用光导纤维做
无开刀手术
光导纤维手术头灯
二氧化硅的重要用途:光导纤维材料
P76思考与交流
物理性质:熔点高,硬度大,不溶于水,不导电
根据SiO2的存在和应用。分析:
①SiO2有哪些物理性质?
②化学稳定性如何?
化学稳定性:通常情况稳定,不活泼。不与水、酸(除氢氟酸外)发生反应,耐高温、耐腐蚀。
想一想: SiO2属于酸性氧化物,推测它的化学性质。
酸性氧化物 + 水 = 酸
酸性氧化物 + 碱 = 盐 + 水
酸性氧化物 + 碱性氧化物 = 盐
3、二氧化硅的化学性质
(1)酸性氧化物的性质(如同CO2)
高温
SiO2+ CaO ==
CaSiO3
a.与强碱反应生成盐和水
SiO2 + 2NaOH =
Na2SiO3 +H2O
b.与碱性氧化物反应生成盐
(有粘性)
(1)酸性氧化物的性质(如同CO2)
硅酸钠
c.特性——与唯一的酸氢氟酸(HF)反应
SiO2 + 4HF=SiF4 ↑ + 2H2O
(用于雕刻玻璃)
二氧化碳和二氧化硅的物理化学性质及用途比较
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+Na2O=Na2CO3
不反应
SiO2 + 2NaOH = Na2SiO3 +H2O
固态 硅石、石英、水晶、玛瑙、沙子、硅藻土
熔、沸点低, 微溶于水
气 态 空 气
熔点高,硬度大,不溶于水
——
与氢氟酸反应
SiO2 + 4HF=SiF4↑+ 2H2O
人工降雨,灭火等
装饰、石英坩埚、光纤等
高温
1、实验室盛装NaOH
溶液的试剂瓶为什么
用橡胶塞而不用玻璃塞?
NaOH溶液能与玻璃中的SiO2反应生成 Na2SiO3,使瓶塞部分粘结而无法打开。因此盛装NaOH溶液的试剂瓶不能用玻璃塞而要用橡胶塞。
SiO2 + 2NaOH = Na2SiO3 +H2O
想一想
图 4-6 实验室盛放NaOH溶液的试剂瓶
3、某同学根据SiO2既可与碱反应,也能与氢氟酸反应,推断SiO2为两性氧化物.是否正确?
动动脑筋
2、实验室为什么不用玻璃瓶盛装氢氟酸?
HF能腐蚀玻璃,因此,盛装氢氟酸不 能用
玻璃试剂瓶而要用塑料瓶。
SiO2 + 4HF =SiF4↑+ 2H2O
此反应常用于雕刻玻璃
不正确。因为二氧化硅只跟氢氟酸反应,不跟
其它酸反应,而是属于酸性氧化物。
想一想:怎样设计实验制取H2SiO3呢?
2、硅酸 (H2SiO3)
温馨提示:
CO2+H2O=H2CO3 ,但是SiO2不能与水直接
化合成H2SiO3。
(1)性质:
硅酸是一种白色固体,溶解度很小,而且是一种
弱酸,酸性比H2CO3还弱。
(2)制备:
制取原理:强酸制弱酸
滴入酚酞后溶液变为红色,再滴入稀盐酸,有透明的凝胶产生,溶液红色变浅至无色
Na2SiO3溶液呈碱性,与盐酸反应生成不溶于水的硅酸。
阅读课本P76并
探究实验4-1
Na2SiO3 + 2HCl == 2NaCl + H2SiO3(胶体)
SiO32- + 2H+ == H2SiO3(胶体)
生成的硅酸逐渐聚合而形成硅酸溶胶,经干
燥脱水就形成硅酸干胶,称为“硅胶”。常常用
做干燥剂。
(3)用途
一、SiO2
结构特点
物理性质
化学性质
用 途
①
②
③
④
二、H2SiO3
物理性质
化学性质
用 途
实验室制法
小 结
1、下列各组物质有关性质关系的比较,正确的是
A.溶解性:CO2
C.熔点:SiO2 > CO2
D.硬度: SiO2
课堂练习
2、玻璃的主要成分之一是二氧化硅,能在玻璃上进行蚀刻,将其制成毛玻璃和雕花玻璃的物质是 ( )
A、烧碱 B、纯碱
C、氢氟酸 D、盐酸
C
看谁做得最好(课后小测)
写出下列的化学方程式:
1、二氧化硅和氢氟酸反应
2、二氧化硅和氧化钙反应
3、二氧化硅和氢氧化钠溶液
4、实验室制取硅酸
5、二氧化碳通入氢氧化钠溶液
SiO2+4HF==SiF4↑+2H2O
SiO2+CaO=高温=CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3+2NaCl
CO2+2NaOH=Na2CO3+H2O
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
