4.4.2 硫酸 硝酸的性质
文档属性
| 名称 | 4.4.2 硫酸 硝酸的性质 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-11 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第四节
氨 硝酸 硫酸
第二课时
硫酸 硝酸 的 性 质
人教版 必修一
【思考与交流1】
硫酸、硝酸和盐酸都是酸,它们在组成上有什么特点?这种特点与酸的通性有什么关系?用电离方程式表示。
电离时产生的阳离子全部是H+的化合物
H2SO4 == 2H+ + SO42-
HNO3 == H+ + NO3-
HCl == H+ + Cl-
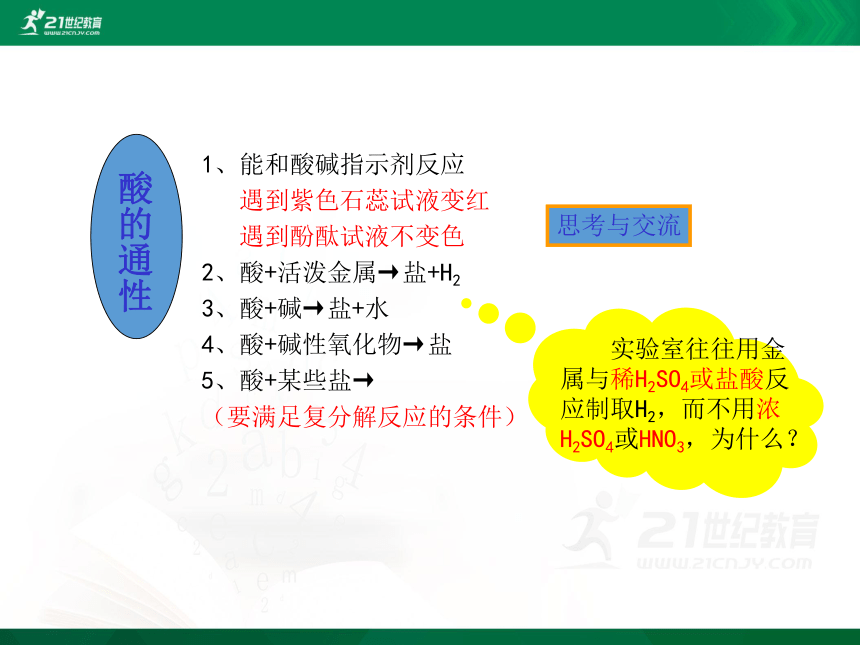
1、能和酸碱指示剂反应
遇到紫色石蕊试液变红
遇到酚酞试液不变色
2、酸+活泼金属→盐+H2
3、酸+碱→盐+水
4、酸+碱性氧化物→盐
5、酸+某些盐→
(要满足复分解反应的条件)
实验室往往用金属与稀H2SO4或盐酸反应制取H2,而不用浓H2SO4或HNO3,为什么?
酸的通性
思考与交流
一、浓硫酸
1.浓H2SO4的物理性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发酸(高沸点酸)
密度:1.84g/cm3——高密度酸
溶解性:跟水任意比互溶,溶解放出大量热
[思考] 浓硫酸应如何稀释?
用于制易挥发
酸,如盐酸。
(1).吸水性
用途:可以作干燥剂
浓硫酸吸收物质本来就有的水,
直接与水分子结合;
2 浓硫酸的特性
不能干燥
碱性气体:NH3
还原性气体:H2S HBr、HI
(2).脱水性
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
【实验】取10g蔗糖放入小烧杯中,加入几滴水,用玻璃棒搅拌均匀,再加入10mL浓硫酸,并用玻璃棒迅速搅拌。观察物质的颜色、体积变化并闻味。
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C== CO2 + 2H2O + 2SO2
脱水性
氧化性
△
浓硫酸的吸水性和脱水性有什么区别?
吸水性是指浓硫酸直接与水分子结合。
脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。
吸收现成的水
反应生成水
问题?
加热后产生的气体使紫色石蕊试液变为红色;使品红溶液褪色;试管中溶液变蓝色。
【实验4-9】 Cu与浓H2SO4反应
现象
结论
常温下铜与浓硫酸不反应,
加热时:
得2e-
失2e-
氧化剂
还原剂
0 +6 +2 +4
(3).强氧化性
加热前无现象,
Cu +2H2SO4 (浓)== CuSO4 +SO2↑+2H2O
△
浓硫酸既有氧化性又有酸性
a.与金属反应
b.与某些非金属反应
C + 2H2SO4 (浓) = CO2 + SO2 + 2H2O
△
设计一实验,证明浓硫酸与碳反应的生成物含有
水、二氧化硫和二氧化碳 。
思考题
铁和铝在常温下遇浓硫酸会发生钝化现象,故浓硫酸的贮存和运输可用铝(铁)槽车运输。若加热,则铁和铝都会跟浓硝酸、浓硫酸反应。
【金属的钝化】
3、硫酸的用途:
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
1、难挥发性
浓硫酸的特性
2、吸水性
3、脱水性
4、强氧化性
S
-2
+6
S
S
0
S
+4
被氧化
被氧化
被氧化
被还原
被还原
被还原
1、将下列现象中硫酸表现出来的性质写在空白处:
(1)敞口放置浓硫酸时,质量增加.
(2)把CuSO4?5H2O 晶体放入浓硫酸中,变白色
(3)锌粒放入稀硫酸中,有气体放出.
(4)把木屑放入浓硫酸中,变黑.
练习:
吸水性
吸水性
酸性、氧化性
脱水性
⑴纯硝酸是无色、易挥发、有刺激性气味的液体。
二、硝酸
⑵能以任意比溶于水;
⑶密度比水大;
⑷沸点低:83℃;
⑸常用浓硝酸的浓度为69%,
98%的浓硝酸叫作“发烟硝酸”。
(一)硝酸的物理性质:
a、能和酸碱指示剂反应
遇到紫色石蕊试液变红
遇到酚酞试液不变色
b、酸+碱→盐+水
c、酸+碱性氧化物→盐
d、酸+某些盐→
(要满足复分解反应的条件)
硝酸的通性
(二)硝酸的化学性质
1.酸的通性
2、不稳定性
硝酸分解产生NO2,NO2溶于硝酸而使硝酸呈现黄色。
保存:
密封于棕色瓶中,并放在阴暗处!
久置浓硝酸为什么呈黄色?
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO +4H2O
结论:
硝酸具有强的氧化性。
Cu+4HNO3(浓) = Cu(NO3)2+2NO2 +2H2O
3.与金属反应
硝酸具有强的氧化性,也能跟许多非金属(如碳)反应
4HNO3 (浓)+ C = CO2 + 4NO2 + 2H2O
4.与非金属反应
硝酸浓度越大,氧化性越强。
氧化性:浓HNO3 > 稀HNO3
硝酸+5价的氮得电子,被还原成较低价的氮
NO2 HNO2 NO N2O N2 NH3
+4
+3
+2
+1
0
-3
⑴大量实验证明:不论浓、稀硝酸都有很强的氧化性,几乎能与所有金属(除Pt、Au等少数金属外)反应,如:Mg、Al、Zn、Fe、Cu等。但Al、Fe在冷、浓硝酸中要发生钝化。
(2)Pt、Au不与硝酸反应,但能与王水反应。王水是由浓硝酸和浓盐酸以体积比1:3组成的混合物,具有极强的氧化性,能氧化Pt、Au等极不活泼金属。
记忆方法 :
王水:“三言(盐)一笑(硝)”
可以用铁、铝制的容器盛装浓硫酸或浓硝酸
(三)硝酸的用途 p102
硝酸是一种重要的化工原料,可用于制造炸药、燃料、塑料、硝酸盐等,在实验室里它是一种化学试剂。
浓硝酸、浓硫酸、浓盐酸性质对比
有
有
有
有
有
有
无
有
有
稳定
稳定
不稳定
易挥发
难挥发
易挥发
无
有
无
无
有
无
1.分别将盛有浓盐酸、浓硫酸、浓硝酸的烧杯露置于空气中,放置一段时间后,质量增大的是 ,原因是 ,质量减少的是 ,原因是 。
浓H2SO4
浓H2SO4吸收空气中的水蒸气
浓盐酸、浓硝酸
浓盐酸、浓硝酸均具有挥发性.
练习
2.下列试剂不需要保存在棕色试剂瓶内的是 ( )
A、浓HNO3 B、NaCl溶液
C、新制氯水 D、AgNO3 溶液
见光或受热而易变质的物质需用棕色试剂瓶且密封保存,如:AgNO3、浓HNO3、AgCl、H2O2、溴水、氯水等
B
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第四节
氨 硝酸 硫酸
第二课时
硫酸 硝酸 的 性 质
人教版 必修一
【思考与交流1】
硫酸、硝酸和盐酸都是酸,它们在组成上有什么特点?这种特点与酸的通性有什么关系?用电离方程式表示。
电离时产生的阳离子全部是H+的化合物
H2SO4 == 2H+ + SO42-
HNO3 == H+ + NO3-
HCl == H+ + Cl-
1、能和酸碱指示剂反应
遇到紫色石蕊试液变红
遇到酚酞试液不变色
2、酸+活泼金属→盐+H2
3、酸+碱→盐+水
4、酸+碱性氧化物→盐
5、酸+某些盐→
(要满足复分解反应的条件)
实验室往往用金属与稀H2SO4或盐酸反应制取H2,而不用浓H2SO4或HNO3,为什么?
酸的通性
思考与交流
一、浓硫酸
1.浓H2SO4的物理性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发酸(高沸点酸)
密度:1.84g/cm3——高密度酸
溶解性:跟水任意比互溶,溶解放出大量热
[思考] 浓硫酸应如何稀释?
用于制易挥发
酸,如盐酸。
(1).吸水性
用途:可以作干燥剂
浓硫酸吸收物质本来就有的水,
直接与水分子结合;
2 浓硫酸的特性
不能干燥
碱性气体:NH3
还原性气体:H2S HBr、HI
(2).脱水性
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
【实验】取10g蔗糖放入小烧杯中,加入几滴水,用玻璃棒搅拌均匀,再加入10mL浓硫酸,并用玻璃棒迅速搅拌。观察物质的颜色、体积变化并闻味。
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C== CO2 + 2H2O + 2SO2
脱水性
氧化性
△
浓硫酸的吸水性和脱水性有什么区别?
吸水性是指浓硫酸直接与水分子结合。
脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。
吸收现成的水
反应生成水
问题?
加热后产生的气体使紫色石蕊试液变为红色;使品红溶液褪色;试管中溶液变蓝色。
【实验4-9】 Cu与浓H2SO4反应
现象
结论
常温下铜与浓硫酸不反应,
加热时:
得2e-
失2e-
氧化剂
还原剂
0 +6 +2 +4
(3).强氧化性
加热前无现象,
Cu +2H2SO4 (浓)== CuSO4 +SO2↑+2H2O
△
浓硫酸既有氧化性又有酸性
a.与金属反应
b.与某些非金属反应
C + 2H2SO4 (浓) = CO2 + SO2 + 2H2O
△
设计一实验,证明浓硫酸与碳反应的生成物含有
水、二氧化硫和二氧化碳 。
思考题
铁和铝在常温下遇浓硫酸会发生钝化现象,故浓硫酸的贮存和运输可用铝(铁)槽车运输。若加热,则铁和铝都会跟浓硝酸、浓硫酸反应。
【金属的钝化】
3、硫酸的用途:
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
1、难挥发性
浓硫酸的特性
2、吸水性
3、脱水性
4、强氧化性
S
-2
+6
S
S
0
S
+4
被氧化
被氧化
被氧化
被还原
被还原
被还原
1、将下列现象中硫酸表现出来的性质写在空白处:
(1)敞口放置浓硫酸时,质量增加.
(2)把CuSO4?5H2O 晶体放入浓硫酸中,变白色
(3)锌粒放入稀硫酸中,有气体放出.
(4)把木屑放入浓硫酸中,变黑.
练习:
吸水性
吸水性
酸性、氧化性
脱水性
⑴纯硝酸是无色、易挥发、有刺激性气味的液体。
二、硝酸
⑵能以任意比溶于水;
⑶密度比水大;
⑷沸点低:83℃;
⑸常用浓硝酸的浓度为69%,
98%的浓硝酸叫作“发烟硝酸”。
(一)硝酸的物理性质:
a、能和酸碱指示剂反应
遇到紫色石蕊试液变红
遇到酚酞试液不变色
b、酸+碱→盐+水
c、酸+碱性氧化物→盐
d、酸+某些盐→
(要满足复分解反应的条件)
硝酸的通性
(二)硝酸的化学性质
1.酸的通性
2、不稳定性
硝酸分解产生NO2,NO2溶于硝酸而使硝酸呈现黄色。
保存:
密封于棕色瓶中,并放在阴暗处!
久置浓硝酸为什么呈黄色?
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO +4H2O
结论:
硝酸具有强的氧化性。
Cu+4HNO3(浓) = Cu(NO3)2+2NO2 +2H2O
3.与金属反应
硝酸具有强的氧化性,也能跟许多非金属(如碳)反应
4HNO3 (浓)+ C = CO2 + 4NO2 + 2H2O
4.与非金属反应
硝酸浓度越大,氧化性越强。
氧化性:浓HNO3 > 稀HNO3
硝酸+5价的氮得电子,被还原成较低价的氮
NO2 HNO2 NO N2O N2 NH3
+4
+3
+2
+1
0
-3
⑴大量实验证明:不论浓、稀硝酸都有很强的氧化性,几乎能与所有金属(除Pt、Au等少数金属外)反应,如:Mg、Al、Zn、Fe、Cu等。但Al、Fe在冷、浓硝酸中要发生钝化。
(2)Pt、Au不与硝酸反应,但能与王水反应。王水是由浓硝酸和浓盐酸以体积比1:3组成的混合物,具有极强的氧化性,能氧化Pt、Au等极不活泼金属。
记忆方法 :
王水:“三言(盐)一笑(硝)”
可以用铁、铝制的容器盛装浓硫酸或浓硝酸
(三)硝酸的用途 p102
硝酸是一种重要的化工原料,可用于制造炸药、燃料、塑料、硝酸盐等,在实验室里它是一种化学试剂。
浓硝酸、浓硫酸、浓盐酸性质对比
有
有
有
有
有
有
无
有
有
稳定
稳定
不稳定
易挥发
难挥发
易挥发
无
有
无
无
有
无
1.分别将盛有浓盐酸、浓硫酸、浓硝酸的烧杯露置于空气中,放置一段时间后,质量增大的是 ,原因是 ,质量减少的是 ,原因是 。
浓H2SO4
浓H2SO4吸收空气中的水蒸气
浓盐酸、浓硝酸
浓盐酸、浓硝酸均具有挥发性.
练习
2.下列试剂不需要保存在棕色试剂瓶内的是 ( )
A、浓HNO3 B、NaCl溶液
C、新制氯水 D、AgNO3 溶液
见光或受热而易变质的物质需用棕色试剂瓶且密封保存,如:AgNO3、浓HNO3、AgCl、H2O2、溴水、氯水等
B
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
