专题5 化学变化及其表示 复习课件(共33张PPT)
文档属性
| 名称 | 专题5 化学变化及其表示 复习课件(共33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 874.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-10 00:00:00 | ||
图片预览











文档简介
课件33张PPT。专题5 化学变化及其表示
复习课件单元1 质量守恒定律
单元2 如何正确书写化学方程式
单元3 利用化学方程式的简单计算在一定条件下才能发生的化学反应,如:加热、点燃、光照、催化剂。
在化学反应中,当反应物相同而反应条件不同时,生成的产物也可能会不同。单元1 质量守恒定律1.物质的变化当氧气充足时,碳完全燃烧:
碳+氧气 二氧化碳 当氧气不充足时,碳不完全燃烧:
碳+氧气 一氧化碳
点燃点燃 铁暴露在潮湿的空气中生锈。
铁+氧气+水→铁锈 铁在氧气中剧烈燃烧,火星四射。
铁+氧气 四氧化三铁点燃葡萄糖在生物体内与氧气反应:
葡萄糖+氧气 二氧化碳+水 在酒化酶作用下发酵:
葡萄糖 酒精+二氧化碳酶酒化酶结 论许多化学反应,反应物相同,反应条件不同,得到的产物不同。1、温度对化学反应速率有影响。
2、在反应物中加入催化剂可能会影
响化学反应速率。
3、不同的催化剂对同一反应的催化
效率不同 。
4、反应物的浓度对化学反应速率有
影响 。
小结 许多化学反应能通过提高反应温度,
选择适当的催化剂,增加反应物浓度等
途径加快其反应速率,并且同一反应可
使用不同的催化剂。1.在用过氧化氢制取氧气时,加入了0.5 g的
二氧化锰,反应结束后,二氧化锰的质量为
g.2.现有30ml5%的过氧化氢溶液,分为两等份装入a、b两支试管中,其中在a试管中加入0.5g二氧化锰,则产生氧气的速度a _____ b (填“>”、“<”或“=”,下同),生成氧气的质量a b。
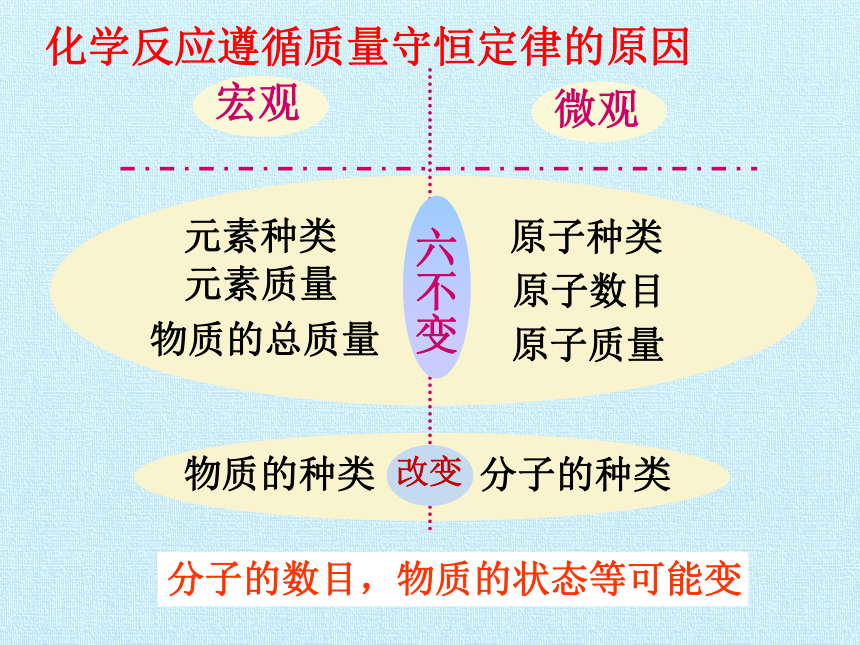
练一练2.质量守恒定律 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。原子数目原子质量原子种类物质的总质量元素质量元素种类物质的种类分子的种类分子的数目,物质的状态等可能变化学反应遵循质量守恒定律的原因改变质量守恒定律内容适用范围解释应用参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和一切化学反应化学反应实质原子种类原子数目原子质量不改变推断反应物或生成物的元素组成推断化学反应类型解释实际问题例题解析【例1】山茶油是一种绿色保健食品,其主要成分是柠檬醛。现从山茶油中提取7.6g柠檬醛,使其在氧气中完全燃烧,生成22g二氧化碳和7.2 g水,则柠檬醛中( )
A.只含有碳、氢元素 B.一定含有碳、氢、氧元素
C.一定含有碳、氢元素,可能含有氧元素 D.含有的元素无法确定B例题解析【例2】在密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质: X Y Z Q 反应前质量/g 8 2 20 5
反应后质量/g 待测 10 8 13
下列说法正确的是( )
A.反应后X的质量为6 g
B.该反应的反应物是X、Y
C.参加反应的X、Z的质量比是1:3
D. Y、Q的相对分子质量比一定为1:1C1.书写化学方程式要遵守两个原则:②必须遵守质量守恒定律①必须以客观事实为基础单元2 如何正确书写化学方程式2.化学方程式的涵义(提供的信息)a. 哪些物质参加了反应(反应物)
b.生成了哪些物质(生成物)
c.反应条件
d.反应物与生成物之间的粒子数量比
e. 反应物与生成物之间的质量比
化学方程式的读法是从左到右,先读反应物,后读生成物。如反应物和生成物不止一种,反应物之间的“+”号读作“跟”、“与”或“和”,生成物之间的“+”读作“和”,“=”读作“生成”。如反应是在一定的条件下发生的,还应读出反应条件。
例如:S+O2 SO2
3.化学方程式的读法①? 质的方面:硫与氧气在点燃的条件下生成二氧化硫。
②? 量的方面:每32份质量的硫跟32份质量的氧气完全反应生成64份质量的二氧化硫。
③粒子方面:每1个硫原子与1个氧分子反应生成1个二氧化硫分子。燃烧4P + 502 2P205
4.化学方程式的书写步骤(1)写:点燃根据事实写出反应物和生成物的化学式,中间
用短横线相连。P + O2 P2O5
(2)配:配平化学方程式,并检验(就是等号两边各种原子的数目必须相等)4P + 5O2 2P2O5
(3)等:将短横线改写成 “ ”4P +5O2 2P205
(4)标:标明反应发生条件以及生成物状态“↑”或“↓”(5)查:检查化学式是否写错,化学方程式是否配平,条件和物质状态标注是否标了,标了是否恰当。如何配?要注意什么?有关反应条件和生成物的状态(1)反应 条件只有一个写在等号的上方;若需 2个或多个条件,则分开写在等号上下方
(2) 点燃≠加热(△)
点燃≠燃烧(不能写燃烧)
高温≠加热(△)
(3)只有生成物中有气体时(反应物中没有气 体),在气体物质的化学式右边标注“↑”。
(4)溶液中的反应 ,只有生成物中有难溶的固体物质时(反应物无不溶性固体),在固体物质的化学式右边标注“ ↓”。 点燃
(1)2Mg+O2===2MgO
点燃
(2)S+O2 ====SO2
点燃
(3)C+O2====CO2
点燃
(4)2C+O2=====2CO
高温
(5)CO2+C=====2CO
点燃
(6)4P+5O2====2P2O5 点燃
(7)3Fe+2O2=====Fe3O4
点燃
(8)2H2+O2====2H2O
点燃
(9)2CO+O2=====2CO2
(10)CO2+H2O==H2CO3
常见的化学方程式一、化合反应 MnO2
2KClO3=====2KCl+3O2↑
△
△
2KMnO4===K2MnO4+MnO2+O2↑
MnO2
2H2O2====2H2O+O2↑
通电
2H2O====2H2↑+O2↑
?
H2CO3===H2O+CO2↑
二、分解反应
CuO + CO====Cu + CO2
Fe2O3 + 3CO====2Fe + 3CO2
Fe3O4 + 4CO====3Fe + 4CO2
CaCO3 + 2HCl==CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl==2NaCl + H2O CO2↑ Ca(OH)2 + CO2===CaCO3↓ + H2O
2NaOH + CO2==Na2CO3 + H2O
CH4+2O2=====CO2+2H2O
C2H5OH+3O2=====2CO2+3H2O
三、其它反应加热高温电燃电燃化学方程式的配平(1)配平化学方程式的原理
配平化学方程式就是在化学式前面配上适当的计量数,使式子(短线)左、右两边的每一种元素的原子总数相等,体现质量守恒定律。(不能改变物质的化学式)。1.如何配平化学方程式?2.配平化学方程式的方法①观察法2222这种方法对一些简单的方程式很有效,凑数进行配平。 练习 : __Al +__Fe3O4 __Al2O3 +__Fe②最小公倍数法找出关键元素(是O)。反应前、后该(氧)原子个数的最小公倍数是10 。最小公倍数除以化学式中该原子的个数,把得到的数字写到化学式前面。在O2前面配上计量数5,在P2O5前面配上计量数2。再配平其他原子。前后磷原子个数的最小公倍数是4,在P前面配上计量数4 。8349配平下面的化学方程式③奇数配偶法找出关键元素(是O):反应前、后某元素出现次数最多,并且短线两边该原子总数为一边奇数、一边偶数。把奇数配成偶数。(优先考虑×2) 再配平其它原子和氧原子,短线变等号。22 点燃
(1)Mg+O2——MgO
点燃
(2)P+O2——P2O5
(3) H2O2——H2O+O2↑
(4) NaOH+CO2——Na2CO3+H2O练习:配平下列方程式 点燃
(1)2Mg+O2===2MgO
点燃
(2)4P+5O2====2P2O5
(3) 2H2O2====2H2O+O2↑
(4) 2NaOH+CO2==Na2CO3+H2O练习:配平下列方程式根据化学方程式计算各物质的质量比各物质的质量比等于化学方程式中每种物质的相对分子质量乘以化学计量数的比。2H2O 2 H2 + O218×2 : 2×2 : 3236: : 4 : 32 KClO3 KCl + O2232MnO2△122.5×2 :74.5×2 :32×3 245 : 149 :96
单元3 利用化学方程式的简单计算通电1.设未知量(求什么就设什么,将所求的问题一次设出)
2.写出化学方程式并配平(计算中所用到的化学方程式)
3.写出有关物质的相对分子质量和已知量、未知量(只写与已知和所求有关的物质,上写相对分子质量,下写物质的质量,已知的带单位)
4.列出比例式、求解(列正比例式,上下同种量,左右同一物质)
5.简明地写出答案
根据化学方程式计算的步骤简化格式:答:加热分解 6g高锰酸钾,可以得到0.6g氧气。设:加热分解 6g高锰酸钾,可以得到氧气的质量为x[解]例:4g氧气可与多少g氢气完全反应?同时生成水多少g?解:设4g氧气可与质量为X的氢气完全反应,同时生成水的质量为Y2H2+ O2 2 H2O点燃4 32 36X 4g Y 4
32X
4gX=4×4g
32 =0. 5g32
364g
yY=36 ×4g
32=4.5g答:4g氧气可与0.5g氢气完全反应,同时生成水4.5g。
谢 谢
复习课件单元1 质量守恒定律
单元2 如何正确书写化学方程式
单元3 利用化学方程式的简单计算在一定条件下才能发生的化学反应,如:加热、点燃、光照、催化剂。
在化学反应中,当反应物相同而反应条件不同时,生成的产物也可能会不同。单元1 质量守恒定律1.物质的变化当氧气充足时,碳完全燃烧:
碳+氧气 二氧化碳 当氧气不充足时,碳不完全燃烧:
碳+氧气 一氧化碳
点燃点燃 铁暴露在潮湿的空气中生锈。
铁+氧气+水→铁锈 铁在氧气中剧烈燃烧,火星四射。
铁+氧气 四氧化三铁点燃葡萄糖在生物体内与氧气反应:
葡萄糖+氧气 二氧化碳+水 在酒化酶作用下发酵:
葡萄糖 酒精+二氧化碳酶酒化酶结 论许多化学反应,反应物相同,反应条件不同,得到的产物不同。1、温度对化学反应速率有影响。
2、在反应物中加入催化剂可能会影
响化学反应速率。
3、不同的催化剂对同一反应的催化
效率不同 。
4、反应物的浓度对化学反应速率有
影响 。
小结 许多化学反应能通过提高反应温度,
选择适当的催化剂,增加反应物浓度等
途径加快其反应速率,并且同一反应可
使用不同的催化剂。1.在用过氧化氢制取氧气时,加入了0.5 g的
二氧化锰,反应结束后,二氧化锰的质量为
g.2.现有30ml5%的过氧化氢溶液,分为两等份装入a、b两支试管中,其中在a试管中加入0.5g二氧化锰,则产生氧气的速度a _____ b (填“>”、“<”或“=”,下同),生成氧气的质量a b。
练一练2.质量守恒定律 参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。原子数目原子质量原子种类物质的总质量元素质量元素种类物质的种类分子的种类分子的数目,物质的状态等可能变化学反应遵循质量守恒定律的原因改变质量守恒定律内容适用范围解释应用参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和一切化学反应化学反应实质原子种类原子数目原子质量不改变推断反应物或生成物的元素组成推断化学反应类型解释实际问题例题解析【例1】山茶油是一种绿色保健食品,其主要成分是柠檬醛。现从山茶油中提取7.6g柠檬醛,使其在氧气中完全燃烧,生成22g二氧化碳和7.2 g水,则柠檬醛中( )
A.只含有碳、氢元素 B.一定含有碳、氢、氧元素
C.一定含有碳、氢元素,可能含有氧元素 D.含有的元素无法确定B例题解析【例2】在密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质: X Y Z Q 反应前质量/g 8 2 20 5
反应后质量/g 待测 10 8 13
下列说法正确的是( )
A.反应后X的质量为6 g
B.该反应的反应物是X、Y
C.参加反应的X、Z的质量比是1:3
D. Y、Q的相对分子质量比一定为1:1C1.书写化学方程式要遵守两个原则:②必须遵守质量守恒定律①必须以客观事实为基础单元2 如何正确书写化学方程式2.化学方程式的涵义(提供的信息)a. 哪些物质参加了反应(反应物)
b.生成了哪些物质(生成物)
c.反应条件
d.反应物与生成物之间的粒子数量比
e. 反应物与生成物之间的质量比
化学方程式的读法是从左到右,先读反应物,后读生成物。如反应物和生成物不止一种,反应物之间的“+”号读作“跟”、“与”或“和”,生成物之间的“+”读作“和”,“=”读作“生成”。如反应是在一定的条件下发生的,还应读出反应条件。
例如:S+O2 SO2
3.化学方程式的读法①? 质的方面:硫与氧气在点燃的条件下生成二氧化硫。
②? 量的方面:每32份质量的硫跟32份质量的氧气完全反应生成64份质量的二氧化硫。
③粒子方面:每1个硫原子与1个氧分子反应生成1个二氧化硫分子。燃烧4P + 502 2P205
4.化学方程式的书写步骤(1)写:点燃根据事实写出反应物和生成物的化学式,中间
用短横线相连。P + O2 P2O5
(2)配:配平化学方程式,并检验(就是等号两边各种原子的数目必须相等)4P + 5O2 2P2O5
(3)等:将短横线改写成 “ ”4P +5O2 2P205
(4)标:标明反应发生条件以及生成物状态“↑”或“↓”(5)查:检查化学式是否写错,化学方程式是否配平,条件和物质状态标注是否标了,标了是否恰当。如何配?要注意什么?有关反应条件和生成物的状态(1)反应 条件只有一个写在等号的上方;若需 2个或多个条件,则分开写在等号上下方
(2) 点燃≠加热(△)
点燃≠燃烧(不能写燃烧)
高温≠加热(△)
(3)只有生成物中有气体时(反应物中没有气 体),在气体物质的化学式右边标注“↑”。
(4)溶液中的反应 ,只有生成物中有难溶的固体物质时(反应物无不溶性固体),在固体物质的化学式右边标注“ ↓”。 点燃
(1)2Mg+O2===2MgO
点燃
(2)S+O2 ====SO2
点燃
(3)C+O2====CO2
点燃
(4)2C+O2=====2CO
高温
(5)CO2+C=====2CO
点燃
(6)4P+5O2====2P2O5 点燃
(7)3Fe+2O2=====Fe3O4
点燃
(8)2H2+O2====2H2O
点燃
(9)2CO+O2=====2CO2
(10)CO2+H2O==H2CO3
常见的化学方程式一、化合反应 MnO2
2KClO3=====2KCl+3O2↑
△
△
2KMnO4===K2MnO4+MnO2+O2↑
MnO2
2H2O2====2H2O+O2↑
通电
2H2O====2H2↑+O2↑
?
H2CO3===H2O+CO2↑
二、分解反应
CuO + CO====Cu + CO2
Fe2O3 + 3CO====2Fe + 3CO2
Fe3O4 + 4CO====3Fe + 4CO2
CaCO3 + 2HCl==CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl==2NaCl + H2O CO2↑ Ca(OH)2 + CO2===CaCO3↓ + H2O
2NaOH + CO2==Na2CO3 + H2O
CH4+2O2=====CO2+2H2O
C2H5OH+3O2=====2CO2+3H2O
三、其它反应加热高温电燃电燃化学方程式的配平(1)配平化学方程式的原理
配平化学方程式就是在化学式前面配上适当的计量数,使式子(短线)左、右两边的每一种元素的原子总数相等,体现质量守恒定律。(不能改变物质的化学式)。1.如何配平化学方程式?2.配平化学方程式的方法①观察法2222这种方法对一些简单的方程式很有效,凑数进行配平。 练习 : __Al +__Fe3O4 __Al2O3 +__Fe②最小公倍数法找出关键元素(是O)。反应前、后该(氧)原子个数的最小公倍数是10 。最小公倍数除以化学式中该原子的个数,把得到的数字写到化学式前面。在O2前面配上计量数5,在P2O5前面配上计量数2。再配平其他原子。前后磷原子个数的最小公倍数是4,在P前面配上计量数4 。8349配平下面的化学方程式③奇数配偶法找出关键元素(是O):反应前、后某元素出现次数最多,并且短线两边该原子总数为一边奇数、一边偶数。把奇数配成偶数。(优先考虑×2) 再配平其它原子和氧原子,短线变等号。22 点燃
(1)Mg+O2——MgO
点燃
(2)P+O2——P2O5
(3) H2O2——H2O+O2↑
(4) NaOH+CO2——Na2CO3+H2O练习:配平下列方程式 点燃
(1)2Mg+O2===2MgO
点燃
(2)4P+5O2====2P2O5
(3) 2H2O2====2H2O+O2↑
(4) 2NaOH+CO2==Na2CO3+H2O练习:配平下列方程式根据化学方程式计算各物质的质量比各物质的质量比等于化学方程式中每种物质的相对分子质量乘以化学计量数的比。2H2O 2 H2 + O218×2 : 2×2 : 3236: : 4 : 32 KClO3 KCl + O2232MnO2△122.5×2 :74.5×2 :32×3 245 : 149 :96
单元3 利用化学方程式的简单计算通电1.设未知量(求什么就设什么,将所求的问题一次设出)
2.写出化学方程式并配平(计算中所用到的化学方程式)
3.写出有关物质的相对分子质量和已知量、未知量(只写与已知和所求有关的物质,上写相对分子质量,下写物质的质量,已知的带单位)
4.列出比例式、求解(列正比例式,上下同种量,左右同一物质)
5.简明地写出答案
根据化学方程式计算的步骤简化格式:答:加热分解 6g高锰酸钾,可以得到0.6g氧气。设:加热分解 6g高锰酸钾,可以得到氧气的质量为x[解]例:4g氧气可与多少g氢气完全反应?同时生成水多少g?解:设4g氧气可与质量为X的氢气完全反应,同时生成水的质量为Y2H2+ O2 2 H2O点燃4 32 36X 4g Y 4
32X
4gX=4×4g
32 =0. 5g32
364g
yY=36 ×4g
32=4.5g答:4g氧气可与0.5g氢气完全反应,同时生成水4.5g。
谢 谢
同课章节目录
- 专题一 走进化学殿堂
- 单元1 化学使生活更美好
- 单元2 如何学习化学
- 专题二 空气和水
- 单元1 多组分的空气
- 单元2 氧气
- 单元3 自然界的水
- 专题三 物质的构成
- 单元1 构成物质的微粒
- 单元2 组成物质的元素
- 单元3 纯净物组成的表示方法
- 专题四 燃料与燃烧
- 单元1 燃烧与灭火
- 单元2 碳及其化合物
- 单元3 化石燃料的利用
- 专题五 化学变化及其表示
- 单元1 化学变化是有条件的
- 单元2 质量守恒定律
- 单元3 化学方程式
- 专题六 物质的溶解
- 单元1 物质的溶解过程
- 单元2 物质的溶解性
- 单元3 物质的溶解性的改变
- 学生实验
- 实验1 实验基本操作
- 实验2 氧气的实验室制取与性质
- 实验3 燃烧的条件
- 实验4 二氧化碳的实验室制取与性质
- 实验5 一定浓度溶液的配置
