第5节 酸和碱之间发生的反应 同步练习
文档属性
| 名称 | 第5节 酸和碱之间发生的反应 同步练习 |

|
|
| 格式 | zip | ||
| 文件大小 | 186.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-10-12 00:00:00 | ||
图片预览


文档简介
第5节 酸和碱之间发生的反应
一、碱+酸===盐+水
Ca(OH)2+2HCl===________________
NaOH+HCl===__________________
2NaOH+H2SO4===__________________
二、中和反应:酸和碱反应,生成________的反应
1.实验时用酸碱指示剂指示酸、碱是否恰好完全反应。
2.反应的本质是________===H2O。
3.根据此原理可以用熟石灰改良酸性土壤等。
A组 基础训练
1.(铁岭中考)中和反应在生产和生活中有着广泛的应用。下列应用与中和反应原理一定无关的是( )
A.服用含氢氧化铝的药物治疗胃酸过多症
B.用稀硫酸处理印染厂的碱性废水
C.在工业上,用熟石灰和纯碱制取烧碱
D.在蚊虫叮咬处涂抹稀氨水可以减轻蚊虫分泌出的蚁酸造成的痛痒
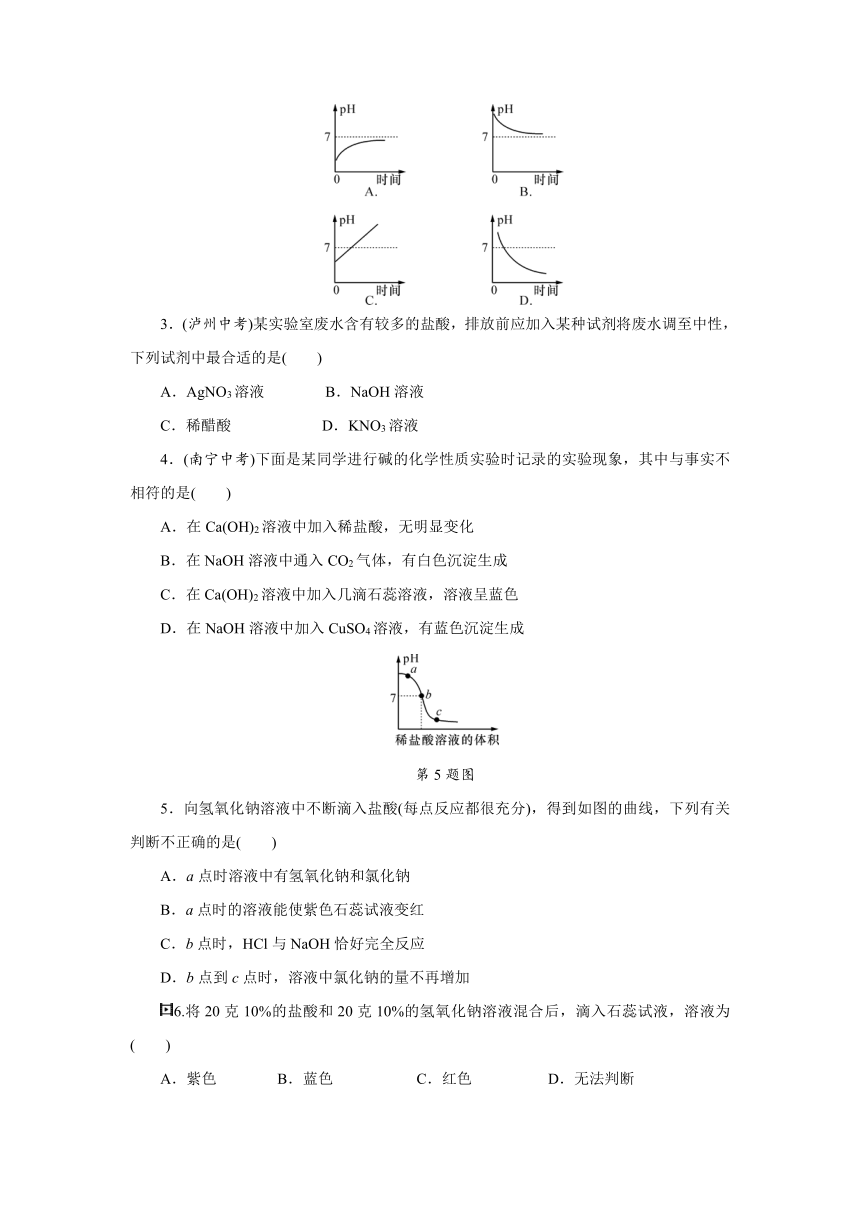
2.某种胃药的有效成分是 Mg(OH)2,服用后能减缓因胃酸过多而引起的疼痛。在 Mg(OH)2的作用过程中,胃液 pH 变化的情况可能是( )
3.(泸州中考)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液
C.稀醋酸 D.KNO3溶液
4.(南宁中考)下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( )
A.在Ca(OH)2溶液中加入稀盐酸,无明显变化
B.在NaOH溶液中通入CO2气体,有白色沉淀生成
C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色
D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
第5题图
5.向氢氧化钠溶液中不断滴入盐酸(每点反应都很充分),得到如图的曲线,下列有关判断不正确的是( )
A.a点时溶液中有氢氧化钠和氯化钠
B.a点时的溶液能使紫色石蕊试液变红
C.b点时,HCl与NaOH恰好完全反应
D.b点到c点时,溶液中氯化钠的量不再增加
6.将20克10%的盐酸和20克10%的氢氧化钠溶液混合后,滴入石蕊试液,溶液为( )
A.紫色 B.蓝色 C.红色 D.无法判断
7.经测定,在任何水溶液中,均存在一定数量的H+[用n(H+)表示]和一定数量的OH-[用n(OH-)表示],n(H+)与n(OH-)的相对大小对应溶液的酸碱性如表所示:
n(H+)与n(OH-)的相对大小 溶液的酸碱性
n(H+)>n(OH-) 酸性
n(H+)=n(OH-) 中性
n(H+)<n(OH-) 碱性
据此分析:
(1)常温下测得水中pH=7,可知水中n(H+)________n(OH-)(填“>”、“=”或“<”)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞,现象是__________________________,再往上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液中
n(H+)________n(OH-)(填“>”、“=”或“<”)。
8.某化学兴趣小组在室温的条件下(温度为20℃),为了测定H2SO4与NaOH发生中和反应时放出的热量,在如图的小烧杯中加入8mL溶质质量分数为10%的NaOH溶液(密度1g/mL),并滴入3滴酚酞,测量其温度;另取过量的稀硫酸(密度1.12g/mL),测量其温度后逐量缓慢地加入到小烧杯中,边加边用环形玻璃棒搅拌;测得烧杯中溶液温度的变化与加入稀硫酸体积之间的关系如图所示。
第8题图
(1)当加入5mL稀硫酸时,溶液中的溶质有__________________(填写溶质化学式)。
(2)当加入约为________mL稀硫酸时,烧杯中溶液的温度达到最高。此时烧杯中溶液的温度约为________(填写整数)℃,烧杯中溶液颜色为________。
(3)当加入稀硫酸的体积大于10mL时,溶液温度下降的原因是
________________________________________________________________________。
(4)当溶液温度升到最高时,此时溶液中溶质质量分数是多少?(写出计算过程)
B组 自主提高
9.(湘潭中考)将等质量等溶质质量分数的氢氧化钠溶液与稀硫酸充分混合,所得溶液与下列哪种物质不反应( )
A.CuSO4 B.Fe
C.BaCl2 D.SO2
10.向盛有20g 10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应),其中正确的是( )
11.兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
【提出问题】氢氧化钠溶液与稀硫酸混合是否发生了化学反应?
【猜想与假设】a:两者混合发生了化学反应;b:两者混合没有发生化学反应。
【设计并实验】
实验操作 实验现象
甲同学 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1~2滴稀硫酸,振荡,同时测定溶液的pH 溶液pH减小但仍大于7
乙同学 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入稀硫酸 溶液由红色变为无色
【得出结论】氢氧化钠溶液与稀硫酸发生了化学反应。
(1)乙同学认为甲的实验设计不合理,原因是______________________,改进的方法是____________________________________。根据改进后的实验现象说明两者混合后发生了化学反应,写出氢氧化钠溶液与稀硫酸反应的化学方程式:________________________。甲同学也认为乙的实验设计也不合理,你是否赞同,说出你的理由:____________________
________________________________________________________________________
________________________________________________________________________。
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液的烧杯中加入不同体积某浓度的稀硫酸,充分混合后溶液的温度变化曲线如图(混合前稀硫酸和氢氧化钠溶液均为18℃)。
第11题图
(2)根据图示分析,稀硫酸和氢氧化钠的反应是________(填“吸热”或“放热”)反应,加入稀硫酸________mL时,两者恰好完全反应。
12.(深圳中考)某小组欲用4.9%的稀H2SO4测一瓶标签破损的NaOH溶液的质量分数。
(1)从一瓶标签模糊的NaOH溶液里取出几滴后向________(填写溶液名称)里滴加,呈红色。
第12题图
(2)取10g NaOH溶液样品,并与4.9%的稀硫酸溶液混合。由图可得,完全反应时,所用稀硫酸溶液中溶质的质量为________。
(3)求NaOH溶液样品中溶质的质量分数。
参考答案
【课堂笔记】
一、CaCl2+2H2O NaCl+H2O Na2SO4+2H2O
二、盐和水 2.H++OH-
【课时训练】
1-5.CABBB 6.C
7.(1)= (2)溶液变为红色 >
8.(1)Na2SO4、NaOH (2)10 38或39 无色
(3)过量的稀硫酸起冷却作用或散热 (4)7.4%
9-10.BB
11.(1)加入的稀硫酸不足 加入足量稀硫酸,直至溶液pH等于或小于7 2NaOH+H2SO4===Na2SO4+2H2O 不赞同,这是因为先滴入几滴无色酚酞试液时溶液变红色,然后再加入稀硫酸时溶液由红色变为无色,说明氢氧化钠和稀硫酸发生了反应 (2)放热 10
12.(1)酚酞试液 (2)0.98g (3)设10gNaOH溶液样品中溶质的质量为x
2NaOH+H2SO4===Na2SO4+2H2O
80 98
x 0.98g
= 解得:x=0.8g
NaOH溶液样品中溶质的质量分数:×100%=8%
一、碱+酸===盐+水
Ca(OH)2+2HCl===________________
NaOH+HCl===__________________
2NaOH+H2SO4===__________________
二、中和反应:酸和碱反应,生成________的反应
1.实验时用酸碱指示剂指示酸、碱是否恰好完全反应。
2.反应的本质是________===H2O。
3.根据此原理可以用熟石灰改良酸性土壤等。
A组 基础训练
1.(铁岭中考)中和反应在生产和生活中有着广泛的应用。下列应用与中和反应原理一定无关的是( )
A.服用含氢氧化铝的药物治疗胃酸过多症
B.用稀硫酸处理印染厂的碱性废水
C.在工业上,用熟石灰和纯碱制取烧碱
D.在蚊虫叮咬处涂抹稀氨水可以减轻蚊虫分泌出的蚁酸造成的痛痒
2.某种胃药的有效成分是 Mg(OH)2,服用后能减缓因胃酸过多而引起的疼痛。在 Mg(OH)2的作用过程中,胃液 pH 变化的情况可能是( )
3.(泸州中考)某实验室废水含有较多的盐酸,排放前应加入某种试剂将废水调至中性,下列试剂中最合适的是( )
A.AgNO3溶液 B.NaOH溶液
C.稀醋酸 D.KNO3溶液
4.(南宁中考)下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( )
A.在Ca(OH)2溶液中加入稀盐酸,无明显变化
B.在NaOH溶液中通入CO2气体,有白色沉淀生成
C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色
D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
第5题图
5.向氢氧化钠溶液中不断滴入盐酸(每点反应都很充分),得到如图的曲线,下列有关判断不正确的是( )
A.a点时溶液中有氢氧化钠和氯化钠
B.a点时的溶液能使紫色石蕊试液变红
C.b点时,HCl与NaOH恰好完全反应
D.b点到c点时,溶液中氯化钠的量不再增加
6.将20克10%的盐酸和20克10%的氢氧化钠溶液混合后,滴入石蕊试液,溶液为( )
A.紫色 B.蓝色 C.红色 D.无法判断
7.经测定,在任何水溶液中,均存在一定数量的H+[用n(H+)表示]和一定数量的OH-[用n(OH-)表示],n(H+)与n(OH-)的相对大小对应溶液的酸碱性如表所示:
n(H+)与n(OH-)的相对大小 溶液的酸碱性
n(H+)>n(OH-) 酸性
n(H+)=n(OH-) 中性
n(H+)<n(OH-) 碱性
据此分析:
(1)常温下测得水中pH=7,可知水中n(H+)________n(OH-)(填“>”、“=”或“<”)。
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞,现象是__________________________,再往上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液中
n(H+)________n(OH-)(填“>”、“=”或“<”)。
8.某化学兴趣小组在室温的条件下(温度为20℃),为了测定H2SO4与NaOH发生中和反应时放出的热量,在如图的小烧杯中加入8mL溶质质量分数为10%的NaOH溶液(密度1g/mL),并滴入3滴酚酞,测量其温度;另取过量的稀硫酸(密度1.12g/mL),测量其温度后逐量缓慢地加入到小烧杯中,边加边用环形玻璃棒搅拌;测得烧杯中溶液温度的变化与加入稀硫酸体积之间的关系如图所示。
第8题图
(1)当加入5mL稀硫酸时,溶液中的溶质有__________________(填写溶质化学式)。
(2)当加入约为________mL稀硫酸时,烧杯中溶液的温度达到最高。此时烧杯中溶液的温度约为________(填写整数)℃,烧杯中溶液颜色为________。
(3)当加入稀硫酸的体积大于10mL时,溶液温度下降的原因是
________________________________________________________________________。
(4)当溶液温度升到最高时,此时溶液中溶质质量分数是多少?(写出计算过程)
B组 自主提高
9.(湘潭中考)将等质量等溶质质量分数的氢氧化钠溶液与稀硫酸充分混合,所得溶液与下列哪种物质不反应( )
A.CuSO4 B.Fe
C.BaCl2 D.SO2
10.向盛有20g 10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应),其中正确的是( )
11.兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
【提出问题】氢氧化钠溶液与稀硫酸混合是否发生了化学反应?
【猜想与假设】a:两者混合发生了化学反应;b:两者混合没有发生化学反应。
【设计并实验】
实验操作 实验现象
甲同学 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1~2滴稀硫酸,振荡,同时测定溶液的pH 溶液pH减小但仍大于7
乙同学 在盛有10mL一定浓度的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入稀硫酸 溶液由红色变为无色
【得出结论】氢氧化钠溶液与稀硫酸发生了化学反应。
(1)乙同学认为甲的实验设计不合理,原因是______________________,改进的方法是____________________________________。根据改进后的实验现象说明两者混合后发生了化学反应,写出氢氧化钠溶液与稀硫酸反应的化学方程式:________________________。甲同学也认为乙的实验设计也不合理,你是否赞同,说出你的理由:____________________
________________________________________________________________________
________________________________________________________________________。
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液的烧杯中加入不同体积某浓度的稀硫酸,充分混合后溶液的温度变化曲线如图(混合前稀硫酸和氢氧化钠溶液均为18℃)。
第11题图
(2)根据图示分析,稀硫酸和氢氧化钠的反应是________(填“吸热”或“放热”)反应,加入稀硫酸________mL时,两者恰好完全反应。
12.(深圳中考)某小组欲用4.9%的稀H2SO4测一瓶标签破损的NaOH溶液的质量分数。
(1)从一瓶标签模糊的NaOH溶液里取出几滴后向________(填写溶液名称)里滴加,呈红色。
第12题图
(2)取10g NaOH溶液样品,并与4.9%的稀硫酸溶液混合。由图可得,完全反应时,所用稀硫酸溶液中溶质的质量为________。
(3)求NaOH溶液样品中溶质的质量分数。
参考答案
【课堂笔记】
一、CaCl2+2H2O NaCl+H2O Na2SO4+2H2O
二、盐和水 2.H++OH-
【课时训练】
1-5.CABBB 6.C
7.(1)= (2)溶液变为红色 >
8.(1)Na2SO4、NaOH (2)10 38或39 无色
(3)过量的稀硫酸起冷却作用或散热 (4)7.4%
9-10.BB
11.(1)加入的稀硫酸不足 加入足量稀硫酸,直至溶液pH等于或小于7 2NaOH+H2SO4===Na2SO4+2H2O 不赞同,这是因为先滴入几滴无色酚酞试液时溶液变红色,然后再加入稀硫酸时溶液由红色变为无色,说明氢氧化钠和稀硫酸发生了反应 (2)放热 10
12.(1)酚酞试液 (2)0.98g (3)设10gNaOH溶液样品中溶质的质量为x
2NaOH+H2SO4===Na2SO4+2H2O
80 98
x 0.98g
= 解得:x=0.8g
NaOH溶液样品中溶质的质量分数:×100%=8%
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
