人教版高中化学必修1第三章《金属及其化合物》检测题(含答案)
文档属性
| 名称 | 人教版高中化学必修1第三章《金属及其化合物》检测题(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 166.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-13 00:00:00 | ||
图片预览



文档简介
《金属及其化合物》检测题
一、单选题
1.下列有关金属及其合金的说法不正确的是
A.目前我国流通的硬币是由合金材料制成的
B.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C.出土的古代铜制品表面覆盖着铜绿,其主要成分是CuO
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
2.在含有FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断正确的是
A.加入KSCN溶液可能变红色 B.溶液中一定含有Fe2+
C.溶液中一定不含Cu2+ D.剩余固体中一定含有Fe
3.由Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少一部分。将上述混合物在空气中加热,有气体放出,下列判断正确的是( )
A.混合物中一定有Na2O2、NaHCO3 B.混合物中一定不含Na2CO3、NaCl
C.无法确定混合物中是否含有NaHCO3 D.混合物中一定不含Na2O2、NaCl
4.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.32克188O2,中含有的中子数为10NA
B.25℃时,1L pH=12的Ba(OH)2溶液中OH-数目为0.02NA
C.标况下,224L Cl2与足量H2O反应转移的电子数为0.1NA
D.4.6gNa与足量O2充分反应后的产物中含离子数目为0.3NA
5.将一定质量的金属钠放入100 mL 0.25 mol·L-1的氯化铝溶液中,反应后得到无色澄清溶液,其中除水外只含氯化钠和四羟基合铝酸钠,则加入金属钠的质量是( )
A.2.3 g B.1.725 g C.0.575 g D.3.45 g
6.现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案①:铝镁合金测定生成的气体在标准状况下的体积
实验方案②:铝镁合金测定生成的气体在标准状况下的体积
实验方案③:铝镁合金溶液过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是( )
A.都能 B.都不能 C.①不能,其它都能 D.②③不能,①能
7.钠和钾化学性质相似的根本原因是( )
A.都是碱金属 B.都与酸反应
C.都与水反应生成碱 D.原子的最外层都只有一个电子
8.下列说法正确的是 ( )
A.蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,则收集到的馏分沸点偏低
B.除去CuCl2溶液中的FeCl3杂质,可加过量的Cu,充分反应后过滤
C.实验室从海带提取单质碘的实验流程是:取样→浸泡→过滤→萃取
D.配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏大
9.用一定量的铁与足量的稀硫酸及足量的CuO制单质铜,有人设计了以下两种方案:
①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量为
A.一样多 B.①多 C.②多 D.无法判断
10.下列试剂的保存方法正确的是
A.氢氟酸存放在玻璃瓶中 B.NaOH溶液存在带橡皮塞的玻璃瓶中
C.水玻璃存放在滴瓶中 D.金属钠保存在冷水中
11.在一定条件下,铁与有关物质的反应,所得产物错误的为
A.FeFeCl3 B.FeFeS
C.FeFe(OH)3 D.FeFe3O4
12.化学与人类生产、生活密切相关,下列有关说法错误的是( )
A.Al2O3作耐火材料是因为氧化铝熔点高
B.用加热灼烧的方法可以区分羊毛毛线和腈纶毛线
C.波尔多液是由硫酸铜溶液、生石灰和水制得,可用于防治植物的病虫害
D.玉米油和鸡蛋清均是高分子化合物,它们均能水解生成氨基酸
13.下列关于Na2CO3和NaHCO3的叙述中正确的是( )
A.常温下,Na2CO3比NaHCO3的溶解度小
B.质量相同的Na2CO3和NaHCO3与足量盐酸反应可生成等量的CO2
C.石灰水可鉴别Na2CO3和NaHCO3溶液
D.相同条件下Na2CO3和NaHCO3分别与盐酸反应,后者放出气体快
14.化学与生产和生活密切相关,下列有关说法正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
C.泡沫灭火器中用的是小苏打和硫酸铝
D.二氧化硫有毒,严禁将其添加到任何食品和饮料中
二、实验题
15.某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是__________________________
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是____________(填序号);记录C的液面位置时,除平视外,还应____________________________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”或“不受影响”)。
(5)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器是胶头滴管、玻璃棒和_____________________(填仪器规格和名称)
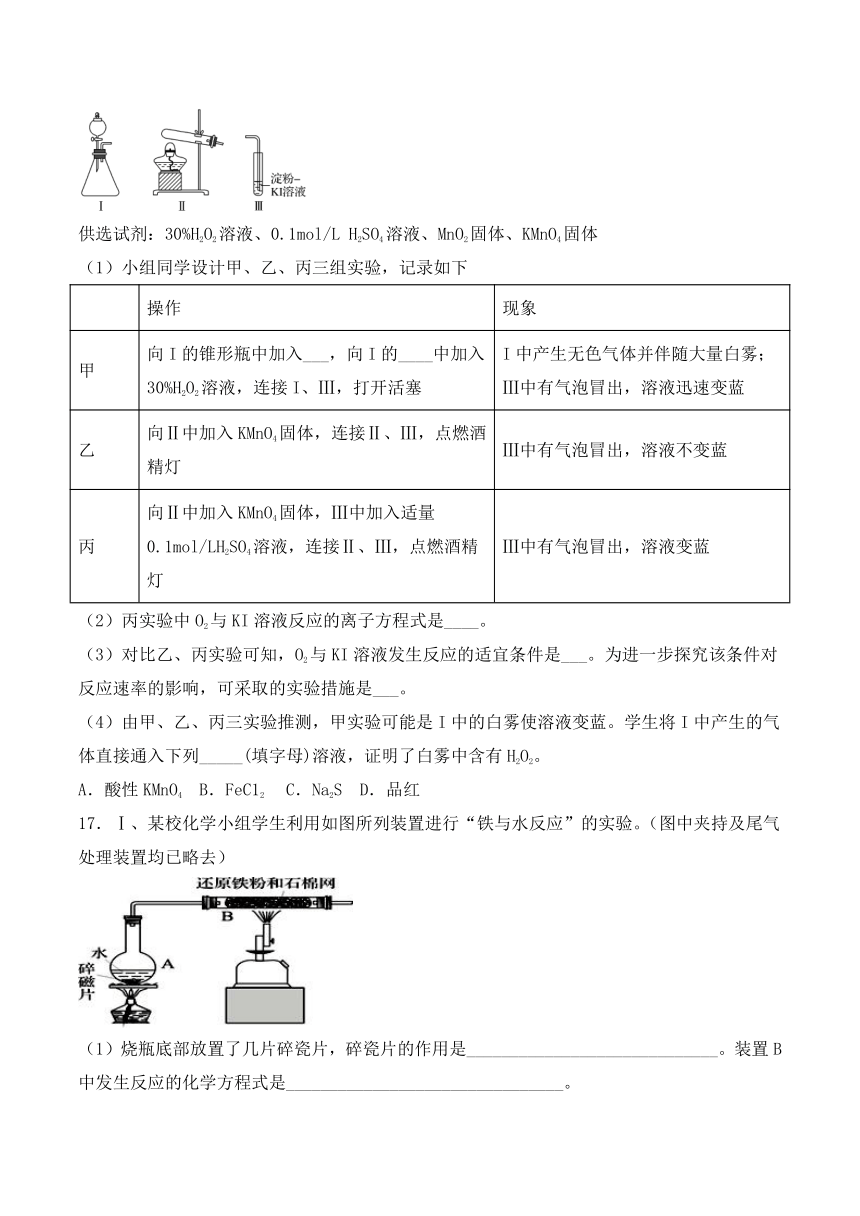
16.某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 现象
甲 向I的锥形瓶中加入___,向I的____中加入30%H2O2溶液,连接I、Ⅲ,打开活塞 I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝
乙 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 Ⅲ中有气泡冒出,溶液不变蓝
丙 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 Ⅲ中有气泡冒出,溶液变蓝
(2)丙实验中O2与KI溶液反应的离子方程式是____。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___。为进一步探究该条件对反应速率的影响,可采取的实验措施是___。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____(填字母)溶液,证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeC12 C.Na2S D.品红
17.Ⅰ、某校化学小组学生利用如图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_____________________________。装置B中发生反应的化学方程式是________________________________。
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法____________________________________。
Ⅱ、利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
(1)a电极的材料应为__________,电极反应式为__________________。
(2)d为苯,其作用是________________。
(3)当电解一段时间后看到白色Fe(OH)2沉淀,然后向溶液中通入空气,可观察的现象是__________________。
三、推断题
18.如图转化关系中,①B、E、F、Y通常条件下均是气体;②E、F相遇会产生白烟;③A、B、G、Y都是常见的主族元素组成的单质,其余均是化合物;④A、C、H焰色反应均呈黄色。
请按要求回答下列问题:
(1)化合物C的电子式是___________________________________________。
(2)以上反应属于氧化还原反应的有________(填反应编号)。
(3)E与F反应的化学方程式为__________________在加热条件下C溶液与D溶液反应的离子方程式为___________________________。
(4)G与C的溶液发生反应的离子方程式为____________________。
(5)下列叙述正确的是________(填序号)。
a.利用图装置可制取气体F
b.将干燥的红色石蕊试纸接近图中a处,可观察到试纸变蓝
c.图中收集完气体后,取下试管,在导管口b处堵上浸有稀硫酸的棉花可防止气体F污染空气
d.进行图所示实验时,可观察到液体迅速充满试管并变为红色,说明气体F极易溶于水,其水溶液显碱性
19.X、Y、Z、W、M、R六种短周期元素,周期表中位置如下:
试回答下列问题:
(1)X、Z、W、R四种元素的原子半径由大到小的排列顺序是______(用元素符号表示)。
(2)由X、Z、W、R四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为_____________________________。
(3)由X、W、M、R四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式_________________________________。
(4)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是____________________(用方程式及必要的文字说明)。0.1mol·L-1该溶液中各离子浓度由大到小的顺序为________________________。
(5)由X、Z、W、R和Fe五种元素可组成类似明矾的化合物T(相对分子质量为392),1molT中含有6mol结晶水。对化合物T进行如下实验:
a.取T的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取T的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
则T的化学式为_____________________。
20.为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:
(1)X中的非金属元素是_________。
(2)黑色化合物高温空气红棕色化合物的化学方程式是___________________。
(3)设计实验方案检验黄色溶液中的金属阳离子_________________________。
四、计算题
21.把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:
(1)该合金中铝的质量分数_______;
(2)该合金中铝和镁的物质的量之比_______;
(3)若向反应后的溶液中加入足量的NaOH溶液,最终能产生沉淀_______克?
参考答案
1.C2.B3.A4.D5.A6.A7.D8.D9.C10.B11.C12.D13.D14.C
15.NaOH溶液 除去铝镁合金表面的氧化膜 ①④③② 使D和C的液面相平 偏小 500 mL容量瓶
16.MnO2固体 分液漏斗 O2+4I-+4H+=2I2+2H2O 酸性环境 使用不同浓度的稀硫酸作对比实验 AD
17.防止暴沸 3Fe+4H2O(g)Fe3O4+4H2 取少量滤液,滴入几滴KSCN溶液,观察到溶液变红色,则溶液中有Fe3+,否则无 Fe Fe-2e-=Fe2+ 隔绝空气,防止生成的Fe(OH)2被氧化 白色沉淀迅速变为灰绿色,最后变成红褐色
18. ①②③ HCl+NH3=NH4Cl OH-+NH4+NH3↑+H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ acd
19.S>N>O>H 3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O HSO3-+H+=SO2+H2O KHC2O4溶液中存在HC2O4-的电离与水解,即HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,电离程度大于水解程度,使溶液中的c(H+)>c(OH-),溶液显酸性 c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) (NH4)2Fe(SO4)2·6H2O
20.S 4FeS+7O2 2Fe2O3+4SO2 取少量黄色溶液,滴加KSCN溶液,若变血红色,说明存在Fe3+
21.52.9% 1∶1 5.8
一、单选题
1.下列有关金属及其合金的说法不正确的是
A.目前我国流通的硬币是由合金材料制成的
B.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
C.出土的古代铜制品表面覆盖着铜绿,其主要成分是CuO
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
2.在含有FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断正确的是
A.加入KSCN溶液可能变红色 B.溶液中一定含有Fe2+
C.溶液中一定不含Cu2+ D.剩余固体中一定含有Fe
3.由Na2O2、Na2CO3、NaHCO3、NaCl中的某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少一部分。将上述混合物在空气中加热,有气体放出,下列判断正确的是( )
A.混合物中一定有Na2O2、NaHCO3 B.混合物中一定不含Na2CO3、NaCl
C.无法确定混合物中是否含有NaHCO3 D.混合物中一定不含Na2O2、NaCl
4.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.32克188O2,中含有的中子数为10NA
B.25℃时,1L pH=12的Ba(OH)2溶液中OH-数目为0.02NA
C.标况下,224L Cl2与足量H2O反应转移的电子数为0.1NA
D.4.6gNa与足量O2充分反应后的产物中含离子数目为0.3NA
5.将一定质量的金属钠放入100 mL 0.25 mol·L-1的氯化铝溶液中,反应后得到无色澄清溶液,其中除水外只含氯化钠和四羟基合铝酸钠,则加入金属钠的质量是( )
A.2.3 g B.1.725 g C.0.575 g D.3.45 g
6.现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案①:铝镁合金测定生成的气体在标准状况下的体积
实验方案②:铝镁合金测定生成的气体在标准状况下的体积
实验方案③:铝镁合金溶液过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是( )
A.都能 B.都不能 C.①不能,其它都能 D.②③不能,①能
7.钠和钾化学性质相似的根本原因是( )
A.都是碱金属 B.都与酸反应
C.都与水反应生成碱 D.原子的最外层都只有一个电子
8.下列说法正确的是 ( )
A.蒸馏实验时,若温度计水银球高于蒸馏烧瓶支管口,则收集到的馏分沸点偏低
B.除去CuCl2溶液中的FeCl3杂质,可加过量的Cu,充分反应后过滤
C.实验室从海带提取单质碘的实验流程是:取样→浸泡→过滤→萃取
D.配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏大
9.用一定量的铁与足量的稀硫酸及足量的CuO制单质铜,有人设计了以下两种方案:
①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量为
A.一样多 B.①多 C.②多 D.无法判断
10.下列试剂的保存方法正确的是
A.氢氟酸存放在玻璃瓶中 B.NaOH溶液存在带橡皮塞的玻璃瓶中
C.水玻璃存放在滴瓶中 D.金属钠保存在冷水中
11.在一定条件下,铁与有关物质的反应,所得产物错误的为
A.FeFeCl3 B.FeFeS
C.FeFe(OH)3 D.FeFe3O4
12.化学与人类生产、生活密切相关,下列有关说法错误的是( )
A.Al2O3作耐火材料是因为氧化铝熔点高
B.用加热灼烧的方法可以区分羊毛毛线和腈纶毛线
C.波尔多液是由硫酸铜溶液、生石灰和水制得,可用于防治植物的病虫害
D.玉米油和鸡蛋清均是高分子化合物,它们均能水解生成氨基酸
13.下列关于Na2CO3和NaHCO3的叙述中正确的是( )
A.常温下,Na2CO3比NaHCO3的溶解度小
B.质量相同的Na2CO3和NaHCO3与足量盐酸反应可生成等量的CO2
C.石灰水可鉴别Na2CO3和NaHCO3溶液
D.相同条件下Na2CO3和NaHCO3分别与盐酸反应,后者放出气体快
14.化学与生产和生活密切相关,下列有关说法正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B.英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
C.泡沫灭火器中用的是小苏打和硫酸铝
D.二氧化硫有毒,严禁将其添加到任何食品和饮料中
二、实验题
15.某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是__________________________
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂。上述操作的顺序是____________(填序号);记录C的液面位置时,除平视外,还应____________________________。
(4)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”“偏小”或“不受影响”)。
(5)实验中需要用480 mL 1 mol/L的盐酸,配制过程中用于定容的玻璃仪器是胶头滴管、玻璃棒和_____________________(填仪器规格和名称)
16.某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
供选试剂:30%H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下
操作 现象
甲 向I的锥形瓶中加入___,向I的____中加入30%H2O2溶液,连接I、Ⅲ,打开活塞 I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝
乙 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 Ⅲ中有气泡冒出,溶液不变蓝
丙 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/LH2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 Ⅲ中有气泡冒出,溶液变蓝
(2)丙实验中O2与KI溶液反应的离子方程式是____。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___。为进一步探究该条件对反应速率的影响,可采取的实验措施是___。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列_____(填字母)溶液,证明了白雾中含有H2O2。
A.酸性KMnO4 B.FeC12 C.Na2S D.品红
17.Ⅰ、某校化学小组学生利用如图所列装置进行“铁与水反应”的实验。(图中夹持及尾气处理装置均已略去)
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_____________________________。装置B中发生反应的化学方程式是________________________________。
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法____________________________________。
Ⅱ、利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
(1)a电极的材料应为__________,电极反应式为__________________。
(2)d为苯,其作用是________________。
(3)当电解一段时间后看到白色Fe(OH)2沉淀,然后向溶液中通入空气,可观察的现象是__________________。
三、推断题
18.如图转化关系中,①B、E、F、Y通常条件下均是气体;②E、F相遇会产生白烟;③A、B、G、Y都是常见的主族元素组成的单质,其余均是化合物;④A、C、H焰色反应均呈黄色。
请按要求回答下列问题:
(1)化合物C的电子式是___________________________________________。
(2)以上反应属于氧化还原反应的有________(填反应编号)。
(3)E与F反应的化学方程式为__________________在加热条件下C溶液与D溶液反应的离子方程式为___________________________。
(4)G与C的溶液发生反应的离子方程式为____________________。
(5)下列叙述正确的是________(填序号)。
a.利用图装置可制取气体F
b.将干燥的红色石蕊试纸接近图中a处,可观察到试纸变蓝
c.图中收集完气体后,取下试管,在导管口b处堵上浸有稀硫酸的棉花可防止气体F污染空气
d.进行图所示实验时,可观察到液体迅速充满试管并变为红色,说明气体F极易溶于水,其水溶液显碱性
19.X、Y、Z、W、M、R六种短周期元素,周期表中位置如下:
试回答下列问题:
(1)X、Z、W、R四种元素的原子半径由大到小的排列顺序是______(用元素符号表示)。
(2)由X、Z、W、R四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为_____________________________。
(3)由X、W、M、R四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式_________________________________。
(4)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是____________________(用方程式及必要的文字说明)。0.1mol·L-1该溶液中各离子浓度由大到小的顺序为________________________。
(5)由X、Z、W、R和Fe五种元素可组成类似明矾的化合物T(相对分子质量为392),1molT中含有6mol结晶水。对化合物T进行如下实验:
a.取T的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取T的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
则T的化学式为_____________________。
20.为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:
(1)X中的非金属元素是_________。
(2)黑色化合物高温空气红棕色化合物的化学方程式是___________________。
(3)设计实验方案检验黄色溶液中的金属阳离子_________________________。
四、计算题
21.把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6L H2(标准状况下).试计算:
(1)该合金中铝的质量分数_______;
(2)该合金中铝和镁的物质的量之比_______;
(3)若向反应后的溶液中加入足量的NaOH溶液,最终能产生沉淀_______克?
参考答案
1.C2.B3.A4.D5.A6.A7.D8.D9.C10.B11.C12.D13.D14.C
15.NaOH溶液 除去铝镁合金表面的氧化膜 ①④③② 使D和C的液面相平 偏小 500 mL容量瓶
16.MnO2固体 分液漏斗 O2+4I-+4H+=2I2+2H2O 酸性环境 使用不同浓度的稀硫酸作对比实验 AD
17.防止暴沸 3Fe+4H2O(g)Fe3O4+4H2 取少量滤液,滴入几滴KSCN溶液,观察到溶液变红色,则溶液中有Fe3+,否则无 Fe Fe-2e-=Fe2+ 隔绝空气,防止生成的Fe(OH)2被氧化 白色沉淀迅速变为灰绿色,最后变成红褐色
18. ①②③ HCl+NH3=NH4Cl OH-+NH4+NH3↑+H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ acd
19.S>N>O>H 3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O HSO3-+H+=SO2+H2O KHC2O4溶液中存在HC2O4-的电离与水解,即HC2O4-?H++C2O42-,HC2O4-+H2O?H2C2O4+OH-,电离程度大于水解程度,使溶液中的c(H+)>c(OH-),溶液显酸性 c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-) (NH4)2Fe(SO4)2·6H2O
20.S 4FeS+7O2 2Fe2O3+4SO2 取少量黄色溶液,滴加KSCN溶液,若变血红色,说明存在Fe3+
21.52.9% 1∶1 5.8
