人教版九年级化学上册复习课件:第五单元 化学方程式(12张PPT)
文档属性
| 名称 | 人教版九年级化学上册复习课件:第五单元 化学方程式(12张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 676.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-14 21:03:11 | ||
图片预览



文档简介
(共12张PPT)
第五单元化学方程式
复习
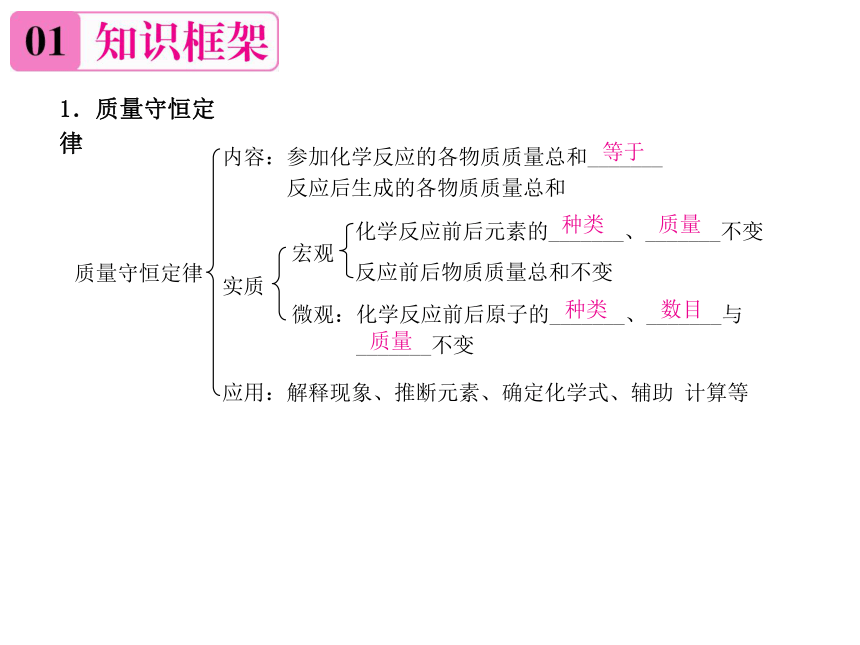
1.质量守恒定律
等于
种类
质量
种类
质量
数目
2.化学方程式
反应物
生成物
反应条件
质量比
微粒个数比
客观事实
质量守恒定律
易错点1 对质量守恒定律内容的理解
1.建立基本的化学观念可以让我们更好地理解化学,如形成守恒观,可以更好地理解质量守恒定律,下列说法正确的是( )
A.10 g水加热后变成了10 g水蒸气,这一变化符合质量守恒定律
B.a g S与b g O2完全反应,生成(a+b) g SO2
C.镁条燃烧后固体质量增加,故质量守恒定律不是普遍规律
D.碳酸钠溶液和稀盐酸混合反应后溶液总质量减小,该变化遵守质量守恒定律
D
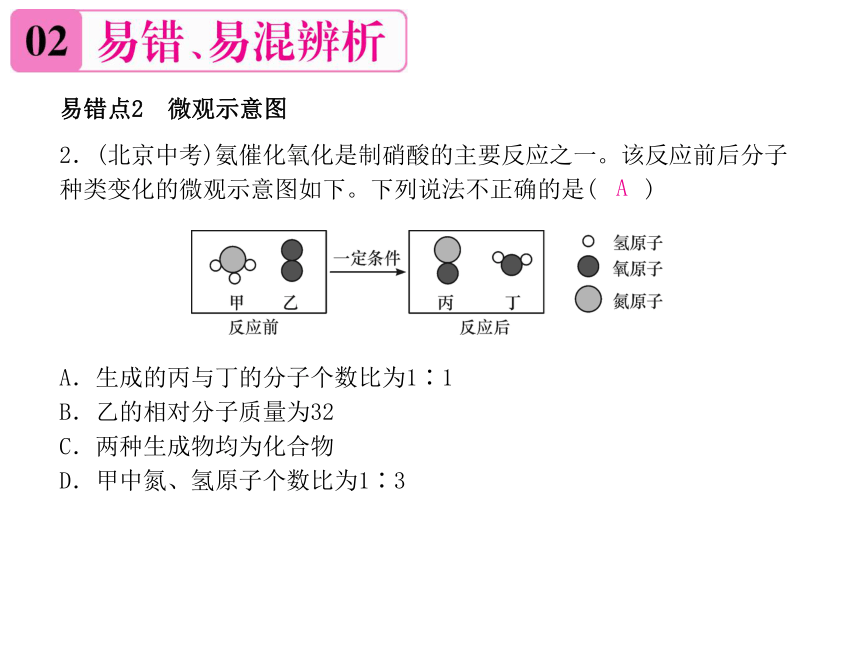
易错点2 微观示意图
2.(北京中考)氨催化氧化是制硝酸的主要反应之一。该反应前后分子种类变化的微观示意图如下。下列说法不正确的是( )
A.生成的丙与丁的分子个数比为1∶1
B.乙的相对分子质量为32
C.两种生成物均为化合物
D.甲中氮、氢原子个数比为1∶3
A
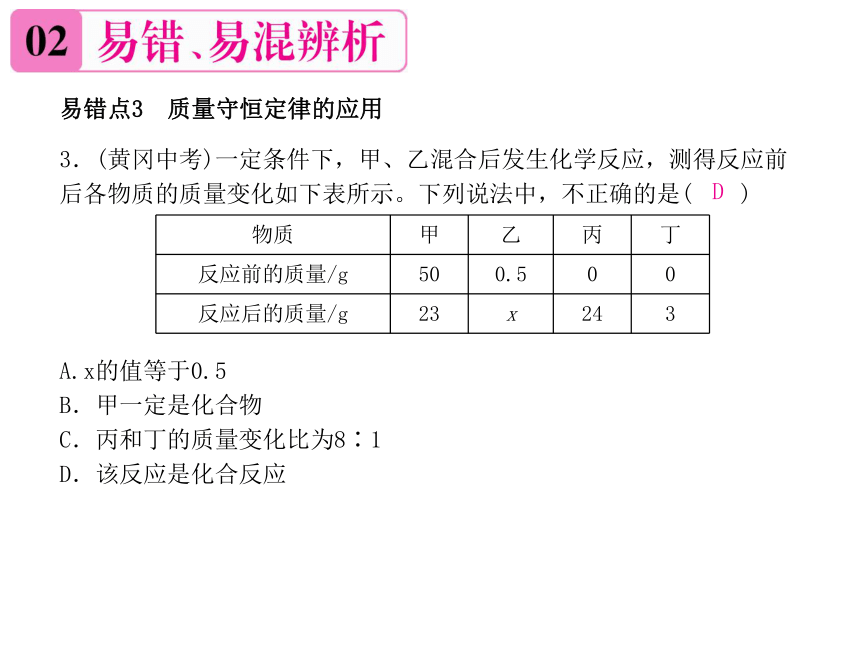
易错点3 质量守恒定律的应用
3.(黄冈中考)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( )
A.x的值等于0.5
B.甲一定是化合物
C.丙和丁的质量变化比为8∶1
D.该反应是化合反应
D
物质 甲 乙 丙 丁
反应前的质量/g 50 0.5 0 0
反应后的质量/g 23 x 24 3
4.物质X在4.8 g氧气中恰好完全燃烧,其化学方程式可表示为4X+3O2===2R2+6H2O,测得R2和H2O的质量分别为2.8 g和5.4 g,下列判断中正确的是( )
A.X的相对分子质量为17
B.该反应前后R元素的化合价降低了
C.参加反应的X的质量为4.4 g
D.X中一定含有R、H元素,可能含有氧元素
A
易错点4 化学方程式的书写
C
易错点5 根据化学方程式的计算
解:(1)所设未知量不能带单位。
(2)化学方程式未配平。
(3)H2的相对分子质量算错。
(4)解答x=211.25 g错误。
1.(关注创新意识)纳米铁粉在空气中不自燃,稍加热即剧烈燃烧,某化学兴趣小组设计如图所示实验装置验证纳米铁粉燃烧符合质量守恒定律。
【步骤与现象】
(1)按上图所示连接装置、装药品。
(2)称量整个装置质量为m。
(3)用激光手电照射纳米铁粉,剧烈燃烧,得黑色固体。
(4)(冷却后)___________________________。
【反思与分析】
(5)纳米铁粉燃烧的化学方程式是______________________。
(6)实验过程中气球变化情况是____________________。
(7)锥形瓶底放水的原因是___________________________________。
再称量整个装置质量仍为m
先膨胀,后变小
防止溅落的高温熔融物使瓶底炸裂
2.(关注化学模型)如图是某反应的微观示意图。请回答下列问题。
(1)B框中的物质属于____(填序号)。
①化合物 ②单质 ③氧化物
(2)此反应的化学方程式为_________________________________。
(3)此图说明化学反应前后发生改变的粒子是________。
②
分子
3.(关注生产·生活)(娄底中考)高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产该物质,反应原理用化学方程式表示为:
3NaClO+2Fe(NO3)3+10NaOH===2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO)中Cl元素的化合价为______。
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为_______(填最简整数比)。
(3)现要制得830 kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?
7∶8
+1
第五单元化学方程式
复习
1.质量守恒定律
等于
种类
质量
种类
质量
数目
2.化学方程式
反应物
生成物
反应条件
质量比
微粒个数比
客观事实
质量守恒定律
易错点1 对质量守恒定律内容的理解
1.建立基本的化学观念可以让我们更好地理解化学,如形成守恒观,可以更好地理解质量守恒定律,下列说法正确的是( )
A.10 g水加热后变成了10 g水蒸气,这一变化符合质量守恒定律
B.a g S与b g O2完全反应,生成(a+b) g SO2
C.镁条燃烧后固体质量增加,故质量守恒定律不是普遍规律
D.碳酸钠溶液和稀盐酸混合反应后溶液总质量减小,该变化遵守质量守恒定律
D
易错点2 微观示意图
2.(北京中考)氨催化氧化是制硝酸的主要反应之一。该反应前后分子种类变化的微观示意图如下。下列说法不正确的是( )
A.生成的丙与丁的分子个数比为1∶1
B.乙的相对分子质量为32
C.两种生成物均为化合物
D.甲中氮、氢原子个数比为1∶3
A
易错点3 质量守恒定律的应用
3.(黄冈中考)一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是( )
A.x的值等于0.5
B.甲一定是化合物
C.丙和丁的质量变化比为8∶1
D.该反应是化合反应
D
物质 甲 乙 丙 丁
反应前的质量/g 50 0.5 0 0
反应后的质量/g 23 x 24 3
4.物质X在4.8 g氧气中恰好完全燃烧,其化学方程式可表示为4X+3O2===2R2+6H2O,测得R2和H2O的质量分别为2.8 g和5.4 g,下列判断中正确的是( )
A.X的相对分子质量为17
B.该反应前后R元素的化合价降低了
C.参加反应的X的质量为4.4 g
D.X中一定含有R、H元素,可能含有氧元素
A
易错点4 化学方程式的书写
C
易错点5 根据化学方程式的计算
解:(1)所设未知量不能带单位。
(2)化学方程式未配平。
(3)H2的相对分子质量算错。
(4)解答x=211.25 g错误。
1.(关注创新意识)纳米铁粉在空气中不自燃,稍加热即剧烈燃烧,某化学兴趣小组设计如图所示实验装置验证纳米铁粉燃烧符合质量守恒定律。
【步骤与现象】
(1)按上图所示连接装置、装药品。
(2)称量整个装置质量为m。
(3)用激光手电照射纳米铁粉,剧烈燃烧,得黑色固体。
(4)(冷却后)___________________________。
【反思与分析】
(5)纳米铁粉燃烧的化学方程式是______________________。
(6)实验过程中气球变化情况是____________________。
(7)锥形瓶底放水的原因是___________________________________。
再称量整个装置质量仍为m
先膨胀,后变小
防止溅落的高温熔融物使瓶底炸裂
2.(关注化学模型)如图是某反应的微观示意图。请回答下列问题。
(1)B框中的物质属于____(填序号)。
①化合物 ②单质 ③氧化物
(2)此反应的化学方程式为_________________________________。
(3)此图说明化学反应前后发生改变的粒子是________。
②
分子
3.(关注生产·生活)(娄底中考)高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产该物质,反应原理用化学方程式表示为:
3NaClO+2Fe(NO3)3+10NaOH===2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO)中Cl元素的化合价为______。
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为_______(填最简整数比)。
(3)现要制得830 kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?
7∶8
+1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
