人教版九年级化学上册课件:第五单元 课题1 质量守恒定律(29张PPT)
文档属性
| 名称 | 人教版九年级化学上册课件:第五单元 课题1 质量守恒定律(29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 959.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-14 21:05:23 | ||
图片预览








文档简介
(共29张PPT)
课题1 质量守恒定律
第1课时 质量守恒定律
1.质量守恒定律
内 容:参加_________的各物质的质量______,等于反应后生成的各物质的质量______,这个规律叫做质量守恒定律。
注 意:(1)质量守恒定律强调的是“质量守恒”,而体积和分子个数不一定守恒。
(2)质量守恒定律适用于所有的化学变化,不适用于物理变化。
化学反应
总和
总和
2.质量守恒的原因
化学反应实质:参加反应的各物质(反应物)的______________而生成其他物质(生成物)的过程。
微观解释:在化学反应中,反应前后原子的______没有改变,______没有增减,原子的______也没有改变。
点 拨:质量守恒定律有三个方面的含义:物质的总质量守恒;元素的种类、质量不变;原子的种类、数目、质量不变。
原子重新组合
种类
数目
质量
3.质量守恒定律的应用
应 用:(1)解释化学反应中的“不守恒”现象。如镁条在空气中燃烧后,生成物的质量比原来的镁条质量大,是因为生成物的质量比原来的镁条多了______的质量。
(2)判断物质的组成。如某物质在空气中燃烧后生成了二氧化碳和水,则该物质中一定含有____元素和____元素,可能含有____元素。
(3)求某种反应物或生成物的质量。
(4)推断反应物或生成物的组成(化学式)。
氧气
碳
氢
氧
考点1 质量守恒定律的探究
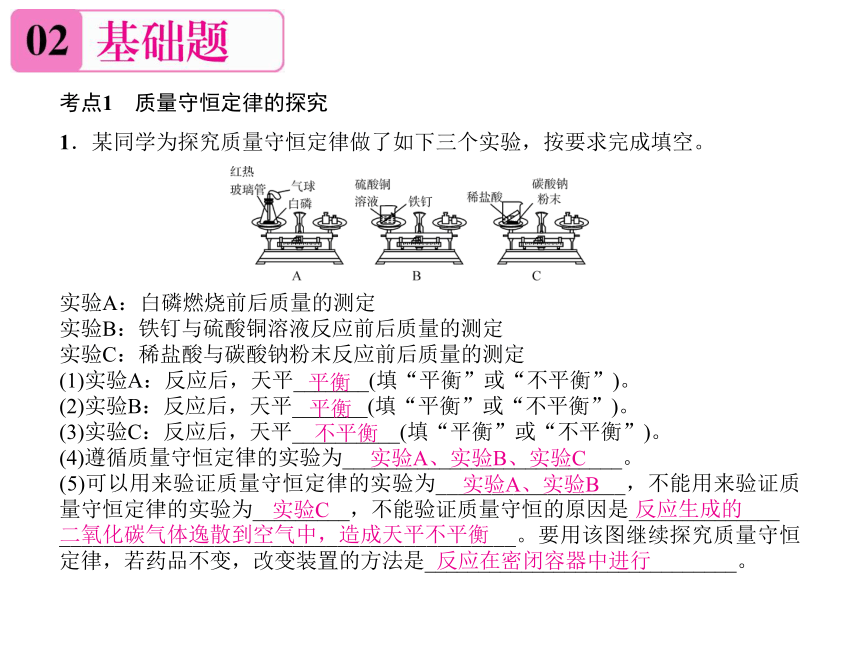
1.某同学为探究质量守恒定律做了如下三个实验,按要求完成填空。
实验A:白磷燃烧前后质量的测定
实验B:铁钉与硫酸铜溶液反应前后质量的测定
实验C:稀盐酸与碳酸钠粉末反应前后质量的测定
(1)实验A:反应后,天平_______(填“平衡”或“不平衡”)。
(2)实验B:反应后,天平_______(填“平衡”或“不平衡”)。
(3)实验C:反应后,天平__________(填“平衡”或“不平衡”)。
(4)遵循质量守恒定律的实验为__________________________。
(5)可以用来验证质量守恒定律的实验为_________________,不能用来验证质量守恒定律的实验为_________,不能验证质量守恒的原因是______________
_________________________________________。要用该图继续探究质量守恒定律,若药品不变,改变装置的方法是_____________________________。
平衡
不平衡
平衡
实验A、实验B、实验C
实验A、实验B
实验C
反应生成的
二氧化碳气体逸散到空气中,造成天平不平衡
反应在密闭容器中进行
考点2 质量守恒定律的理解
2.下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.50 mL水和50 mL乙醇混合后总体积小于100 mL
C.在100 g过氧化氢溶液中,含有30 g过氧化氢和70 g 水
D.高锰酸钾受热分解后,剩余固体的质量减小
3.下列对质量守恒定律的理解错误的是( )
A.质量守恒定律只适用于化学反应,不适用于物理变化
B.质量守恒定律研究的内容仅是指“质量”,不能推广到其他物理量
C.催化剂可以改变其他物质的化学反应速率,有催化剂参加的反应也遵守质量守恒定律
D.蜡烛燃烧后质量减轻,不符合质量守恒定律
D
D
考点3 质量守恒定律的微观解释
4.在化学变化中,一定不变的是( )
①物质种类 ②元素种类 ③分子种类 ④原子种类 ⑤分子数目 ⑥原子数目
A.②④⑤⑥ B.①②⑥
C.②④⑥ D.③④⑥
5.(巴中中考)炼铁炉中某反应的微观示意图(不同的球代表不同原子)如图所示,下列说法不正确的是( )
A.该反应属于化合反应
B.反应前后原子数目没有变化
C.反应前后各元素化合价均不变
D.反应前后元素种类不变
C
C
考点4 质量守恒定律的应用
6.(邵阳中考)AgNO3固体见光或受热易分解,故保存在棕色瓶中,AgNO3见光分解时产生一种有刺激性气味的气体,该气体可能是 ( )
A.H2S B.SO2 C.N2 D.NO2
7.(邵阳中考)某化学反应可表示为二氧化碳+水→M+氧气,根据以上信息,下列关于M的组成说法中正确的是( )
A.一定含有C、H元素,可能含有O元素
B.只含有C、H元素
C.含有C、H、O三种元素
D.无法确定
D
A
8.关于质量守恒定律的理解,错误的是( )
A.宏观:实际参加反应的反应物总质量等于生成物总质量
B.微观:反应前后原子种类和个数不变
C.某可燃物燃烧后生成二氧化碳和水,该可燃物中一定含有碳、氢元素
D.煤燃烧后灰渣质量小于煤,不能用质量守恒定律解释
D
9.镁带在耐高温的密闭容器(内含空气)中燃烧,如图所示,能正确表示容器里所盛物质总质量变化的是( )
C
10.如图表示三种物质在密闭容器中反应前后质量比例的变化,下列说法正确的是( )
A.该反应中CO2起催化作用
B.该反应中CO是生成物
C.该反应是分解反应
D.该反应是化合反应
D
11.实验室用a g过氧化氢和b g二氧化锰反应制取氧气,完全分解后剩余在试管内的物质的总质量为c g,则生成氧气的质量为___________g,生成水的质量为________g。
12.柴油机尾气中的主要污染物是氮氧化合物,某种尾气处理技术利用氨气与氮氧化合物发生化学反应,降低污染物排放,反应的微观示意图如下:
(1)一个A分子是由____个原子构成的。
(2)反应物的化学式为_______、_______。
(3)上述反应中,一定发生改变的是______(填字母)。
A.元素种类 B.分子种类
C.原子种类
(a+b-c)
(c-b)
4
NH3
NO
B
13.早在1673年,英国化学家波义耳在一个密闭的容器中煅烧金属汞,然后打开称量,发现反应后固体物质的质量增加了。
(1)波义耳的实验结果是否违反质量守恒定律?简析原因。
______________________________________________________________________________________。
(2)试从原子的角度解释质量守恒定律。
_____________________________________________________________________________。
不违反;金属汞与空气中的氧气反应,生成物的质量应该等于金属汞质量与氧气质量之和
在一切化学反应中,反应前后原子的种类、数目均没有改变,原子的质量也不改变
请写出下列反应的符号表达式:
磷在空气中燃烧:______________________________,
铁与硫酸铜反应:______________________________,
镁在氧气中燃烧:______________________________,
水在通电条件下分解:__________________________,
木炭在空气中燃烧:____________________________,
分解过氧化氢制取氧气:________________________。
第2课时 化学方程式
1.概 念:用________表示化学反应的式子。
2.意义与读法(以C+O2 CO2为例)
质的方面:表示________、_______和反应条件。读作:碳与_______在点燃的条件下反应生成________。
量的方面:(1)宏观:表示反应物、生成物各物质之间的_______。读作:在点燃的条件下,每____份质量的碳和____份质量的氧气完全反应生成____份质量的二氧化碳。
(2)微观:表示反应物、生成物各物质之间的_________比。读作:在点燃的条件下,每1个碳原子与1个氧分子完全反应生成1个二氧化碳分子。
注 意:在化学方程式中,“+”不能读作“加”,应读作“和”或“与”;“===”不能读作“等于”,应读作“生成”。
化学式
反应物
生成物
氧气
二氧化碳
12
32
44
粒子个数
质量
考点1 化学方程式及其意义和读法
1.(荆州中考)根据化学方程式不能获得的信息有( )
A.化学反应发生的条件
B.化学反应的快慢
C.反应物和生成物的质量比
D.化学反应中的反应物和生成物
B
2.(来宾中考)关于2H2+O2 2H2O的读法不正确的是( )
A.氢气与氧气在点燃的条件下生成水
B.每2个氢分子与1个氧分子完全反应,生成2个水分子
C.常温下,每2体积的氢气与l体积的氧气完全反应,生成2体积的水
D.每4份质量的氢气与32份质量的氧气完全反应,生成36份质量的水
C
3.同学们对化学反应方程式:C+O2 CO2有下面四种说法,其中错误的是( )
D
4.写出下列化学方程式中各物质的质量比。
(1)4P+5O2 2P2O5
m(P)∶m(O2)∶m(P2O5)=
__________________________________________________________________。
(2)2KClO3 2KCl+3O2↑
m(KClO3)∶m(KCl)∶m(O2)=
__________________________________________________________________。
(3)2H2O 2H2↑+O2↑
m(H2O)∶m(H2)∶m(O2)=
__________________________________________________________________。
(4)Fe+CuSO4===FeSO4+Cu
m(Fe)∶m(CuSO4)∶m(FeSO4)∶m(Cu)=
__________________________________________________________________。
(4×31)∶(5×16×2)∶[2×(31×2+16×5)]=31∶40∶71
[2×(39+35.5+16×3)]∶[2×(39+35.5)]∶(3×16×2)=245∶149∶96
[2×(1×2+16)]∶(2×1×2)∶(16×2)=9∶1∶8
56∶(64+32+16×4)∶(56+32+16×4)∶64=7∶20∶19∶8
考点2 质量守恒定律在化学方程式中的应用
5.(眉山中考)10 g A和足量B混合加热,充分反应后生成8 g C和4 g D,则参加反应的A和B的质量比为( )
A.1∶1 B.2∶1
C.4∶1 D.5∶1
6.(邵阳中考)某纯净物X在氧气中燃烧的化学方程式为2X+5O2 4CO2+2H2O,则X的化学式是( )
A.C2H4 B.C2H5OH
C.C2H2 D.CH4
D
C
7.如图是用比例模型来表示物质间发生化学反应的微观示意图。图中“ ”
“ ”分别表示两种元素的原子,能用该图示表示的化学反应是( )
A.2CO+O2 2CO2
B.N2+3H2 2NH3
C.C+O2 CO2
D.H2+Cl2 2HCl
A
8.(淄博中考)镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件;②反应速率;③反应物、生成物各物质间的质量关系;④反应的微观过程;⑤反应过程中的能量变化;⑥反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是( )
A.①③④ B.②③⑤
C.①③⑥ D.②④⑥
C
9.不能从以下两个化学方程式中获取的信息是( )
反应①:2H2O2 2H2O+O2↑
反应②:2KMnO4 K2MnO4+MnO2+O2↑
A.反应①和反应②都有气体生成
B.反应①和反应②是在不同条件下进行的
C.反应①和反应②都放出热量
D.反应①和反应②的反应物中都含氧元素
C
10.现有三个化学反应:①S+O2 SO2;②2Mg+O2 2MgO;
③4P+5O2 2P2O5。
(1)比较发现,它们的相似之处:从反应类型上看都是__________;从反应条件上看都是_______;从反应的能量来看都是__________;从物质类别上看生成物都是__________。我也能写出另外一个符合这三点的化学方程式:
____________________。
(2)某同学课外学习Cu2(OH)2CO32CuO+H2O+CO2↑,他发现这个反应和上述三个反应也有相似之处,其相似之处是____________________。
化合反应
点燃
放热反应
生成物都是氧化物
氧化物
11.质量守恒定律是化学反应的一条重要规律,运用此规律解答下列问题。
(1)某纯净物X在空气中完全燃烧,反应的化学方程式为X+3O2 2CO2+3H2O,则X的化学式为__________。
(2)在点燃条件下,A与B反应生成C和D,反应前后分子变化的微观示意图如下所示。
①上述四种物质中,属于化合物的是_________(填字母),从微观角度说出你的判断依据为_______________________________________。
②根据上述示意图,你能得到哪些化学变化的信息?(请写出一条)
__________________________________________________________________________________________________。
C2H6O
A、C、D
A、C、D的分子都是由不同原子构成的
化学反应前后原子的种类不变(或元素的种类不变、化学变化中分子分成原子而原子不能再分等其他合理答案)
12.(衡阳中考)如图是某化学反应前后的微观示意图,下列说法不正确的是( )
A.该反应属于分解反应
B.生成的甲、乙分子个数比是1∶4
C.该反应前后原子个数不变
D.该反应的生成物都是单质
B
13.(兰州中考)在某密闭容器中,加入一定质量的甲、乙、丙、丁四种物质,一段时间后,测得各物质的质量如下表。下列说法正确的是( )
A.丙一定是催化剂
B.x的值是5.3
C.参加反应的甲、乙质量比为4∶3
D.丁可能是单质
B
物质 甲 乙 丙 丁
反应前的质量/g 5.2 2.3 2.0 1.3
反应后的质量/g 2.0 1.5 2.0 x
课题1 质量守恒定律
第1课时 质量守恒定律
1.质量守恒定律
内 容:参加_________的各物质的质量______,等于反应后生成的各物质的质量______,这个规律叫做质量守恒定律。
注 意:(1)质量守恒定律强调的是“质量守恒”,而体积和分子个数不一定守恒。
(2)质量守恒定律适用于所有的化学变化,不适用于物理变化。
化学反应
总和
总和
2.质量守恒的原因
化学反应实质:参加反应的各物质(反应物)的______________而生成其他物质(生成物)的过程。
微观解释:在化学反应中,反应前后原子的______没有改变,______没有增减,原子的______也没有改变。
点 拨:质量守恒定律有三个方面的含义:物质的总质量守恒;元素的种类、质量不变;原子的种类、数目、质量不变。
原子重新组合
种类
数目
质量
3.质量守恒定律的应用
应 用:(1)解释化学反应中的“不守恒”现象。如镁条在空气中燃烧后,生成物的质量比原来的镁条质量大,是因为生成物的质量比原来的镁条多了______的质量。
(2)判断物质的组成。如某物质在空气中燃烧后生成了二氧化碳和水,则该物质中一定含有____元素和____元素,可能含有____元素。
(3)求某种反应物或生成物的质量。
(4)推断反应物或生成物的组成(化学式)。
氧气
碳
氢
氧
考点1 质量守恒定律的探究
1.某同学为探究质量守恒定律做了如下三个实验,按要求完成填空。
实验A:白磷燃烧前后质量的测定
实验B:铁钉与硫酸铜溶液反应前后质量的测定
实验C:稀盐酸与碳酸钠粉末反应前后质量的测定
(1)实验A:反应后,天平_______(填“平衡”或“不平衡”)。
(2)实验B:反应后,天平_______(填“平衡”或“不平衡”)。
(3)实验C:反应后,天平__________(填“平衡”或“不平衡”)。
(4)遵循质量守恒定律的实验为__________________________。
(5)可以用来验证质量守恒定律的实验为_________________,不能用来验证质量守恒定律的实验为_________,不能验证质量守恒的原因是______________
_________________________________________。要用该图继续探究质量守恒定律,若药品不变,改变装置的方法是_____________________________。
平衡
不平衡
平衡
实验A、实验B、实验C
实验A、实验B
实验C
反应生成的
二氧化碳气体逸散到空气中,造成天平不平衡
反应在密闭容器中进行
考点2 质量守恒定律的理解
2.下列叙述完全符合质量守恒定律的是( )
A.水结成冰前后,质量保持不变
B.50 mL水和50 mL乙醇混合后总体积小于100 mL
C.在100 g过氧化氢溶液中,含有30 g过氧化氢和70 g 水
D.高锰酸钾受热分解后,剩余固体的质量减小
3.下列对质量守恒定律的理解错误的是( )
A.质量守恒定律只适用于化学反应,不适用于物理变化
B.质量守恒定律研究的内容仅是指“质量”,不能推广到其他物理量
C.催化剂可以改变其他物质的化学反应速率,有催化剂参加的反应也遵守质量守恒定律
D.蜡烛燃烧后质量减轻,不符合质量守恒定律
D
D
考点3 质量守恒定律的微观解释
4.在化学变化中,一定不变的是( )
①物质种类 ②元素种类 ③分子种类 ④原子种类 ⑤分子数目 ⑥原子数目
A.②④⑤⑥ B.①②⑥
C.②④⑥ D.③④⑥
5.(巴中中考)炼铁炉中某反应的微观示意图(不同的球代表不同原子)如图所示,下列说法不正确的是( )
A.该反应属于化合反应
B.反应前后原子数目没有变化
C.反应前后各元素化合价均不变
D.反应前后元素种类不变
C
C
考点4 质量守恒定律的应用
6.(邵阳中考)AgNO3固体见光或受热易分解,故保存在棕色瓶中,AgNO3见光分解时产生一种有刺激性气味的气体,该气体可能是 ( )
A.H2S B.SO2 C.N2 D.NO2
7.(邵阳中考)某化学反应可表示为二氧化碳+水→M+氧气,根据以上信息,下列关于M的组成说法中正确的是( )
A.一定含有C、H元素,可能含有O元素
B.只含有C、H元素
C.含有C、H、O三种元素
D.无法确定
D
A
8.关于质量守恒定律的理解,错误的是( )
A.宏观:实际参加反应的反应物总质量等于生成物总质量
B.微观:反应前后原子种类和个数不变
C.某可燃物燃烧后生成二氧化碳和水,该可燃物中一定含有碳、氢元素
D.煤燃烧后灰渣质量小于煤,不能用质量守恒定律解释
D
9.镁带在耐高温的密闭容器(内含空气)中燃烧,如图所示,能正确表示容器里所盛物质总质量变化的是( )
C
10.如图表示三种物质在密闭容器中反应前后质量比例的变化,下列说法正确的是( )
A.该反应中CO2起催化作用
B.该反应中CO是生成物
C.该反应是分解反应
D.该反应是化合反应
D
11.实验室用a g过氧化氢和b g二氧化锰反应制取氧气,完全分解后剩余在试管内的物质的总质量为c g,则生成氧气的质量为___________g,生成水的质量为________g。
12.柴油机尾气中的主要污染物是氮氧化合物,某种尾气处理技术利用氨气与氮氧化合物发生化学反应,降低污染物排放,反应的微观示意图如下:
(1)一个A分子是由____个原子构成的。
(2)反应物的化学式为_______、_______。
(3)上述反应中,一定发生改变的是______(填字母)。
A.元素种类 B.分子种类
C.原子种类
(a+b-c)
(c-b)
4
NH3
NO
B
13.早在1673年,英国化学家波义耳在一个密闭的容器中煅烧金属汞,然后打开称量,发现反应后固体物质的质量增加了。
(1)波义耳的实验结果是否违反质量守恒定律?简析原因。
______________________________________________________________________________________。
(2)试从原子的角度解释质量守恒定律。
_____________________________________________________________________________。
不违反;金属汞与空气中的氧气反应,生成物的质量应该等于金属汞质量与氧气质量之和
在一切化学反应中,反应前后原子的种类、数目均没有改变,原子的质量也不改变
请写出下列反应的符号表达式:
磷在空气中燃烧:______________________________,
铁与硫酸铜反应:______________________________,
镁在氧气中燃烧:______________________________,
水在通电条件下分解:__________________________,
木炭在空气中燃烧:____________________________,
分解过氧化氢制取氧气:________________________。
第2课时 化学方程式
1.概 念:用________表示化学反应的式子。
2.意义与读法(以C+O2 CO2为例)
质的方面:表示________、_______和反应条件。读作:碳与_______在点燃的条件下反应生成________。
量的方面:(1)宏观:表示反应物、生成物各物质之间的_______。读作:在点燃的条件下,每____份质量的碳和____份质量的氧气完全反应生成____份质量的二氧化碳。
(2)微观:表示反应物、生成物各物质之间的_________比。读作:在点燃的条件下,每1个碳原子与1个氧分子完全反应生成1个二氧化碳分子。
注 意:在化学方程式中,“+”不能读作“加”,应读作“和”或“与”;“===”不能读作“等于”,应读作“生成”。
化学式
反应物
生成物
氧气
二氧化碳
12
32
44
粒子个数
质量
考点1 化学方程式及其意义和读法
1.(荆州中考)根据化学方程式不能获得的信息有( )
A.化学反应发生的条件
B.化学反应的快慢
C.反应物和生成物的质量比
D.化学反应中的反应物和生成物
B
2.(来宾中考)关于2H2+O2 2H2O的读法不正确的是( )
A.氢气与氧气在点燃的条件下生成水
B.每2个氢分子与1个氧分子完全反应,生成2个水分子
C.常温下,每2体积的氢气与l体积的氧气完全反应,生成2体积的水
D.每4份质量的氢气与32份质量的氧气完全反应,生成36份质量的水
C
3.同学们对化学反应方程式:C+O2 CO2有下面四种说法,其中错误的是( )
D
4.写出下列化学方程式中各物质的质量比。
(1)4P+5O2 2P2O5
m(P)∶m(O2)∶m(P2O5)=
__________________________________________________________________。
(2)2KClO3 2KCl+3O2↑
m(KClO3)∶m(KCl)∶m(O2)=
__________________________________________________________________。
(3)2H2O 2H2↑+O2↑
m(H2O)∶m(H2)∶m(O2)=
__________________________________________________________________。
(4)Fe+CuSO4===FeSO4+Cu
m(Fe)∶m(CuSO4)∶m(FeSO4)∶m(Cu)=
__________________________________________________________________。
(4×31)∶(5×16×2)∶[2×(31×2+16×5)]=31∶40∶71
[2×(39+35.5+16×3)]∶[2×(39+35.5)]∶(3×16×2)=245∶149∶96
[2×(1×2+16)]∶(2×1×2)∶(16×2)=9∶1∶8
56∶(64+32+16×4)∶(56+32+16×4)∶64=7∶20∶19∶8
考点2 质量守恒定律在化学方程式中的应用
5.(眉山中考)10 g A和足量B混合加热,充分反应后生成8 g C和4 g D,则参加反应的A和B的质量比为( )
A.1∶1 B.2∶1
C.4∶1 D.5∶1
6.(邵阳中考)某纯净物X在氧气中燃烧的化学方程式为2X+5O2 4CO2+2H2O,则X的化学式是( )
A.C2H4 B.C2H5OH
C.C2H2 D.CH4
D
C
7.如图是用比例模型来表示物质间发生化学反应的微观示意图。图中“ ”
“ ”分别表示两种元素的原子,能用该图示表示的化学反应是( )
A.2CO+O2 2CO2
B.N2+3H2 2NH3
C.C+O2 CO2
D.H2+Cl2 2HCl
A
8.(淄博中考)镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件;②反应速率;③反应物、生成物各物质间的质量关系;④反应的微观过程;⑤反应过程中的能量变化;⑥反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是( )
A.①③④ B.②③⑤
C.①③⑥ D.②④⑥
C
9.不能从以下两个化学方程式中获取的信息是( )
反应①:2H2O2 2H2O+O2↑
反应②:2KMnO4 K2MnO4+MnO2+O2↑
A.反应①和反应②都有气体生成
B.反应①和反应②是在不同条件下进行的
C.反应①和反应②都放出热量
D.反应①和反应②的反应物中都含氧元素
C
10.现有三个化学反应:①S+O2 SO2;②2Mg+O2 2MgO;
③4P+5O2 2P2O5。
(1)比较发现,它们的相似之处:从反应类型上看都是__________;从反应条件上看都是_______;从反应的能量来看都是__________;从物质类别上看生成物都是__________。我也能写出另外一个符合这三点的化学方程式:
____________________。
(2)某同学课外学习Cu2(OH)2CO32CuO+H2O+CO2↑,他发现这个反应和上述三个反应也有相似之处,其相似之处是____________________。
化合反应
点燃
放热反应
生成物都是氧化物
氧化物
11.质量守恒定律是化学反应的一条重要规律,运用此规律解答下列问题。
(1)某纯净物X在空气中完全燃烧,反应的化学方程式为X+3O2 2CO2+3H2O,则X的化学式为__________。
(2)在点燃条件下,A与B反应生成C和D,反应前后分子变化的微观示意图如下所示。
①上述四种物质中,属于化合物的是_________(填字母),从微观角度说出你的判断依据为_______________________________________。
②根据上述示意图,你能得到哪些化学变化的信息?(请写出一条)
__________________________________________________________________________________________________。
C2H6O
A、C、D
A、C、D的分子都是由不同原子构成的
化学反应前后原子的种类不变(或元素的种类不变、化学变化中分子分成原子而原子不能再分等其他合理答案)
12.(衡阳中考)如图是某化学反应前后的微观示意图,下列说法不正确的是( )
A.该反应属于分解反应
B.生成的甲、乙分子个数比是1∶4
C.该反应前后原子个数不变
D.该反应的生成物都是单质
B
13.(兰州中考)在某密闭容器中,加入一定质量的甲、乙、丙、丁四种物质,一段时间后,测得各物质的质量如下表。下列说法正确的是( )
A.丙一定是催化剂
B.x的值是5.3
C.参加反应的甲、乙质量比为4∶3
D.丁可能是单质
B
物质 甲 乙 丙 丁
反应前的质量/g 5.2 2.3 2.0 1.3
反应后的质量/g 2.0 1.5 2.0 x
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
