三年级上册科学课件-12 空气 - 首师大版 (共17张PPT)
文档属性
| 名称 | 三年级上册科学课件-12 空气 - 首师大版 (共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 首师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-10-13 22:30:10 | ||
图片预览





文档简介
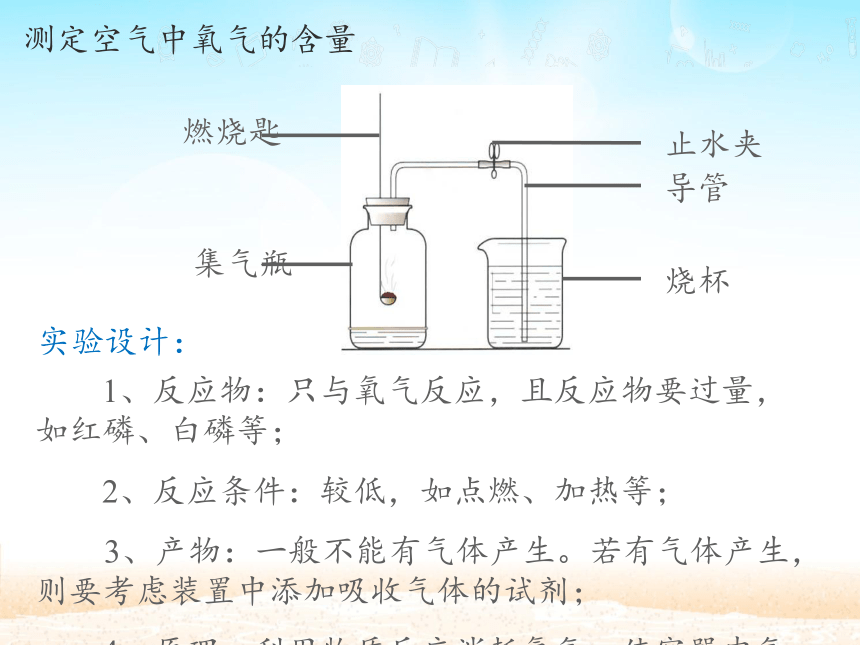
课件17张PPT。空气课程导入 有一种物质你摸不到、看不到、也抓不住,但是我们却时刻离不开它。请问这种物质是什么?拉瓦锡的发现 法国化学家拉瓦锡在实验过程中重视化学反应中物质质量的变化,摆脱了传统错误理论的束缚,尊重事实,得出空气是由氮气和氧气组成。测定空气中氧气的含量 1、反应物:只与氧气反应,且反应物要过量,如红磷、白磷等;
2、反应条件:较低,如点燃、加热等;
3、产物:一般不能有气体产生。若有气体产生,则要考虑装置中添加吸收气体的试剂;
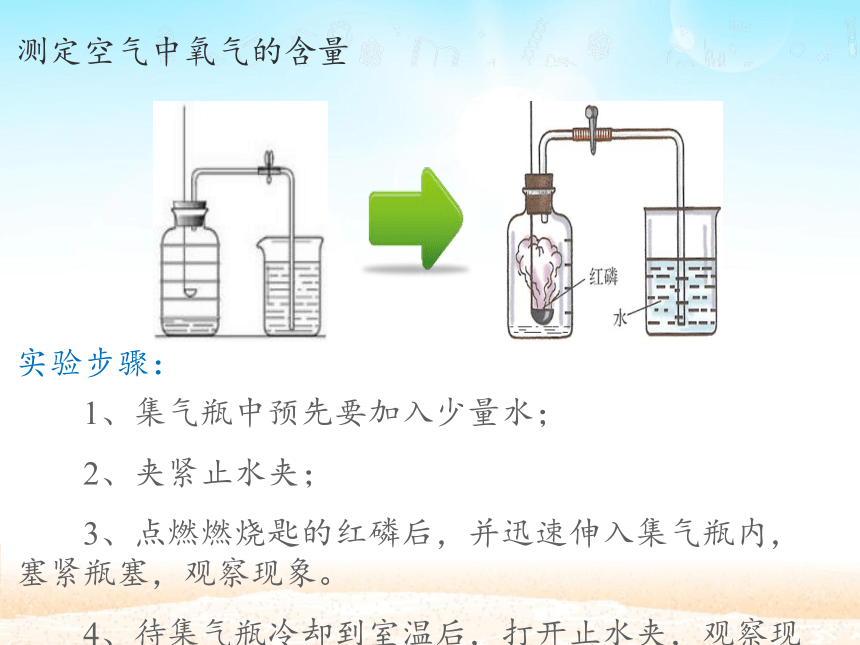
4、原理:利用物质反应消耗氧气,使容器内气体减小。实验设计: 1、集气瓶中预先要加入少量水;
2、夹紧止水夹;
3、点燃燃烧匙的红磷后,并迅速伸入集气瓶内,塞紧瓶塞,观察现象。
4、待集气瓶冷却到室温后,打开止水夹,观察现象。实验步骤:测定空气中氧气的含量化学反应:实验现象:1、红磷燃烧,发光,放热,产生大量白烟;
2、红磷熄灭并冷却后,打开弹簧夹,水经导管进入集气瓶,进入水的体积约占瓶内空气总体积的五分之一。实验结论:氧气约占空气体积的1/5。红磷+氧气 五氧化二磷
P+O2 P2O5测定空气中氧气的含量点燃
→点燃
→ 1、为什么气体减少的体积小于1/5?
(1)装置漏气;(2)红磷的量不足;(3)红磷熄灭后未冷却到室温;
(4)有部分水留在导管中未进入集气瓶;
(5)燃烧一定程度时,瓶内氧气含量小,红磷不能继续燃烧。 2、实验成功的关键:(注意事项) (1)装置不能漏气。(否则看不到水进入或水进入过少) (2)集气瓶中加少量水。(防止高温熔化物使瓶底炸裂) (3)红磷应过量。(尽量多的消耗氧气) (4)点燃红磷后要立即伸入集气瓶中,并塞紧塞子。(防止白烟污染空气) (5)待红磷熄灭并冷却后,打开弹簧夹。(维持压强)测定空气中氧气的含量 3、为什么要在集气瓶里放少量的水? 防止燃着的红磷溅在集气瓶上,将集气瓶炸裂。让P2O5溶于水中。 4、为什么点燃的红磷要立即伸入集气瓶中? 防止白烟污染空气。 5、根据实验现象,分析瓶内剩余气体具有怎样的性质? 能燃烧,也不能支持燃烧;不能溶于水。 6、红磷燃烧后生成的“大量白烟”可以说“大量白雾”吗? 不能,烟是固体微粒;雾是小液滴。测定空气中氧气的含量 7、为什么不用硫和石蜡代替红磷?假如用,需要对实验进行哪些改进?测定空气中氧气的含量空气组成性质 用途决定保护空气酸雨形成的原因主要的污染物可吸入颗粒有害气体二氧化硫(SO2)二氧化氮(NO2)一氧化碳(CO)1、空气中有害物质2、大气污染的危害:酸雨臭氧空洞损害人体健康温室效应影响作物生长保护空气3、保护措施加强大气质量监测使用清洁能源积极植树造林保护空气练习巩固 1、人的生存离不开空气。下图为空气成分示意图,其中R指的是( )
A.氮气
B.氧气
C.稀有气体
D.二氧化碳 B 2、下列用途不属于氮气用途的是( )
A.保鲜蔬菜 B.作保护气
C.作冷冻剂 D.供给呼吸D 3、下列物质属于纯净物的是________,属于混合物的是________。
①二氧化碳;②雨水;③红磷;④酱油;⑤加碘盐;⑥蒸馏水。①③⑥②④⑤谢 谢
2、反应条件:较低,如点燃、加热等;
3、产物:一般不能有气体产生。若有气体产生,则要考虑装置中添加吸收气体的试剂;
4、原理:利用物质反应消耗氧气,使容器内气体减小。实验设计: 1、集气瓶中预先要加入少量水;
2、夹紧止水夹;
3、点燃燃烧匙的红磷后,并迅速伸入集气瓶内,塞紧瓶塞,观察现象。
4、待集气瓶冷却到室温后,打开止水夹,观察现象。实验步骤:测定空气中氧气的含量化学反应:实验现象:1、红磷燃烧,发光,放热,产生大量白烟;
2、红磷熄灭并冷却后,打开弹簧夹,水经导管进入集气瓶,进入水的体积约占瓶内空气总体积的五分之一。实验结论:氧气约占空气体积的1/5。红磷+氧气 五氧化二磷
P+O2 P2O5测定空气中氧气的含量点燃
→点燃
→ 1、为什么气体减少的体积小于1/5?
(1)装置漏气;(2)红磷的量不足;(3)红磷熄灭后未冷却到室温;
(4)有部分水留在导管中未进入集气瓶;
(5)燃烧一定程度时,瓶内氧气含量小,红磷不能继续燃烧。 2、实验成功的关键:(注意事项) (1)装置不能漏气。(否则看不到水进入或水进入过少) (2)集气瓶中加少量水。(防止高温熔化物使瓶底炸裂) (3)红磷应过量。(尽量多的消耗氧气) (4)点燃红磷后要立即伸入集气瓶中,并塞紧塞子。(防止白烟污染空气) (5)待红磷熄灭并冷却后,打开弹簧夹。(维持压强)测定空气中氧气的含量 3、为什么要在集气瓶里放少量的水? 防止燃着的红磷溅在集气瓶上,将集气瓶炸裂。让P2O5溶于水中。 4、为什么点燃的红磷要立即伸入集气瓶中? 防止白烟污染空气。 5、根据实验现象,分析瓶内剩余气体具有怎样的性质? 能燃烧,也不能支持燃烧;不能溶于水。 6、红磷燃烧后生成的“大量白烟”可以说“大量白雾”吗? 不能,烟是固体微粒;雾是小液滴。测定空气中氧气的含量 7、为什么不用硫和石蜡代替红磷?假如用,需要对实验进行哪些改进?测定空气中氧气的含量空气组成性质 用途决定保护空气酸雨形成的原因主要的污染物可吸入颗粒有害气体二氧化硫(SO2)二氧化氮(NO2)一氧化碳(CO)1、空气中有害物质2、大气污染的危害:酸雨臭氧空洞损害人体健康温室效应影响作物生长保护空气3、保护措施加强大气质量监测使用清洁能源积极植树造林保护空气练习巩固 1、人的生存离不开空气。下图为空气成分示意图,其中R指的是( )
A.氮气
B.氧气
C.稀有气体
D.二氧化碳 B 2、下列用途不属于氮气用途的是( )
A.保鲜蔬菜 B.作保护气
C.作冷冻剂 D.供给呼吸D 3、下列物质属于纯净物的是________,属于混合物的是________。
①二氧化碳;②雨水;③红磷;④酱油;⑤加碘盐;⑥蒸馏水。①③⑥②④⑤谢 谢
