人教版九年级化学上《原子的结构》 教学课件 PPT(共34张PPT)
文档属性
| 名称 | 人教版九年级化学上《原子的结构》 教学课件 PPT(共34张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-14 22:03:34 | ||
图片预览






文档简介
课件34张PPT。学习目标1、了解原子是由质子、中子和电子构成的;
2、初步了解相对原子质量的概念,并会查相对原子质量表;
3、了解离子的形成,初步认识离子是构成物质的一种粒子;
4、充分利用教材提供的图、表等资料,借助模型、多媒体等教学手段,化抽象为直观,初步学会运用类比、想像、归纳、概括等方法对获取的信息进行加工;
5、观察l~18号元素的原子结构示意图,归纳小结原子最外层电子数与原子化学性质的关系;
6、通过讨论与交流,启发学生的思维,逐步养成良好的学习习惯和学习方法;
7、激发学生对微观世界的探究欲和学习化学的兴趣;
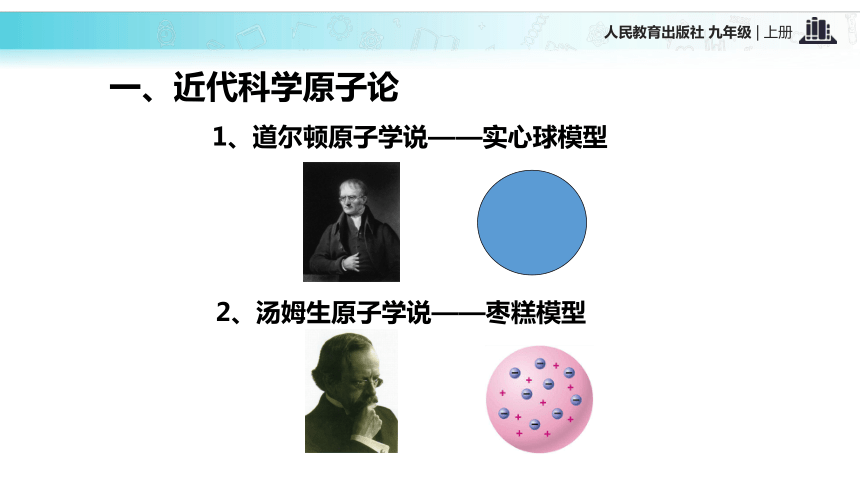
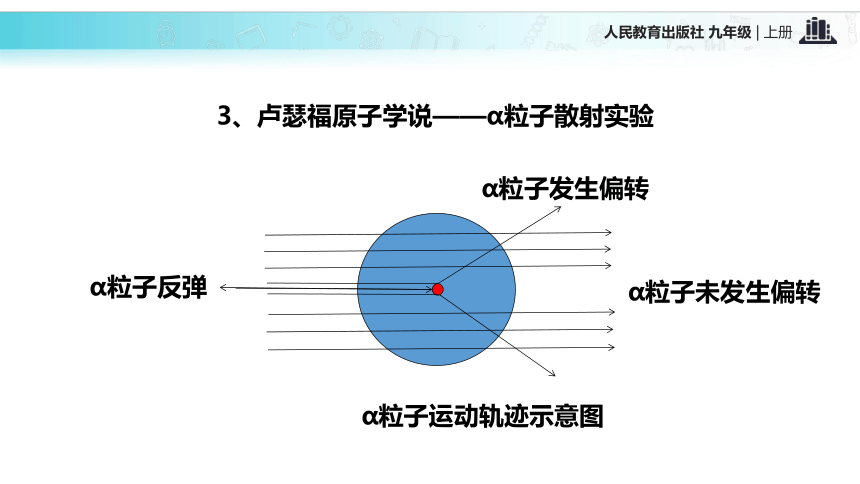
8、对学生进行世界的物质性、物质的可分性的辩证唯物主义观点的教育。一、近代科学原子论1、道尔顿原子学说——实心球模型2、汤姆生原子学说——枣糕模型3、卢瑟福原子学说——α粒子散射实验α粒子发生偏转α粒子运动轨迹示意图α粒子反弹α粒子未发生偏转现象:
①大多数α粒子能穿透金箔而不改变原来的运动方向;
②一小部分α粒子改变了原来的运动方向;
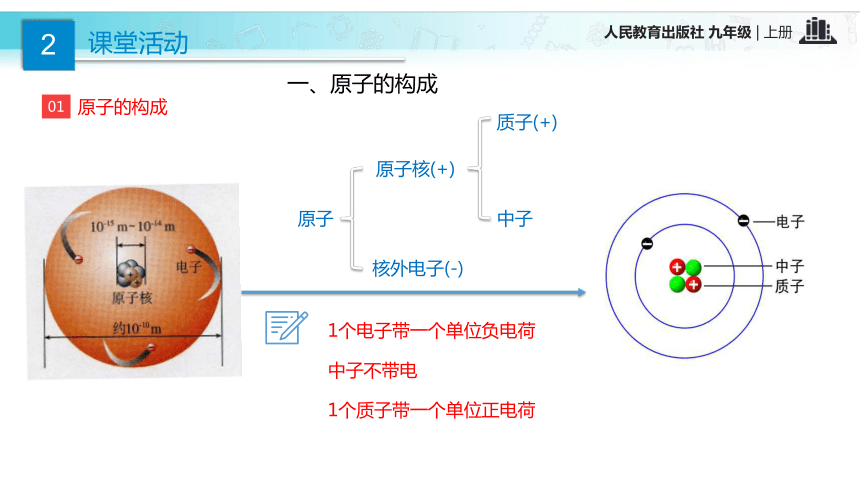
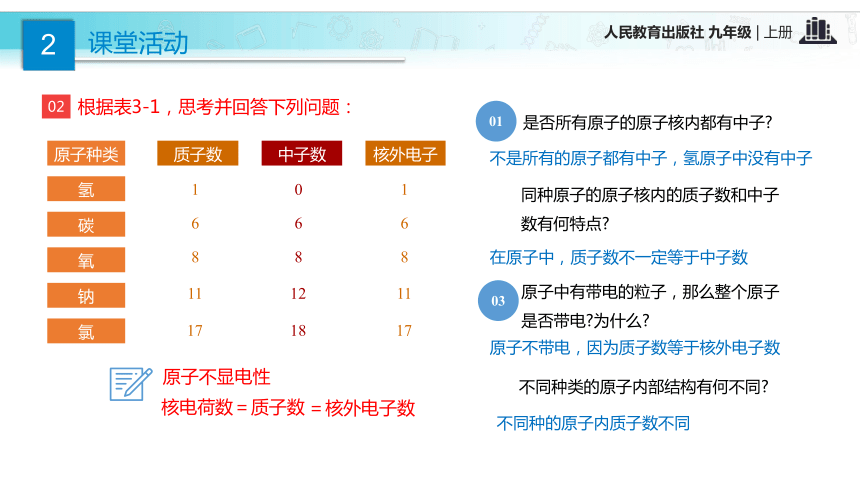
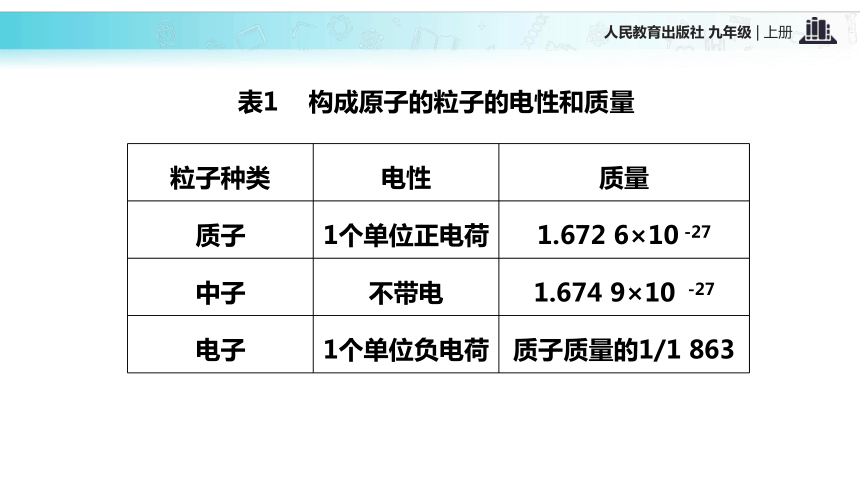
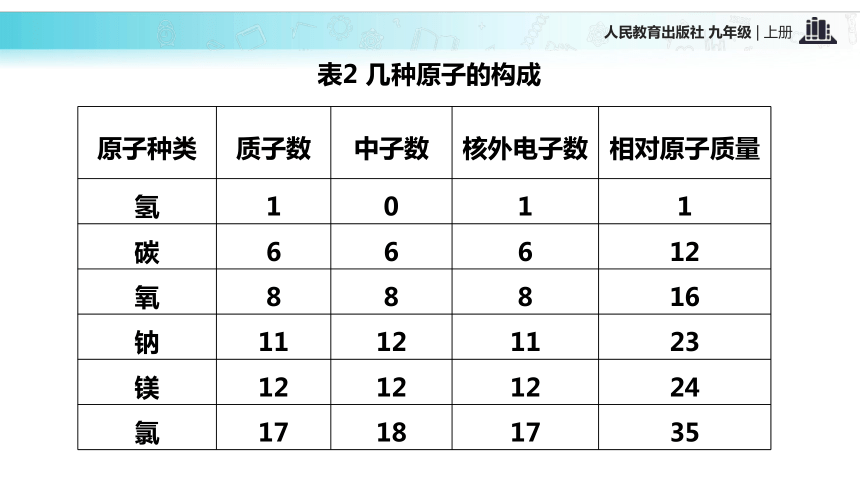
③极少数粒子反弹回来。【结论】 原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。一、原子的构成质子(+)中子原子核外电子(-)原子核(+)02根据表3-1,思考并回答下列问题: 不是所有的原子都有中子,氢原子中没有中子 在原子中,质子数不一定等于中子数不同种的原子内质子数不同原子不带电,因为质子数等于核外电子数表1 构成原子的粒子的电性和质量表2 几种原子的构成【思考】 原子中存在带电的粒子,为什么整个原子不显电性?原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带正电荷(核电荷数)和核外电子所带负电荷电量相等,但电性相反,所以整个原子不显电性。原子结构中的规律:(1)核电荷数=质子数=核外电子数
(2)质子数不一定等于中子数
(3)原子里质子数不同,原子种类也不同
(4)并不是所有的原子都有中子
(5)质子数+中子数=相对原子质量(近似相等)三、相对原子质量国际上以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比,作为这种原子的相对原子质量。相对原子质量(Ar)=该原子的质量1/12 ×碳原子的质量注意:相对原子质量只是一个比,不是原子的实际质量,单位是1通常不写。碳原子碳原子质量的1/12氧原子氧原子的相对原子质量=÷≈16 1、我国著名化学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕、铈、铒、锗、锌、镝等元素的相对原子质量新值,其中他测定出核电荷数为63的铕元素的相对原子质量新值为152,则该元素的原子中质子数为_____________,中子数为____________,核外电子数为____________。6389632.下列关于原子的叙述中,正确的是( )
A.原子由电子和质子构成 B.原子由电子和中子构成
C.原子由质子和中子构成 D.原子由原子核和核外电子构成D3.钠原子中有11个质子、12个中子,则钠原子的核外电子数是( )
A.11 B.12 C.23 D.1A4.相对原子质量是( )
A.原子质量的简称 B.原子质量与一种碳原子质量的1/12的比
C.原子数量的简称 D.原子的实际质量B铁水食盐一、核外电子的分层排布(高速运动) 思考:如何直观、形象地表示电子的分层排布呢?电子层
离核远近
能量高低 二 三 四 五 六 七低 高 近 远电子层(由里到外分别为一、二、三…、七) +142 8 4该电子层上的电子数核电荷数原子核原子结构示意图二、原子核外电子的排布1.在含有多个电子的原子里,电子的能量是否相同?2.是否都在同一区域运动?3.电子能量与运动区域有何关系?①核外电子分层排布离核远近 近 远②核外电子离核越近,能量越低;离核越远。能量越高能量高低 低 高③核外电子最少有 1 层,最多有 7 层。
④核外电子总是先排满能量低的电子层,再进入能量较高的电子层。
⑤第一层电子数不超过 2 个,最外层电子数不超过 8 个,第二层电子数不超过 8个。电子层该层的电子数核内质子数原子核①根据原子序数得出核电荷数(质子数),写在圆圈中,并在数字前标上正号。②从左往右依次用短弧线表示电子层,并标出每层所排电子数。③排满一层后,再排下一层。第一层电子数不超过2个,第二层电子数不超过8个,最外层
电子数不超过8个。8个(He为2个)比较稳定一般少于4个一般多于4个不稳定不稳定结论:原子的最外层电子数决定原子的化学性质。易失电子易得电子既不得电子,也不失电子稳定不稳定不稳定【思考】
1.不同类元素的原子最外层电子数有何特点?它们的结构是否稳定?
2.化学反应过程中元素的原子总是力求使自身的结构趋于或达到稳定结构。金属与非金属元素通过何种方式可趋向达到相对稳定结构?
3.不同类元素的原子最外层电子数与元素化学性质有怎样的关系?1.稀有气体元素的原子最外层电子数为8(氦为2),这种结构被视为稳定结构,所以稀有气体具有“化学惰性”,一般情况下不易和别的物质发生化学反应。
2.金属元素的最外层电子数一般少于4,在化学反应中,易失去电子,形成阳离子。
非金属元素的最外层电子数一般多于4,在化学反应中,易得到电子,形成阴离子。
3.元素的性质,尤其是化学性质主要决定于原子的最外层电子数。二、离子1、离子:带电的原子阴离子:带负电的原子(原子得到电子)阳离子:带正电的原子(原子失去电子)2、离子的分类+11+17+11+172 8 12 8 72 8 12 8 7Na+Cl-NaClNaCle- 3、离子化合物的形成失去1e-得到1e-SO42-4、离子符号的表示(1)离子符号所带电荷数在原子或是原子团的右上角,并且数字在前,正负号在后;
(2)所所带电荷数为“1” ,“1”可以省略不写。Mg2+1.氢原子失去一个电子变成________________,它的符号是________________。
2.比较氢原子和氢离子:【练习】:氢离子H+1
0
0
1
3.化合物MCl2中,M元素原子核内的质子数可能为( )
A.1 B.10 C.11 D.12
4.朝核问题引起了国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )
A.该原子是一种氢原子 B.该元素是金属元素
C.该原子核外有3个电子 D.该原子核带2个单位的正电荷DA练习巩固1、下列关于原子结构的说法,正确的是( )
A.任何原子都是由质子、中子和电子三种粒子构成
B.原子的核电荷数=质子数=中子数=核外电子数
C.原子是由原子核和电子构成的
D.原子对外不显电性是因为原子中不存在带电粒子C2、下列粒子中带正电的是 ,带负电的是 ,不带电的是 ,不显电性的是 。
(1)质子(2)原子(3)中子(4)电子(5)分子(6)原子核(1)、(6)(4)(3)(2)、(5)练习巩固3、铁原子的相对原子质量是( )
A.56克 B.56
C.9.288X10-26 Kg D.1/56B练习巩固
2、初步了解相对原子质量的概念,并会查相对原子质量表;
3、了解离子的形成,初步认识离子是构成物质的一种粒子;
4、充分利用教材提供的图、表等资料,借助模型、多媒体等教学手段,化抽象为直观,初步学会运用类比、想像、归纳、概括等方法对获取的信息进行加工;
5、观察l~18号元素的原子结构示意图,归纳小结原子最外层电子数与原子化学性质的关系;
6、通过讨论与交流,启发学生的思维,逐步养成良好的学习习惯和学习方法;
7、激发学生对微观世界的探究欲和学习化学的兴趣;
8、对学生进行世界的物质性、物质的可分性的辩证唯物主义观点的教育。一、近代科学原子论1、道尔顿原子学说——实心球模型2、汤姆生原子学说——枣糕模型3、卢瑟福原子学说——α粒子散射实验α粒子发生偏转α粒子运动轨迹示意图α粒子反弹α粒子未发生偏转现象:
①大多数α粒子能穿透金箔而不改变原来的运动方向;
②一小部分α粒子改变了原来的运动方向;
③极少数粒子反弹回来。【结论】 原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。一、原子的构成质子(+)中子原子核外电子(-)原子核(+)02根据表3-1,思考并回答下列问题: 不是所有的原子都有中子,氢原子中没有中子 在原子中,质子数不一定等于中子数不同种的原子内质子数不同原子不带电,因为质子数等于核外电子数表1 构成原子的粒子的电性和质量表2 几种原子的构成【思考】 原子中存在带电的粒子,为什么整个原子不显电性?原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带正电荷(核电荷数)和核外电子所带负电荷电量相等,但电性相反,所以整个原子不显电性。原子结构中的规律:(1)核电荷数=质子数=核外电子数
(2)质子数不一定等于中子数
(3)原子里质子数不同,原子种类也不同
(4)并不是所有的原子都有中子
(5)质子数+中子数=相对原子质量(近似相等)三、相对原子质量国际上以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比,作为这种原子的相对原子质量。相对原子质量(Ar)=该原子的质量1/12 ×碳原子的质量注意:相对原子质量只是一个比,不是原子的实际质量,单位是1通常不写。碳原子碳原子质量的1/12氧原子氧原子的相对原子质量=÷≈16 1、我国著名化学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕、铈、铒、锗、锌、镝等元素的相对原子质量新值,其中他测定出核电荷数为63的铕元素的相对原子质量新值为152,则该元素的原子中质子数为_____________,中子数为____________,核外电子数为____________。6389632.下列关于原子的叙述中,正确的是( )
A.原子由电子和质子构成 B.原子由电子和中子构成
C.原子由质子和中子构成 D.原子由原子核和核外电子构成D3.钠原子中有11个质子、12个中子,则钠原子的核外电子数是( )
A.11 B.12 C.23 D.1A4.相对原子质量是( )
A.原子质量的简称 B.原子质量与一种碳原子质量的1/12的比
C.原子数量的简称 D.原子的实际质量B铁水食盐一、核外电子的分层排布(高速运动) 思考:如何直观、形象地表示电子的分层排布呢?电子层
离核远近
能量高低 二 三 四 五 六 七低 高 近 远电子层(由里到外分别为一、二、三…、七) +142 8 4该电子层上的电子数核电荷数原子核原子结构示意图二、原子核外电子的排布1.在含有多个电子的原子里,电子的能量是否相同?2.是否都在同一区域运动?3.电子能量与运动区域有何关系?①核外电子分层排布离核远近 近 远②核外电子离核越近,能量越低;离核越远。能量越高能量高低 低 高③核外电子最少有 1 层,最多有 7 层。
④核外电子总是先排满能量低的电子层,再进入能量较高的电子层。
⑤第一层电子数不超过 2 个,最外层电子数不超过 8 个,第二层电子数不超过 8个。电子层该层的电子数核内质子数原子核①根据原子序数得出核电荷数(质子数),写在圆圈中,并在数字前标上正号。②从左往右依次用短弧线表示电子层,并标出每层所排电子数。③排满一层后,再排下一层。第一层电子数不超过2个,第二层电子数不超过8个,最外层
电子数不超过8个。8个(He为2个)比较稳定一般少于4个一般多于4个不稳定不稳定结论:原子的最外层电子数决定原子的化学性质。易失电子易得电子既不得电子,也不失电子稳定不稳定不稳定【思考】
1.不同类元素的原子最外层电子数有何特点?它们的结构是否稳定?
2.化学反应过程中元素的原子总是力求使自身的结构趋于或达到稳定结构。金属与非金属元素通过何种方式可趋向达到相对稳定结构?
3.不同类元素的原子最外层电子数与元素化学性质有怎样的关系?1.稀有气体元素的原子最外层电子数为8(氦为2),这种结构被视为稳定结构,所以稀有气体具有“化学惰性”,一般情况下不易和别的物质发生化学反应。
2.金属元素的最外层电子数一般少于4,在化学反应中,易失去电子,形成阳离子。
非金属元素的最外层电子数一般多于4,在化学反应中,易得到电子,形成阴离子。
3.元素的性质,尤其是化学性质主要决定于原子的最外层电子数。二、离子1、离子:带电的原子阴离子:带负电的原子(原子得到电子)阳离子:带正电的原子(原子失去电子)2、离子的分类+11+17+11+172 8 12 8 72 8 12 8 7Na+Cl-NaClNaCle- 3、离子化合物的形成失去1e-得到1e-SO42-4、离子符号的表示(1)离子符号所带电荷数在原子或是原子团的右上角,并且数字在前,正负号在后;
(2)所所带电荷数为“1” ,“1”可以省略不写。Mg2+1.氢原子失去一个电子变成________________,它的符号是________________。
2.比较氢原子和氢离子:【练习】:氢离子H+1
0
0
1
3.化合物MCl2中,M元素原子核内的质子数可能为( )
A.1 B.10 C.11 D.12
4.朝核问题引起了国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )
A.该原子是一种氢原子 B.该元素是金属元素
C.该原子核外有3个电子 D.该原子核带2个单位的正电荷DA练习巩固1、下列关于原子结构的说法,正确的是( )
A.任何原子都是由质子、中子和电子三种粒子构成
B.原子的核电荷数=质子数=中子数=核外电子数
C.原子是由原子核和电子构成的
D.原子对外不显电性是因为原子中不存在带电粒子C2、下列粒子中带正电的是 ,带负电的是 ,不带电的是 ,不显电性的是 。
(1)质子(2)原子(3)中子(4)电子(5)分子(6)原子核(1)、(6)(4)(3)(2)、(5)练习巩固3、铁原子的相对原子质量是( )
A.56克 B.56
C.9.288X10-26 Kg D.1/56B练习巩固
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
