人教版九年级化学第十一单元-课题1常见的几种盐(共46张PPT)
文档属性
| 名称 | 人教版九年级化学第十一单元-课题1常见的几种盐(共46张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-18 00:00:00 | ||
图片预览










文档简介
(共46张PPT)
第十一单元 盐 化肥
课题1 生活中常见的盐
生活中说的盐指的是什么?食盐是盐,是正确的,因为食盐是由 Na+和Cl- 构成的化合物;盐就是食盐,这种说法是错误的,因为盐是指组成里含有金属离子和酸根离子的一类化合物,不仅仅指食盐,而且有些盐是有毒的,如工业用盐亚硝酸钠(NaNO2)。
盐是指组成里含有金属离子(或铵根离子)和酸根离子的一类化合物。
(有些化合物中不含金属离子,而是由铵根离子和酸根离子组成的化合物,也属于盐类,如NH4Cl)。
2、生活中常见的盐有碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、高锰酸钾(KMnO4)和大理石(主要成分为CaCO3)等。
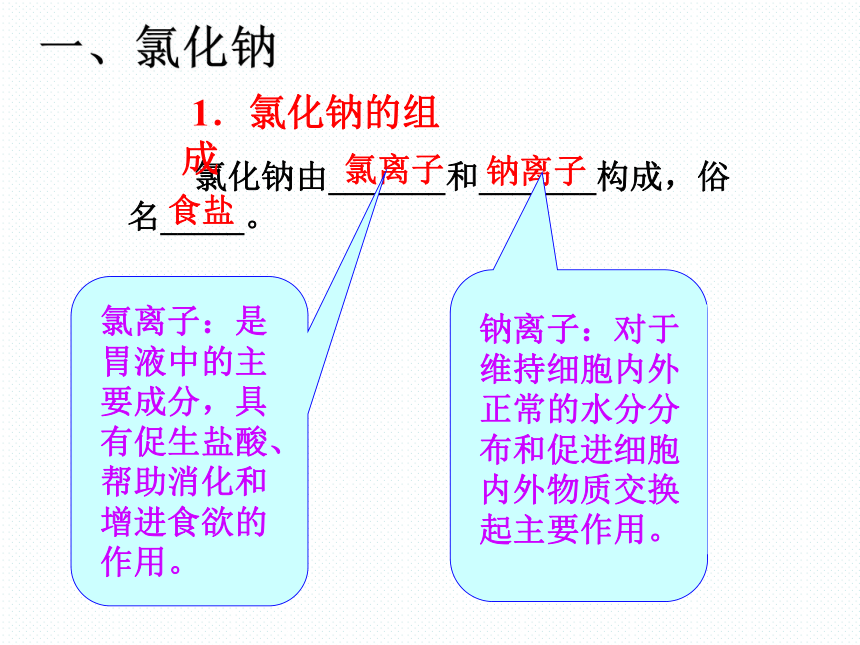
氯化钠由_______和_______构成,俗名_____。
氯离子
钠离子
食盐
钠离子:对于维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用。
氯离子:是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
1.氯化钠的组成
一、氯化钠
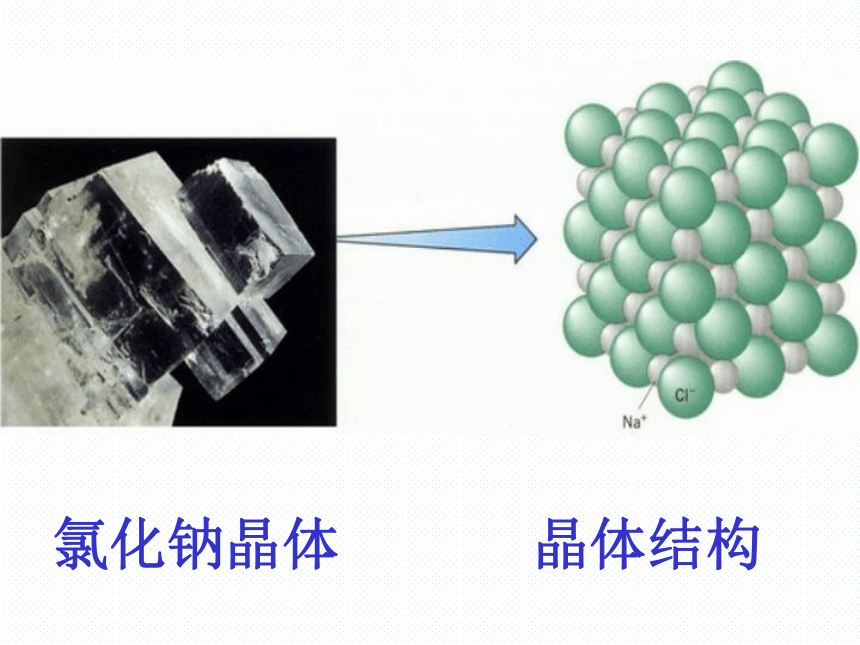
氯化钠晶体
晶体结构
食盐
2.氯化钠的用途
医疗 生理盐水是0.9%的氯化钠溶液;
工业 制取纯碱、烧碱、盐酸等;
农业 氯化钠可以用来选种;
生活 调味品、腌制蔬菜、鱼、肉、蛋等;
交通 公路上的积雪用氯化钠来消除。
融雪机洒盐融雪
有关食品与药品
食盐的实用价值
(1)清晨喝一杯盐开水,可以治大便不通。喝盐开水可以治喉咙痛牙痛。 (2)误食有毒物,喝一些盐开水,有解毒作用。 (3)豆腐易变质,如将食盐化在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月。 (4)鲜花插入稀盐水里,可数日不谢。 (5)新买的玻璃器皿,用盐煮一煮,不易破裂。 (6)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后再洗,则不易掉色。 (7)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑。 (8)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。 (9)铜器生锈或出现黑点,用盐可以擦掉。
海盐
岩盐
3.氯化钠的分布
湖盐
井盐
我国食盐产地
我国食盐的产地分布很广,出产着种类繁多的盐:海盐、井盐、矿盐、池盐等。其中辽宁、山东、两淮、长芦各盐场盛产海盐,自古闻名。井盐则以四川自贡市的自流井最为有名,矿盐产于四川、云南、等地。在青海、新疆、内蒙古等地有很多咸水湖,盛产池盐,其中最大的是柴达木盆地的察尔汗盐池,据统计,仅这一盐池开采出来的池盐,足够我国十二亿人口食用四千多年。
世界上最大的盐矿储地是柴达木盆地
晒盐的原理是什么?相当于化学上的什么操作?
海南省东方盐场晒盐一景
溶解: [称量(左物右码)]
过滤:过滤的要点(一贴二低三靠)
蒸发:(什么时候熄灭酒精灯?)
计算产率:[称量]
4、粗盐提纯的步骤:
氯化钠的提纯
氯化钠的溶解度受温度变化影响_____, 所以一般采用________方法得到晶体,粗盐经_____、_____、_____可制得精盐。粗盐因含有______、______等杂质易发生潮解。潮解一般属于_____变化。
不大
蒸发溶剂
溶解
过滤
蒸发
氯化镁
氯化钙
物理
精讲点拨:
5、玻璃棒的作用:
溶解:搅拌,加速固体的溶解
过滤:引流
蒸发:防止液体受热不均匀,液滴飞溅
第四次:转移固体
纯碱
苏打
小苏打
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
二、化学盐
名 称 俗 称
(或主要
成分) 主 要 用 途
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
碳酸钙
CaCO3
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
【练习】请写出上述有关化学方程式。
Na2CO3 + 2 HCl== 2NaCl +H2O +CO2
NaHCO3 + HCl== NaCl +H2O +CO2
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
碳酸盐(即CO32- 、HCO3-)的检验方法
你想到了吗?
实验操作 实验现象 实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水。 有无色气体生成,澄清石灰水变浑浊。 该样品是碳酸盐。
试管中出现白色浑浊
【设问】碳酸钠能否与碱反应?
Na2CO3 + Ca(OH)2 == CaCO3 +2 NaOH
复分解反应:
由两种化合物互相交换成分,生成另外两种化合物的反应
AB+CD → AD+CB
双交换、价不变
方法 向盛有少量碳酸钠溶液的试管中滴入澄清的石灰水,观察现象
现 象
分 析 Na2CO3与 Ca(OH)2 反应生成不溶物
BaCl2 + Na2SO4 == BaSO4↓+ 2NaCl
Cl-
Na+
Na+
Ba2+
Cl-
BaSO4
SO42-
Na+
Na+
Cl-
Cl-
SO42-
Ba2+
讨论:如何从微观上解释反应的含义?
复分解反应的实质
复分解反应的实质:
1、可溶性的酸碱盐在溶液中以自由移动的离子形式存在。
2、自由移动的离子间相互结合成沉淀、气体或者水时,某些离子的种类、数量发生了变化,复分解反应就发生了。
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
生成沉淀:溶液中反应的离子变化
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4+Na2CO3——
Na2SO4+ + H2O
——
√
生成气体:溶液中反应的离子变化
Ca2+、OH-
H+、SO4 2 -
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ H2SO4——
CaSO4+2H2O
——
√
生成水:溶液中反应的离子变化
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O NaHCO3+HCl=NaCl+ CO2 ↑ +H2O Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH
复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应。
复分解反应的条件:
反应物:无酸参加,必须可溶;
生成物:必须有沉淀、气体、水三者之一。
复分解反应的实质:两种物质在溶液中交换离子的过程
2、复分解反应的条件
首先:反应物之间要能互溶
其次:生成物中有气体、沉淀或水
(1)、无酸参加必须都溶于水。
(2)、有酸参加可不溶水,但要溶于酸
碱盐盐盐溶于水,沉淀气体水生成
盐的化学性质总结
1、金属+盐→
新盐+新金属
位于前面
位于后面
盐溶液
无
可溶性
好好记住我哟!
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
盐的化学性质总结
2、盐与酸反应:盐+酸→新盐+新酸
Na2CO3+Ca(OH)2= CaCO3↓ + 2NaOH
3、盐与碱反应:盐(可溶)+碱(可溶)→新盐+新碱
4、盐+盐→新盐+新盐
BaCl2+Na2SO4=BaSO4↓+2NaCl
AgNO3+NaCl=AgCl↓ +NaNO3
复分解反应类型
1、酸+ 金属氧化物→盐 + 水
2、酸 + 碱 → 盐 + 水
Fe2O3 + 6HCl =2FeCl3+ 3H2O
NaOH + HCl = NaCl +H2O
3、盐+酸→新盐+新酸
CaCO3+2HCl=CaCl2+ CO2 ↑ + H2O
4、盐+碱→新盐+新碱
5、盐+盐→新盐+新盐
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
物质溶解性口诀:
1、酸都溶:
2、可溶碱有:钾、 钠、钡、 钙、 铵。
KOH NaOH Ba(OH)2 Ca(OH)2 NH3.H2O
3、钾盐、 钠盐、 铵盐、 硝酸盐都可溶。
K_ Na_ NH4_ _NO3
4、盐酸盐(— Cl)只有氯化银AgCl不可溶。、
5、硫酸盐(—SO4)只有硫酸钡BaSO4不可溶。
6、碳酸盐(—CO3)只溶钾、钠、铵,剩下都不溶
这些你都记住了吗?
判断复分解反应能否发生常涉及的沉淀有:
BaSO4(白色沉淀)
Cu(OH)2(蓝色沉淀)
1.判断复分解反应能否发生。
2.判断离子能否共存。
应 用
Mg(OH)2
BaCO3
CaCO3
AgCl(白色沉淀)
(白色沉淀)
(白色沉淀)
(白色沉淀)
Fe(OH)3(红褐色沉淀)
CuCO3(蓝色沉淀)
{
不溶酸
{
有色沉淀
碱
非金属
非金属氧化物
酸
盐
盐
金属
1、离子共存:即互相不发生反应
常见不能共存的离子:
与H+不能共存的离子:
OH-:
CO32-:
Cl-:
SO42-:
OH-、CO32-、HCO3-
H+、NH4+及结合形成不溶性碱的金属离子Cu2+、Fe3+、Mg2+、Al3+
H+及结合形成不溶性碳酸盐的金属离子Ba2+、Ca2+
Ag+
Ba2+
补充、离子共存、物质共存问题
几种常见离子的检验
1.碳酸根离子的检验
①滴加稀盐酸,现象:
有气泡产生
②通入澄清石灰水,现象:
生成白色浑浊
2.硫酸根离子的检验
①滴加硝酸钡,现象:
生成白色沉淀
②滴加稀硝酸,现象:
沉淀不溶解
4.铵根离子的检验
①滴加氢氧化钠溶液,现象:
有气泡产生
②用红色石蕊试纸检验,现象:
试纸变蓝
3.氯离子的检验
①滴加硝酸银,现象:
生成白色沉淀
②滴加稀硝酸,现象:
沉淀不溶解
或用沾有无色酚酞的棉花检验
能在水中大量共存的一组离子是( )
下列各组离子在水中一定能大量共存,并形成无色透明溶液的是( )
A、NH4+、Na+、C1-、SO42- B、H+、Na+、NO3-、CO32-
C、K+、Ba2+、OH-、SO42- D、K+、Ag+、NO3-、Cl-
A、Fe2+、OH-、SO42- B、H+、Na+、HCO3-
C、NH4+、H+、NO3- D、K+、H+、MnO4-
下列离子组能在PH=1的无色溶液中大量共存的是( )
下列离子能在PH=12的水溶液中大量共存的是
A、NO3-,K+,Na+,OH- B、K+,SO42-,Na+,NO3-
C、Cl-,K+,SO42-,Ba2+ D、Ca2+,Cl-,Fe3+,Na+
A、SO42-、NO3-、K+、H+ B、Na+、Cl-、NO3-、Al3+
C、Cl-、NO3-、K+、Na+ D、Ag+、Cl-、CO32-、K+
基本反应类型比较:
化 合 反 应
分 解 反 应 置 换 反 应 复 分 解 反 应
定
义 由两种或两种以上物质生成另一种物质的反应 由一种物质生成两种或两种以上其它物质的反应 由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应 由两种化合物互相交换成分生成另外两种化合物的反应
类
型 A+B→AB AB→A+B+ …… AB + C→A +BC AB + CD→ AD+ BC
特
征 反应物为多种而生成物只有一种,
即“多变一” 反应物只有一种而生成物有多种,
即“一变多” 反应物与生成物都是两种,且都是单质和化合物 反应物和生成物都为化合物
五、石灰石和石灰岩地区的溶洞
奇妙的石笋和钟乳石
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
溶洞的形成
1、判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
NaOH + HCl——
KNO3 + NaOH——
不能
BaSO4↓+ 2NaCl
NaCl+H2O
不能
2、下列各组离子能共存的是( )
A、 Ba2+、K+、NO3-、CO32-、H+
B、K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+
D、Ag+、Ba2+、Cl-、NO3-、K+
B
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl
判断复分解反应能否发生常涉及的沉淀有:
BaSO4(白色沉淀)
Cu(OH)2(蓝色沉淀)
1.判断复分解反应能否发生。
2.判断离子能否共存。
应 用
Mg(OH)2
BaCO3
CaCO3
AgCl(白色沉淀)
(白色沉淀)
(白色沉淀)
(白色沉淀)
Fe(OH)3(红褐色沉淀)
CuCO3(蓝色沉淀)
{
不溶酸
{
有色沉淀
第十一单元 盐 化肥
课题1 生活中常见的盐
生活中说的盐指的是什么?食盐是盐,是正确的,因为食盐是由 Na+和Cl- 构成的化合物;盐就是食盐,这种说法是错误的,因为盐是指组成里含有金属离子和酸根离子的一类化合物,不仅仅指食盐,而且有些盐是有毒的,如工业用盐亚硝酸钠(NaNO2)。
盐是指组成里含有金属离子(或铵根离子)和酸根离子的一类化合物。
(有些化合物中不含金属离子,而是由铵根离子和酸根离子组成的化合物,也属于盐类,如NH4Cl)。
2、生活中常见的盐有碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、高锰酸钾(KMnO4)和大理石(主要成分为CaCO3)等。
氯化钠由_______和_______构成,俗名_____。
氯离子
钠离子
食盐
钠离子:对于维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用。
氯离子:是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。
1.氯化钠的组成
一、氯化钠
氯化钠晶体
晶体结构
食盐
2.氯化钠的用途
医疗 生理盐水是0.9%的氯化钠溶液;
工业 制取纯碱、烧碱、盐酸等;
农业 氯化钠可以用来选种;
生活 调味品、腌制蔬菜、鱼、肉、蛋等;
交通 公路上的积雪用氯化钠来消除。
融雪机洒盐融雪
有关食品与药品
食盐的实用价值
(1)清晨喝一杯盐开水,可以治大便不通。喝盐开水可以治喉咙痛牙痛。 (2)误食有毒物,喝一些盐开水,有解毒作用。 (3)豆腐易变质,如将食盐化在开水中,冷却后将豆腐浸入,即使在夏天,也可保存数月。 (4)鲜花插入稀盐水里,可数日不谢。 (5)新买的玻璃器皿,用盐煮一煮,不易破裂。 (6)洗有颜色的衣服,先用5%盐水浸泡10分钟,然后再洗,则不易掉色。 (7)洗有汗渍的白衣服,先在5%的盐水中揉一揉,再用肥皂洗净,就不会出现黄色汗斑。 (8)将胡萝卜砸碎拌上盐,可擦去衣服上的血迹。 (9)铜器生锈或出现黑点,用盐可以擦掉。
海盐
岩盐
3.氯化钠的分布
湖盐
井盐
我国食盐产地
我国食盐的产地分布很广,出产着种类繁多的盐:海盐、井盐、矿盐、池盐等。其中辽宁、山东、两淮、长芦各盐场盛产海盐,自古闻名。井盐则以四川自贡市的自流井最为有名,矿盐产于四川、云南、等地。在青海、新疆、内蒙古等地有很多咸水湖,盛产池盐,其中最大的是柴达木盆地的察尔汗盐池,据统计,仅这一盐池开采出来的池盐,足够我国十二亿人口食用四千多年。
世界上最大的盐矿储地是柴达木盆地
晒盐的原理是什么?相当于化学上的什么操作?
海南省东方盐场晒盐一景
溶解: [称量(左物右码)]
过滤:过滤的要点(一贴二低三靠)
蒸发:(什么时候熄灭酒精灯?)
计算产率:[称量]
4、粗盐提纯的步骤:
氯化钠的提纯
氯化钠的溶解度受温度变化影响_____, 所以一般采用________方法得到晶体,粗盐经_____、_____、_____可制得精盐。粗盐因含有______、______等杂质易发生潮解。潮解一般属于_____变化。
不大
蒸发溶剂
溶解
过滤
蒸发
氯化镁
氯化钙
物理
精讲点拨:
5、玻璃棒的作用:
溶解:搅拌,加速固体的溶解
过滤:引流
蒸发:防止液体受热不均匀,液滴飞溅
第四次:转移固体
纯碱
苏打
小苏打
大理石
石灰石
用于生产玻璃、造纸、纺织、洗涤剂
发酵粉的主要成分之一,
治疗胃酸过多症的药剂
可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料
二、化学盐
名 称 俗 称
(或主要
成分) 主 要 用 途
碳酸钠
Na2CO3
碳酸氢钠
NaHCO3
碳酸钙
CaCO3
白色固体溶解,放出使澄清石灰水变浑浊的无色气体
碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体
【练习】请写出上述有关化学方程式。
Na2CO3 + 2 HCl== 2NaCl +H2O +CO2
NaHCO3 + HCl== NaCl +H2O +CO2
碳酸钠+ 盐酸 碳酸氢钠+盐酸
现 象
分 析
碳酸盐(即CO32- 、HCO3-)的检验方法
你想到了吗?
实验操作 实验现象 实验结论
向少量样品中加入稀盐酸,将产生的气体通入澄清石灰水。 有无色气体生成,澄清石灰水变浑浊。 该样品是碳酸盐。
试管中出现白色浑浊
【设问】碳酸钠能否与碱反应?
Na2CO3 + Ca(OH)2 == CaCO3 +2 NaOH
复分解反应:
由两种化合物互相交换成分,生成另外两种化合物的反应
AB+CD → AD+CB
双交换、价不变
方法 向盛有少量碳酸钠溶液的试管中滴入澄清的石灰水,观察现象
现 象
分 析 Na2CO3与 Ca(OH)2 反应生成不溶物
BaCl2 + Na2SO4 == BaSO4↓+ 2NaCl
Cl-
Na+
Na+
Ba2+
Cl-
BaSO4
SO42-
Na+
Na+
Cl-
Cl-
SO42-
Ba2+
讨论:如何从微观上解释反应的含义?
复分解反应的实质
复分解反应的实质:
1、可溶性的酸碱盐在溶液中以自由移动的离子形式存在。
2、自由移动的离子间相互结合成沉淀、气体或者水时,某些离子的种类、数量发生了变化,复分解反应就发生了。
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
生成沉淀:溶液中反应的离子变化
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
溶液中离子种类发生改变
H2SO4+Na2CO3——
Na2SO4+ + H2O
——
√
生成气体:溶液中反应的离子变化
Ca2+、OH-
H+、SO4 2 -
Ca2+、SO42-
反应前
反应后
溶液中离子种类发生改变
Ca(OH)2+ H2SO4——
CaSO4+2H2O
——
√
生成水:溶液中反应的离子变化
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O NaHCO3+HCl=NaCl+ CO2 ↑ +H2O Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH
复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应。
复分解反应的条件:
反应物:无酸参加,必须可溶;
生成物:必须有沉淀、气体、水三者之一。
复分解反应的实质:两种物质在溶液中交换离子的过程
2、复分解反应的条件
首先:反应物之间要能互溶
其次:生成物中有气体、沉淀或水
(1)、无酸参加必须都溶于水。
(2)、有酸参加可不溶水,但要溶于酸
碱盐盐盐溶于水,沉淀气体水生成
盐的化学性质总结
1、金属+盐→
新盐+新金属
位于前面
位于后面
盐溶液
无
可溶性
好好记住我哟!
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
Na2CO3+2HCl=2NaCl+ CO2 ↑ +H2O
NaHCO3+HCl=NaCl+ CO2 ↑ +H2O
盐的化学性质总结
2、盐与酸反应:盐+酸→新盐+新酸
Na2CO3+Ca(OH)2= CaCO3↓ + 2NaOH
3、盐与碱反应:盐(可溶)+碱(可溶)→新盐+新碱
4、盐+盐→新盐+新盐
BaCl2+Na2SO4=BaSO4↓+2NaCl
AgNO3+NaCl=AgCl↓ +NaNO3
复分解反应类型
1、酸+ 金属氧化物→盐 + 水
2、酸 + 碱 → 盐 + 水
Fe2O3 + 6HCl =2FeCl3+ 3H2O
NaOH + HCl = NaCl +H2O
3、盐+酸→新盐+新酸
CaCO3+2HCl=CaCl2+ CO2 ↑ + H2O
4、盐+碱→新盐+新碱
5、盐+盐→新盐+新盐
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
物质溶解性口诀:
1、酸都溶:
2、可溶碱有:钾、 钠、钡、 钙、 铵。
KOH NaOH Ba(OH)2 Ca(OH)2 NH3.H2O
3、钾盐、 钠盐、 铵盐、 硝酸盐都可溶。
K_ Na_ NH4_ _NO3
4、盐酸盐(— Cl)只有氯化银AgCl不可溶。、
5、硫酸盐(—SO4)只有硫酸钡BaSO4不可溶。
6、碳酸盐(—CO3)只溶钾、钠、铵,剩下都不溶
这些你都记住了吗?
判断复分解反应能否发生常涉及的沉淀有:
BaSO4(白色沉淀)
Cu(OH)2(蓝色沉淀)
1.判断复分解反应能否发生。
2.判断离子能否共存。
应 用
Mg(OH)2
BaCO3
CaCO3
AgCl(白色沉淀)
(白色沉淀)
(白色沉淀)
(白色沉淀)
Fe(OH)3(红褐色沉淀)
CuCO3(蓝色沉淀)
{
不溶酸
{
有色沉淀
碱
非金属
非金属氧化物
酸
盐
盐
金属
1、离子共存:即互相不发生反应
常见不能共存的离子:
与H+不能共存的离子:
OH-:
CO32-:
Cl-:
SO42-:
OH-、CO32-、HCO3-
H+、NH4+及结合形成不溶性碱的金属离子Cu2+、Fe3+、Mg2+、Al3+
H+及结合形成不溶性碳酸盐的金属离子Ba2+、Ca2+
Ag+
Ba2+
补充、离子共存、物质共存问题
几种常见离子的检验
1.碳酸根离子的检验
①滴加稀盐酸,现象:
有气泡产生
②通入澄清石灰水,现象:
生成白色浑浊
2.硫酸根离子的检验
①滴加硝酸钡,现象:
生成白色沉淀
②滴加稀硝酸,现象:
沉淀不溶解
4.铵根离子的检验
①滴加氢氧化钠溶液,现象:
有气泡产生
②用红色石蕊试纸检验,现象:
试纸变蓝
3.氯离子的检验
①滴加硝酸银,现象:
生成白色沉淀
②滴加稀硝酸,现象:
沉淀不溶解
或用沾有无色酚酞的棉花检验
能在水中大量共存的一组离子是( )
下列各组离子在水中一定能大量共存,并形成无色透明溶液的是( )
A、NH4+、Na+、C1-、SO42- B、H+、Na+、NO3-、CO32-
C、K+、Ba2+、OH-、SO42- D、K+、Ag+、NO3-、Cl-
A、Fe2+、OH-、SO42- B、H+、Na+、HCO3-
C、NH4+、H+、NO3- D、K+、H+、MnO4-
下列离子组能在PH=1的无色溶液中大量共存的是( )
下列离子能在PH=12的水溶液中大量共存的是
A、NO3-,K+,Na+,OH- B、K+,SO42-,Na+,NO3-
C、Cl-,K+,SO42-,Ba2+ D、Ca2+,Cl-,Fe3+,Na+
A、SO42-、NO3-、K+、H+ B、Na+、Cl-、NO3-、Al3+
C、Cl-、NO3-、K+、Na+ D、Ag+、Cl-、CO32-、K+
基本反应类型比较:
化 合 反 应
分 解 反 应 置 换 反 应 复 分 解 反 应
定
义 由两种或两种以上物质生成另一种物质的反应 由一种物质生成两种或两种以上其它物质的反应 由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应 由两种化合物互相交换成分生成另外两种化合物的反应
类
型 A+B→AB AB→A+B+ …… AB + C→A +BC AB + CD→ AD+ BC
特
征 反应物为多种而生成物只有一种,
即“多变一” 反应物只有一种而生成物有多种,
即“一变多” 反应物与生成物都是两种,且都是单质和化合物 反应物和生成物都为化合物
五、石灰石和石灰岩地区的溶洞
奇妙的石笋和钟乳石
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
溶洞的形成
1、判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
NaOH + HCl——
KNO3 + NaOH——
不能
BaSO4↓+ 2NaCl
NaCl+H2O
不能
2、下列各组离子能共存的是( )
A、 Ba2+、K+、NO3-、CO32-、H+
B、K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+
D、Ag+、Ba2+、Cl-、NO3-、K+
B
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥工业所做的贡献。
NH3+CO2+H2O = NH4HCO3 NH4HCO3+NaCl = NaHCO3↓+NH4Cl
判断复分解反应能否发生常涉及的沉淀有:
BaSO4(白色沉淀)
Cu(OH)2(蓝色沉淀)
1.判断复分解反应能否发生。
2.判断离子能否共存。
应 用
Mg(OH)2
BaCO3
CaCO3
AgCl(白色沉淀)
(白色沉淀)
(白色沉淀)
(白色沉淀)
Fe(OH)3(红褐色沉淀)
CuCO3(蓝色沉淀)
{
不溶酸
{
有色沉淀
同课章节目录
