人教版化学下册第十单元课题2 酸和碱的中和反应第二课时课件(共19张PPT)
文档属性
| 名称 | 人教版化学下册第十单元课题2 酸和碱的中和反应第二课时课件(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 684.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-18 00:00:00 | ||
图片预览





文档简介
(共19张PPT)
课题2
酸和碱的中和反应第二课时
复习提问
酸有哪些化学性质?用化学方程式说明。
1、能使紫色石蕊试剂变红色.无色酚 酞不变色
2、酸+较活泼金属→盐+氢气
3、酸+金属氧化物→盐+水
4、酸+碱→盐+水
5、酸+盐→新盐+新酸
碱有哪些化学性质?用化学方程式说明。
1、能使紫色石蕊试剂变蓝色.无色酚 酞变红色
2、碱+非金属氧化物→盐+水
3、酸+碱→盐+水
4、碱+盐→新盐+新碱
如NaCl、Na2SO4
等溶液
如HCl、H2SO4等溶液
如Na2CO3、 Ca(OH)2 、NaOH等溶液
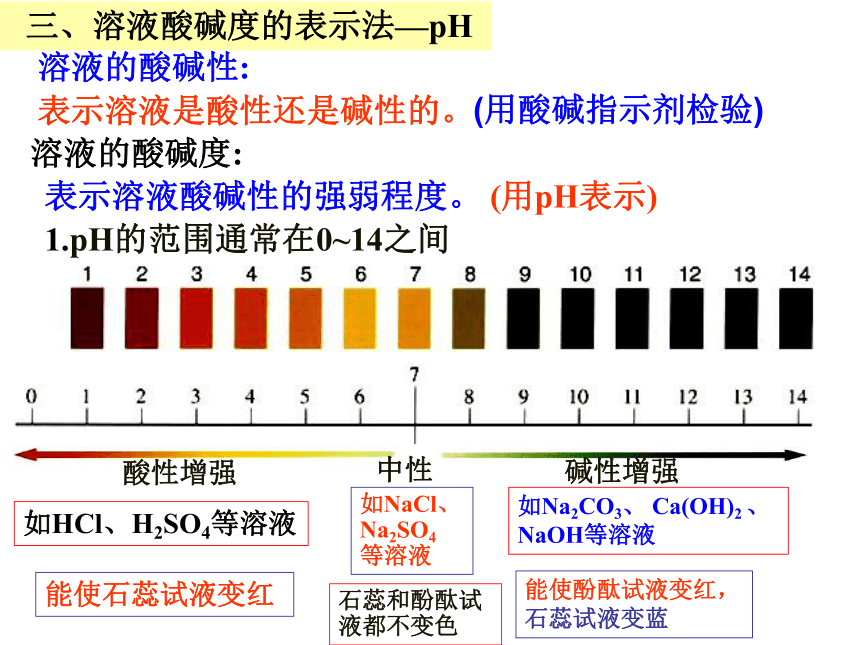
能使石蕊试液变红
能使酚酞试液变红,石蕊试液变蓝
石蕊和酚酞试液都不变色
三、溶液酸碱度的表示法—pH
1.pH的范围通常在0~14之间
溶液的酸碱性:
表示溶液是酸性还是碱性的。
溶液的酸碱度:
表示溶液酸碱性的强弱程度。 (用pH表示)
中性
(用酸碱指示剂检验)
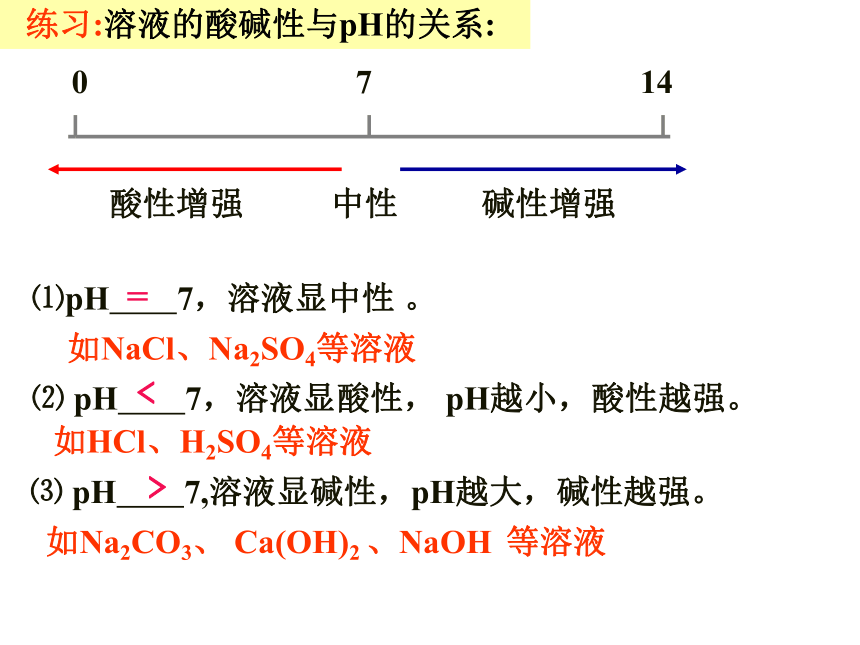
⑴pH 7,溶液显中性 。
⑶ pH 7,溶液显碱性,pH越大,碱性越强。
=
﹥
如NaCl、Na2SO4等溶液
如HCl、H2SO4等溶液
⑵ pH 7,溶液显酸性, pH越小,酸性越强。
如Na2CO3、 Ca(OH)2 、NaOH 等溶液
练习:溶液的酸碱性与pH的关系:
0 7 14
中性
﹤
pH的测定——用pH试纸测定
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
测定方法:
PH试纸的正确使用注意:
1、不能直接把试纸浸入试液,否则会污染试液。
2、不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。酸 PH会变大,碱PH会变小
3、测得值为整数
活动与探究:用PH试纸测定一些溶液的pH
①测定几种酸或碱的稀溶液的PH
②测定生活中的一些物质的pH,说明它们的酸碱性(书63页)
1
1
14
pH pH pH
稀硫酸 稀盐酸 氢氧化钠溶液
PH 酸碱性 PH 酸碱性
橘汁 汽水
糖水 自来水
牛奶 唾液
番茄汁 草木灰水
肥皂水 洗洁精
4.了解溶液的酸碱度有重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况
[注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6];
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
活动与探究:
洗发剂和护发剂的酸碱度
健康的头发
受损伤的头发
讨论:溶液的酸碱度不同对头发影响 , 性溶液对头发有保护作用,溶液______性越强,对头发损害越大。
不同
酸碱
中
四、调节溶液pH的方法(补充在课本P64)
1.若pH
⑴pH增大至=或﹥ 7
﹥7
﹤7
2.若pH
⑵pH增大至≈7
⑴pH减小到=或﹤ 7
⑵pH减小至≈7
图像变化
加碱:
加水
加酸
加水
改变酸碱度强弱的方法
⑴使酸性溶液的pH升高应
⑵使碱性溶液的pH降低应
酸中加水
酸中加碱
碱中加酸
碱中加水
加水或碱性溶液
加水或酸性溶液
在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13所示。 ?????????????????????
(1)该反应的化学方程式为:
? ??????????????????????????????????????。
(2)该实验操作是将 ?
????????????????滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,所得溶液中的溶
质为(写化学式)?????????????????????????? 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈???? 色。
NaOH+HCl=NaCl+H2O
氢氧化钠溶液?
HCl、NaCl
红
复习巩固:
1.向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成_______色,pH_____7;逐滴向锥形瓶中滴入盐酸并振荡,至溶液刚刚褪成无色里,pH_____7;继续滴盐酸,pH_____7。
2.在一瓶溶液的pH是4.5,取少量该溶液加入试管中,再滴几滴酚酞溶液,溶液呈______色。如果要使试管里溶液的pH升高,可以采取________________的方法。
红
大于
等于
小于
无
加入碱溶液
或加水稀释
3.酸雨是指pH ( )
A.小于5.6的降水 B.等于5.6的降水
C.大于5.6的降水 D.小于7的降水 a
2.某同学从资料上获悉,一些紫色的叶或花瓣浸出液具有类似石蕊溶液的性质。如果他想知道紫色的喇叭花是否具有这种性质,不应把花瓣浸出液分别滴入下列哪组物质进行观察 ( )
A.食醋、碱性肥皂水 B.食醋、酸奶
C.糖水、酸奶 D.食醋、食盐水
A
B
1.
2.溶液的酸碱度可用pH表示,用pH试纸可以测定溶 液的酸碱度。 pH 在0—14之间。
4、了解溶液酸碱度在实际中有重要的意义
农业 、工业 、环境 、生活
溶液的酸碱度和酸碱性
①pH 7,溶液呈中性,
②pH 7溶液呈酸性, PH越小,酸性越强,
③pH 7溶液呈碱性, PH越大,碱性越强。
3、溶液的酸碱性与pH的关系:
﹥
﹤
=
2.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。
无
加碱性溶液
1.PH=0的溶液是 ( )
A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
B
练习:
4.失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,可用 加以区分。
稀HCl
蒸馏水
NaOH
步骤:
⑵分别滴加酚酞,振荡。
变红的是NaOH溶液
⑶取少量NaOH溶液再分别滴到另外两只试管中,振荡。
⑴用三支试管,分别取少量三种无色液体。
变红的无色液体是蒸馏水,仍为无色的是稀盐酸。
紫色石蕊溶液
能否用酚酞试液将它们鉴别出来?
谢谢
课题2
酸和碱的中和反应第二课时
复习提问
酸有哪些化学性质?用化学方程式说明。
1、能使紫色石蕊试剂变红色.无色酚 酞不变色
2、酸+较活泼金属→盐+氢气
3、酸+金属氧化物→盐+水
4、酸+碱→盐+水
5、酸+盐→新盐+新酸
碱有哪些化学性质?用化学方程式说明。
1、能使紫色石蕊试剂变蓝色.无色酚 酞变红色
2、碱+非金属氧化物→盐+水
3、酸+碱→盐+水
4、碱+盐→新盐+新碱
如NaCl、Na2SO4
等溶液
如HCl、H2SO4等溶液
如Na2CO3、 Ca(OH)2 、NaOH等溶液
能使石蕊试液变红
能使酚酞试液变红,石蕊试液变蓝
石蕊和酚酞试液都不变色
三、溶液酸碱度的表示法—pH
1.pH的范围通常在0~14之间
溶液的酸碱性:
表示溶液是酸性还是碱性的。
溶液的酸碱度:
表示溶液酸碱性的强弱程度。 (用pH表示)
中性
(用酸碱指示剂检验)
⑴pH 7,溶液显中性 。
⑶ pH 7,溶液显碱性,pH越大,碱性越强。
=
﹥
如NaCl、Na2SO4等溶液
如HCl、H2SO4等溶液
⑵ pH 7,溶液显酸性, pH越小,酸性越强。
如Na2CO3、 Ca(OH)2 、NaOH 等溶液
练习:溶液的酸碱性与pH的关系:
0 7 14
中性
﹤
pH的测定——用pH试纸测定
在白瓷板或玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
测定方法:
PH试纸的正确使用注意:
1、不能直接把试纸浸入试液,否则会污染试液。
2、不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。酸 PH会变大,碱PH会变小
3、测得值为整数
活动与探究:用PH试纸测定一些溶液的pH
①测定几种酸或碱的稀溶液的PH
②测定生活中的一些物质的pH,说明它们的酸碱性(书63页)
1
1
14
pH pH pH
稀硫酸 稀盐酸 氢氧化钠溶液
PH 酸碱性 PH 酸碱性
橘汁 汽水
糖水 自来水
牛奶 唾液
番茄汁 草木灰水
肥皂水 洗洁精
4.了解溶液的酸碱度有重要意义:
①化工生产中许多反应必须在一定pH溶液里才能进行;
②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长;
③测定雨水的pH,可以了解空气的污染情况
[注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6];
④测定人体内或排出的液体的pH,可以了解人体的健康状况。
活动与探究:
洗发剂和护发剂的酸碱度
健康的头发
受损伤的头发
讨论:溶液的酸碱度不同对头发影响 , 性溶液对头发有保护作用,溶液______性越强,对头发损害越大。
不同
酸碱
中
四、调节溶液pH的方法(补充在课本P64)
1.若pH
⑴pH增大至=或﹥ 7
﹥7
﹤7
2.若pH
⑵pH增大至≈7
⑴pH减小到=或﹤ 7
⑵pH减小至≈7
图像变化
加碱:
加水
加酸
加水
改变酸碱度强弱的方法
⑴使酸性溶液的pH升高应
⑵使碱性溶液的pH降低应
酸中加水
酸中加碱
碱中加酸
碱中加水
加水或碱性溶液
加水或酸性溶液
在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图13所示。 ?????????????????????
(1)该反应的化学方程式为:
? ??????????????????????????????????????。
(2)该实验操作是将 ?
????????????????滴加到另一种溶液中。
(3)当加入溶液的质量为a g时,所得溶液中的溶
质为(写化学式)?????????????????????????? 。
(4)当加入溶液的质量为b g时,向所得溶液中滴加酚酞溶液,溶液呈???? 色。
NaOH+HCl=NaCl+H2O
氢氧化钠溶液?
HCl、NaCl
红
复习巩固:
1.向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成_______色,pH_____7;逐滴向锥形瓶中滴入盐酸并振荡,至溶液刚刚褪成无色里,pH_____7;继续滴盐酸,pH_____7。
2.在一瓶溶液的pH是4.5,取少量该溶液加入试管中,再滴几滴酚酞溶液,溶液呈______色。如果要使试管里溶液的pH升高,可以采取________________的方法。
红
大于
等于
小于
无
加入碱溶液
或加水稀释
3.酸雨是指pH ( )
A.小于5.6的降水 B.等于5.6的降水
C.大于5.6的降水 D.小于7的降水 a
2.某同学从资料上获悉,一些紫色的叶或花瓣浸出液具有类似石蕊溶液的性质。如果他想知道紫色的喇叭花是否具有这种性质,不应把花瓣浸出液分别滴入下列哪组物质进行观察 ( )
A.食醋、碱性肥皂水 B.食醋、酸奶
C.糖水、酸奶 D.食醋、食盐水
A
B
1.
2.溶液的酸碱度可用pH表示,用pH试纸可以测定溶 液的酸碱度。 pH 在0—14之间。
4、了解溶液酸碱度在实际中有重要的意义
农业 、工业 、环境 、生活
溶液的酸碱度和酸碱性
①pH 7,溶液呈中性,
②pH 7溶液呈酸性, PH越小,酸性越强,
③pH 7溶液呈碱性, PH越大,碱性越强。
3、溶液的酸碱性与pH的关系:
﹥
﹤
=
2.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。
无
加碱性溶液
1.PH=0的溶液是 ( )
A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
B
练习:
4.失去标签的三瓶无色液体,分别是稀HCl、蒸馏水、NaOH溶液,可用 加以区分。
稀HCl
蒸馏水
NaOH
步骤:
⑵分别滴加酚酞,振荡。
变红的是NaOH溶液
⑶取少量NaOH溶液再分别滴到另外两只试管中,振荡。
⑴用三支试管,分别取少量三种无色液体。
变红的无色液体是蒸馏水,仍为无色的是稀盐酸。
紫色石蕊溶液
能否用酚酞试液将它们鉴别出来?
谢谢
同课章节目录
