科粤版九上化学3.4 组成物质的表达式-化合价与化学式 课件(48张ppt)
文档属性
| 名称 | 科粤版九上化学3.4 组成物质的表达式-化合价与化学式 课件(48张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-21 20:31:52 | ||
图片预览







文档简介
(共48张PPT)
物质组成的表示式
这个符号让我们想到了……
1、定义
一、化学式
用元素符号和数字的组合
表示物质组成的式子。
纯净物有化学式,混合物没有
一种物质只有一种化学式
同一个化学式可以表示不同的物质
表示水这种物质
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
表示一个水分子
①表示一种物质
②表示这种物质由什么元素组成
宏观
微观
2、化学式的含义
③表示这种物质的一个分子
④表示这种物质一个分子由什么元素的各多少原子构成
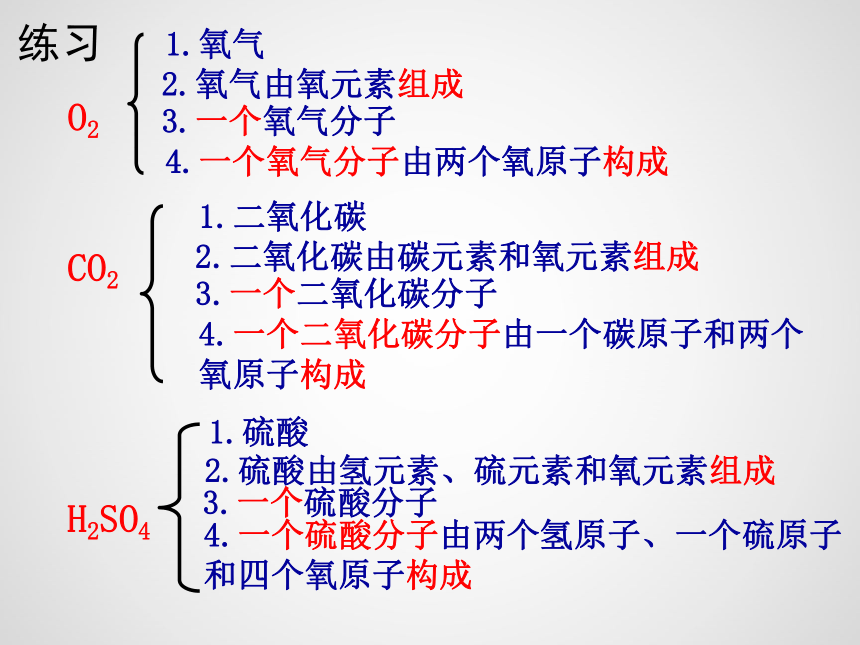
练习
O2
CO2
H2SO4
2.硫酸由氢元素、硫元素和氧元素组成
3.一个硫酸分子
1.硫酸
1.氧气
4.一个氧气分子由两个氧原子构成
2.氧气由氧元素组成
3.一个氧气分子
1.二氧化碳
4.一个二氧化碳分子由一个碳原子和两个氧原子构成
2.二氧化碳由碳元素和氧元素组成
3.一个二氧化碳分子
4.一个硫酸分子由两个氢原子、一个硫原子和四个氧原子构成
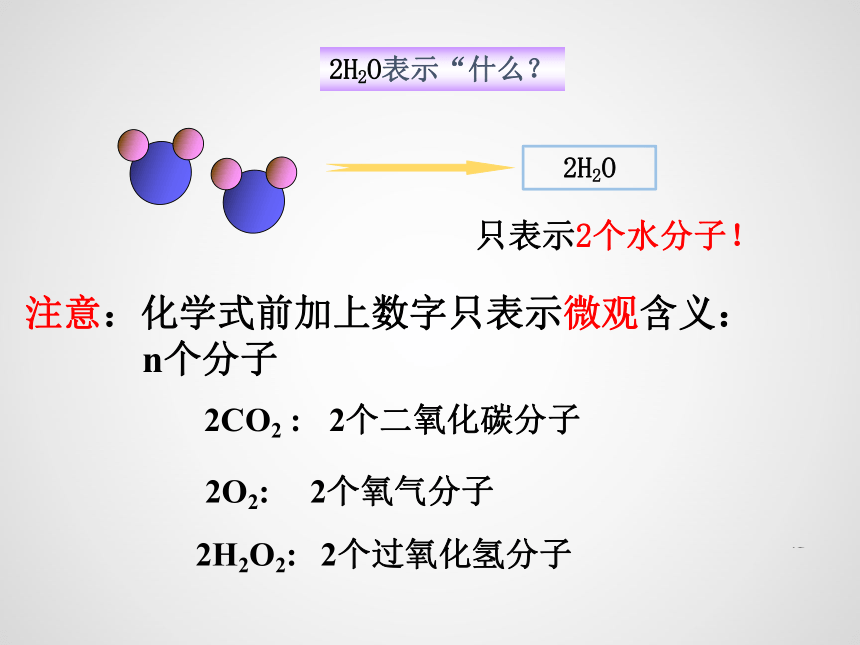
2H2O
2H2O表示“什么?
2CO2 :
注意:化学式前加上数字只表示微观含义:
n个分子
2O2:
只表示2个水分子!
2个二氧化碳分子
2个氧气分子
2H2O2:
2个过氧化氢分子
练习:讨论H、2H、H2、2H2各表示什么意义?
H:
2H:
H2:
2H2:
①氢元素②1个氢原子
2个氢原子
①氢气
②氢气由氢元素组成
③1个氢气分子
④1个氢气分子由2个氢原子构成
2个氢气分子
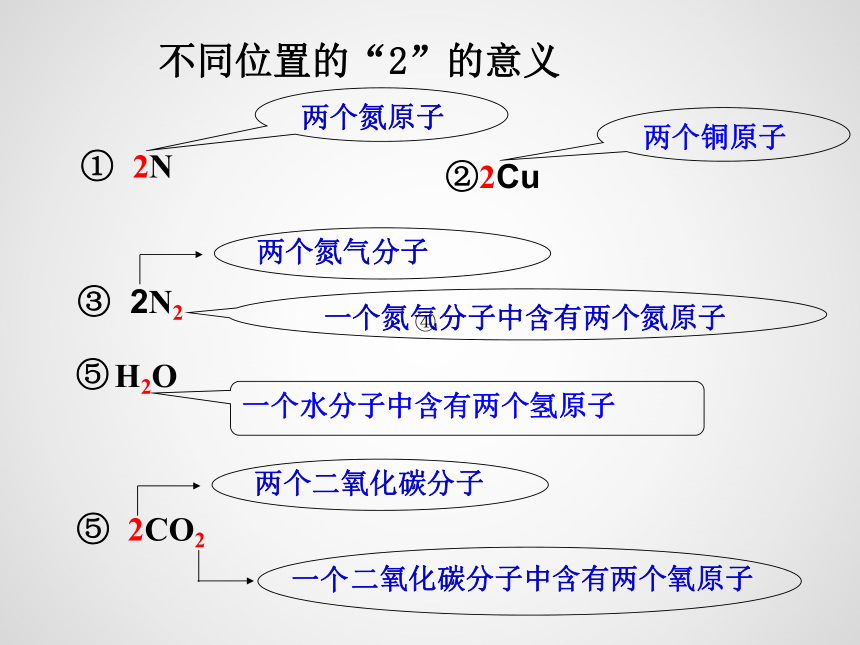
① 2N
⑤ 2CO2
③ 2N2
两个氮原子
一个氮气分子中含有两个氮原子
两个二氧化碳分子
一个
二氧化碳分子中含有两个氧原子
不同位置的“2”的意义
②2Cu
两个铜原子
两个氮气分子
一个水分子中含有两个氢原子
H2O
⑤
④
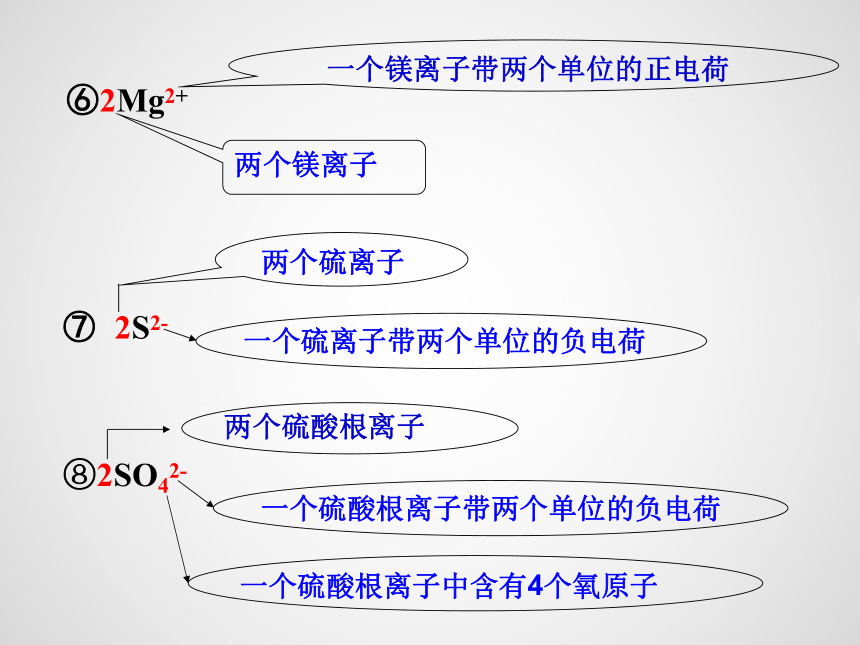
⑦ 2S2-
两个硫离子
一个硫离子带两个单位的负电荷
⑧2SO42-
两个硫酸根离子
一个硫酸根离子带两个单位的负电荷
⑥2Mg2+
一个镁离子带两个单位的正电荷
两个镁离子
一个硫酸根离子中含有4个氧原子
二、化学式的书写
1.单质化学式
(1)由原子直接构成的单质
所有金属
稀有气体
部分固态非金属
(2)由分子直接构成的单质:
如O2、N2、H2、Cl2 、 O3、 Br2、I2 、C60等。
如:Fe、Cu、Na、K等
如:He、Ne、Ar、Kr等
如:C、P、S、B等
:化学式就是元素符号
元素符号和角标(数字)
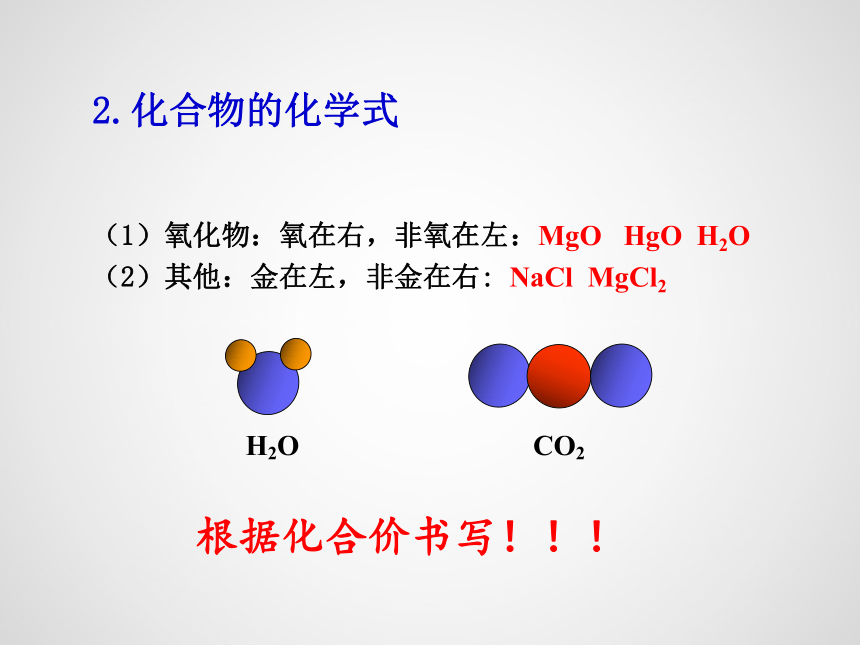
2.化合物的化学式
H2O
CO2
(1)氧化物:氧在右,非氧在左:MgO HgO H2O
(2)其他:金在左,非金在右: NaCl MgCl2
根据化合价书写!!!
三、化合价
1.定义:元素形成化合物时表现出来的一种性质(即微粒间固定的比值关系)
注意:元素的化合价,不是原子、离子或分子的化合价!!!
+1 +2 +3 -2 -2 -1
Na Mg Al O S Cl
元素化合价
原 子
离 子
易 失 电 子
易 得 电 子
+ 2+ 3+ 2- 2- -
Na Mg Al O S Cl
元素的化合价标在元素符号的正上方,有正价和负价之分,用+n或-n表示。
表示方法:R
+/-n
方位
数和号的位置
“1”的处理
名称
离子符号
化合价
右上角
正上方
数字在前,符号在后
符号在前,数字在后
省略不写
不能省略
数值相等、正负相同
联系:
2.化合价的写法和读法
(1)写法
(2)读法
正/负n价某元素 或 某元素显正/负n价
H2O
+1
-2
R
+/- n
元素化合价:
一价钾钠氯氢银;
二价氧钙钡镁锌;
三铝四硅五价磷;
二三铁,二四碳,
二四六硫都齐全;
铜汞二价最常见。
单质零价永不变
原子团化合价:
负一硝酸氢氧根,
负二硫酸碳酸根,
负三记住磷酸根,
正一价的是铵根。
化合价口诀
带电的一个整体的原子
的集团(原子团),叫根
化合价
一价K Na Cl H Ag
二价 O Ca Ba Mg Zn
三 Al Si P
Fe 、 C
S 都齐全
Cu Hg 二价最常见
单质零价永不变
+1 +1 -1 +1 +1
-2 +2 +2 +2 +2
+3 +4 +5
+2、+3 +2、+4
-2、+4、+6
+2 +2
原子团化合价:
负一 NO3- OH-
负二SO42- CO32-
负三 PO43-
正一 价的是NH4+
例:标出下列物质中各元素的化合价
氯化锌 金属锌 氢氧化钠 水
ZnCl2 NaOH NaOH H2O He
+2 -1
+1 –2 +1
+1 -2
+1 -1
MgO
+2
H2O
-2
拓展:不同位置的“2”的意义
2:氧化镁中镁元素的化合价是正二价
2:水中氧元素的化合价是负二价
0
(1)金属全部显 价,非金属一般显 价。
(2)化合物中,通常氢显 价,氧显 价,非金属元素与氧结合时显 。
(3)部分元素可显示不同的化合价;
同一元素在同一化合物中可显不同的化合价。
例:Fe有+2(亚铁)、+3价 Cu有+1(亚铜)、+2价
NH4NO3
3、化合价规则
-3 +5
正
负
+1
-2
正价
(4)单质中元素的化合价为0。
(5)化合物中元素的正负化合价代数和为0。
注意:原子团的化合价是原子团中每个元素化合价的代数和。
4.化合物的读法
(1)由两种元素组成的化合物:“某化某”
如:KCl CaO CuO Na2S NaCl HCl
注意:氧化物有时要读出各原子的个数:“几氧化几某”
如:Fe3O4 Fe2O3 CO2 CO P2O5
MnO2 SO2 SO3 NO NO2 Al2O3
从右向左读 某化某 某酸某
氯化钾
氧化钙
氧化铜
硫化钠
四氧化三铁
二氧化碳
三氧化二铁
一氧化碳
氯化钠
五氧化二磷
二氧化锰
三氧化硫
二氧化硫
一氧化氮
二氧化氮
氯化氢
三氧化二铝
(2)含有原子团的化合物:“某酸某” “氢氧化某”
如Na2CO3 AgNO3 K2SO4 AlPO4 (NH4)2SO4
NaOH Ca(OH)2 Fe(OH)3 Ba(OH)2
注意:如果酸根与H组合,直接读“某酸”
如H2CO3 H2SO4 HNO3 H3PO4
碳酸钠
硫酸铵
氢氧化钠
碳酸
氢氧化钙
硝酸银
硫酸
硝酸
磷酸
我叫盐酸,
HCl
磷酸铝
硫酸钾
氢氧化铁
氢氧化钡
MgO NaCl CuO HCl KI ZnCl2
SO2 CO2 P2O5 Fe3O4 Al2O3
Fe2O3 Na2CO3 CaCO3 K2SO4 Fe2(SO4) 3
NH4NO3 Cu(NO3 )2 KClO3 H2CO3 HNO3
Cu(OH)2 Fe(OH)3 NaOH KMnO4 K2MnO4
氧化镁 氯化钠 氧化铜 氯化氢\盐酸 碘化钾 氯化锌
二氧化硫 二氧化碳 五氧化二磷 四氧化三铁 三氧化二铝
三氧化二铁 碳酸钠 碳酸钙 硫酸钾 硫酸铁
硝酸铵 硝酸铜 氯酸钾 碳酸 硝酸
氢氧化铜 氢氧化铁 氢氧化钠 高锰酸钾 锰酸钾
氧化亚铁
FeO
Fe(OH)2
FeSO4
氢氧化亚铁
硫酸亚铁
Cl2
NH4Cl
氯化铵
氯气
Cu2O
氧化亚铜
(2)方法:正价前,负价后,标出价,相交叉
5.根据化合价书写化合物的化学式
(1)原则:化合物中个元素的化合价代数和为0
①写出化合物的元素,正价前 负价后
②在元素的正上方标出化合价
③约简交叉(绝对值),把原子数写在各元素符号右下方。
④写出化学式并检查化合价代数和是否为零。
注意:酸根个数大于1时酸根带括号,括号外写角标
练习1 已知磷为+5价,氧为-2价,写出五氧化二磷的这种化合物的化学式。
例2 已知钙为+2价,氧为-2价,写出氧化钙的化学式。
例1 已知氢为+1价,氧为-2价,写出水的这种化合物的化学式。
练习2 已知镁为+2价,氧为-2价,写出氧化镁的化学式。
练习3已知钾为+1价,氢氧根为-1价,写出氢氧化钾的化学式。
例4 已知钠为+1价,碳酸根为-2价,写出碳酸钠的化学式。
例3 已知钠为+1价,氢氧根为-1价,写出氢氧化钠的化学式。
练习4 已知镁为+2价,碳酸根为-2价,写出碳酸镁的化学式。
练习5 已知钙为+2价,硝酸根为-1价,写出硝酸钙的化学式。
例6 已知铵根为+1价,硫酸根为-2价,写出硫酸铵的化学式。
例5 已知镁为+2价,硝酸根为-1价,写出硝酸镁的化学式。
练习6 已知铵根为+1价,碳酸根为-2价,写出碳酸铵的化学式。
(1) NH3和CH4
-3 +1 -4 +1
都是正价后负价前!!!
氨气
甲烷
(2)酸是由氢离子和酸根离子(硫酸根离子、碳
酸根离子、硝酸根离子和磷酸根离子)结合形成的
H
CO3
+1 -2
H2CO3
注意:
写出下列物质的化学式:
氧化铁 氧化铝 氧化锌 氧化汞
氧化钙 硫化氢 氢氧化钙 氢氧化钡
氢氧化铜 氢氧化铝 氢氧化铁 氯化钡
氯化亚铁 氯化银
硫酸铜 碳酸钠 碳酸钙 碳酸钡 磷酸钠
硫酸钠 硫酸钡 硫酸亚铁 硫酸铁 硫酸铝
硝酸钠 硝酸亚铁 硝酸铁 硝酸铝 硝酸铜
硝酸锌 硝酸铵 氯化铵 硫酸铵 碳酸铵 磷酸铵
盐酸 硫酸 硝酸 碳酸 磷酸
高锰酸钾 锰酸钾 氯酸钾
甲烷 氨气 氦气 氖气 氩气 氯气
1.写出下列物质的化学式:
氧化铁( )、氧化亚铁( )、氧化锌( )、
氯化银( )、氯化铜 ( )、氯化铁( )、
氯化亚铁( )、氯化钠( )
Fe2O3
FeO
ZnO
AgCl
CuCl2
FeCl3
FeCl2
NaCl
2.下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ____,氯化铁 FeCl2 ______, 氯化锌 ZnCl _____,
硫化铝 Al3 S2 ____,氢氧化铜CuOH _______,氯化钠ClNa _____
CaO
FeCl3
ZnCl2
Al2S3
Cu(OH)2
NaCl
3.判断下列化学式是否正确
Zn(SO4)2 Na(OH)3 BaCO3 Al2(SO4)3
ZnSO4
NaOH
6.化合价的应用
(1)由化学价判断化学式正误
依据:化合物中各元素化合价代数和为0
例:CuO Al2O
(2)由化学式求元素的化合价
例:求氯酸钾中氯元素的化合价
先写出化学式
KClO3
设未知数
解:设KClO3中Cl的化合价为X
列等式 (正负总价和为0)
+1+X+(-2)×3=0
解答
答:氯酸钾中氯元素的化合价为+5价
+5
X=+5
依据:化合物中各元素化合价代数和为0
注意:原子团一个整体带一定单位的电荷,原子团里每种元素的化合价代数和为离子所带电荷数!
例:硫酸根离子(SO42- )的化合价为负二价,求其中硫元素的化合价。
解:设SO42- 中S的化合价为X。
X+(-2)×4=-2
答:硫酸根离子中碳元素的化合价为+4价。
X=+6
2、已知在H3RO4中,氢元素为+1价,氧为-2价,则其中R的化合价为( ) A +3 B +4 C +5 D +6
3、下列化合物中,氮元素为+5价的是( )
A NO B NO2 C NH3 D KNO3
C
D
+5 +6 +7 +4 +5 +5 +6 +5
-3 +7 +1
4、元素R的氧化物的化学式为R2O3,则R元素与OH-组 成的物质的化学式为( )
A ROH B R(OH)2 C R(OH)3 D R(OH)4
C
1、求下列物质中元素的化合价
P2O5 K2MnO4 KMnO4 MnO2 KClO3 NO3- SO42- PO43-
NH4+ HClO4 HClO
1.相对分子质量(Mr)的计算
例2.计算 NH4NO3 的相对分子质量
解:Mr(NH4NO3 )
= 14×2+1×4+16×3
= 80
五、化学式的计算
相对分子质量:化学式中各原子的相对原子质量总和。
注意:相对分子质量也是比值,单位为1!!!
例1.计算水的相对分子质量
解:Mr(H2O)
= 1×2+16×1
= 18
例3.计算硫酸铝 Al2(SO4)3 的相对分子质量
解:Mr[Al2(SO4)3 ]
= 27×2+(32×1+16×4)×3
= 342
例5.计算CuSO4·5H2O的相对分子质量
例4.计算5H2O的相对分子质量
解:Mr[5H2O]
= 5×(1×2+16×1)
= 90
=64×1+32×1+16×4 + 5×(1×2+16×1)
解:Mr[CuSO4·5H2O]
=250
例6.计算KAl(SO4)2·5H2O的相对分子质量
=39+27+(32+16×4) ×2 + 12×(1×2+16)
解:Mr[KAl(SO4)·12H2O]
=474
2.化学式中各元素质量比
例2.计算Fe2O3中铁、氧元素两种元素的质量比
=56×2:16×3
= 7 : 3
解:
铁元素的质量:氧元素的质量
mFe : mO
注意:一定不要漏掉原子的个数!!!
a元素原子的相对原子质量×a原子的个数:
b元素原子的相对原子质量×b原子的个数(最简比)
例1.计算H2O中氢、氧元素两种元素的质量比
解:mH : mO
=1×2 : 16×1
= 1 : 8
练习
1.硝酸铵(NH4NO3)中各元素的质量比
2.硫酸铵 (NH4)2SO4中各元素的质量比
3.五水硫酸铜(CuSO4.5H2O)中硫元素与氧元素的质量比
相对原子质量:H-1、O-16、N-14 、S-32、Cu-64
解:mN:mH:mo = 14×2 :1×4 :16×3 = 7 :1 :12
解:mN:mH:ms:mo =7 : 2 :8: 16
解:ms:mo =32×1 : 16×9 = 2 : 9
3.化合物中某元素的质量分数
质量分数:元素的质量与化合物相对分子质量之比
某元素的质量分数=
该元素的相对原子质量×该原子的个数
化合物的相对分子质量
×100%
例1.求水(H2O)中氢元素的质量分数?
解:H%=
×100%≈11.1%
1×2+16×1
1 × 2
答:水中氢元素的质量分数约为11.1%。
注意:计算过程中除不尽时保留一位小数!
例2.计算硝酸铵NH4NO3中氮元素质量分数
硝酸铵中氮元素的质量分数
=
14 × 2
14×2+1×4+16×3
×100%
=35%
答:硝酸铵中氮元素的质量分数为35%。
氮原子个数×氮元素相对原子质量
硝酸铵相对分子质量
×100%
=
N%
解:
1.求CaCO3中氧元素的质量分数?
??
2. 求CO(NH2)2中氮元素的质量分数?
?
相对原子质量:H-1、C-12、N-14、O-16、Ca-40
=48%?
≈46.7%
=
16 × 3
14×2+1×4+16×3
×100%
O%
=
14 × 2
12×1+16×1+14×2+1×4
×100%
N%
4.求化合物中某元素的质量
例2.80g硝酸铵中含氮元素多少克?
= 80g ×
2×14
80
×100%
= 28g
解:80g硝酸铵中含氮元素的质量
某元素的质量 = 化合物总质量×该元素的质量分数
例1.18g水(H2O )中含多少克氢元素?
18g×
×100%
1×2+16×1
1 × 2
解:氢元素的质量=
=2g
5.求化合物的质量
例2.计算多少克二氧化硫中含硫元素32g?
解:设质量为 x 的二氧化硫中含硫元素32克
X ×
32
64
×100%
=32g
X = 64g
化合物的质量=
某元素的质量
÷
某元素的质量分数
例1.多少克水中含有20克氢元素?
=20g
x=180g
1×2
×100%
X ×
1×2+16×1
解:(1)
(2)
20g
1×2
×100%
1×2+16×1
=180g
纯净物的质量
混合物的质量
×100%
=
混合物中某物质的质量分数(纯度)
例2.鸡蛋壳中碳酸钙的纯度为75%,求5g鸡蛋壳中碳酸钙
的质量?
=3.75g
解:5g×75%
例1.20g加碘食盐中氯化钠的质量是19g,氯化钠的纯度?
解:
=95%
19g
×100%
20g
6.不纯物质的计算
练1.计算100g含碳酸钙90%的石灰石中含钙元素的质量
解:含钙元素的质量
=
100g ×90%
×
40
40+12+16×3
×100%
= 90g ×
40%
= 36g
答:100g含碳酸钙90%的石灰石中含钙元素36g。
练2.90克含硝酸铵80%的化肥中含氮元素的质量为多少?
=
90g ×80% ×
×100%
2×14
80
= 25.2g
答:
90克含硝酸铵80%的化肥中含氮元素25.2克。
解:氮元素的质量
X
·
14×2
12×1+16×1+14×2+1×2
×100%
练3.多少克尿素[CO(NH2)2]与80g硝酸铵(NH4NO3)中所含氮元素的质量相等?
解:设X尿素与80g硝酸铵中所含氮元素的质量相等
80g
×
14×2
14×2+1×4+16×3
×100%
=
X= 60g
答:60g尿素与80g硝酸铵中所含氮元素的质量相等。
X×尿素中N% = 80g×硝酸铵中N%
物质组成的表示式
这个符号让我们想到了……
1、定义
一、化学式
用元素符号和数字的组合
表示物质组成的式子。
纯净物有化学式,混合物没有
一种物质只有一种化学式
同一个化学式可以表示不同的物质
表示水这种物质
表示水由氢元素和氧元素组成
表示一个水分子由2个氢原子和1个氧原子构成
表示一个水分子
①表示一种物质
②表示这种物质由什么元素组成
宏观
微观
2、化学式的含义
③表示这种物质的一个分子
④表示这种物质一个分子由什么元素的各多少原子构成
练习
O2
CO2
H2SO4
2.硫酸由氢元素、硫元素和氧元素组成
3.一个硫酸分子
1.硫酸
1.氧气
4.一个氧气分子由两个氧原子构成
2.氧气由氧元素组成
3.一个氧气分子
1.二氧化碳
4.一个二氧化碳分子由一个碳原子和两个氧原子构成
2.二氧化碳由碳元素和氧元素组成
3.一个二氧化碳分子
4.一个硫酸分子由两个氢原子、一个硫原子和四个氧原子构成
2H2O
2H2O表示“什么?
2CO2 :
注意:化学式前加上数字只表示微观含义:
n个分子
2O2:
只表示2个水分子!
2个二氧化碳分子
2个氧气分子
2H2O2:
2个过氧化氢分子
练习:讨论H、2H、H2、2H2各表示什么意义?
H:
2H:
H2:
2H2:
①氢元素②1个氢原子
2个氢原子
①氢气
②氢气由氢元素组成
③1个氢气分子
④1个氢气分子由2个氢原子构成
2个氢气分子
① 2N
⑤ 2CO2
③ 2N2
两个氮原子
一个氮气分子中含有两个氮原子
两个二氧化碳分子
一个
二氧化碳分子中含有两个氧原子
不同位置的“2”的意义
②2Cu
两个铜原子
两个氮气分子
一个水分子中含有两个氢原子
H2O
⑤
④
⑦ 2S2-
两个硫离子
一个硫离子带两个单位的负电荷
⑧2SO42-
两个硫酸根离子
一个硫酸根离子带两个单位的负电荷
⑥2Mg2+
一个镁离子带两个单位的正电荷
两个镁离子
一个硫酸根离子中含有4个氧原子
二、化学式的书写
1.单质化学式
(1)由原子直接构成的单质
所有金属
稀有气体
部分固态非金属
(2)由分子直接构成的单质:
如O2、N2、H2、Cl2 、 O3、 Br2、I2 、C60等。
如:Fe、Cu、Na、K等
如:He、Ne、Ar、Kr等
如:C、P、S、B等
:化学式就是元素符号
元素符号和角标(数字)
2.化合物的化学式
H2O
CO2
(1)氧化物:氧在右,非氧在左:MgO HgO H2O
(2)其他:金在左,非金在右: NaCl MgCl2
根据化合价书写!!!
三、化合价
1.定义:元素形成化合物时表现出来的一种性质(即微粒间固定的比值关系)
注意:元素的化合价,不是原子、离子或分子的化合价!!!
+1 +2 +3 -2 -2 -1
Na Mg Al O S Cl
元素化合价
原 子
离 子
易 失 电 子
易 得 电 子
+ 2+ 3+ 2- 2- -
Na Mg Al O S Cl
元素的化合价标在元素符号的正上方,有正价和负价之分,用+n或-n表示。
表示方法:R
+/-n
方位
数和号的位置
“1”的处理
名称
离子符号
化合价
右上角
正上方
数字在前,符号在后
符号在前,数字在后
省略不写
不能省略
数值相等、正负相同
联系:
2.化合价的写法和读法
(1)写法
(2)读法
正/负n价某元素 或 某元素显正/负n价
H2O
+1
-2
R
+/- n
元素化合价:
一价钾钠氯氢银;
二价氧钙钡镁锌;
三铝四硅五价磷;
二三铁,二四碳,
二四六硫都齐全;
铜汞二价最常见。
单质零价永不变
原子团化合价:
负一硝酸氢氧根,
负二硫酸碳酸根,
负三记住磷酸根,
正一价的是铵根。
化合价口诀
带电的一个整体的原子
的集团(原子团),叫根
化合价
一价K Na Cl H Ag
二价 O Ca Ba Mg Zn
三 Al Si P
Fe 、 C
S 都齐全
Cu Hg 二价最常见
单质零价永不变
+1 +1 -1 +1 +1
-2 +2 +2 +2 +2
+3 +4 +5
+2、+3 +2、+4
-2、+4、+6
+2 +2
原子团化合价:
负一 NO3- OH-
负二SO42- CO32-
负三 PO43-
正一 价的是NH4+
例:标出下列物质中各元素的化合价
氯化锌 金属锌 氢氧化钠 水
ZnCl2 NaOH NaOH H2O He
+2 -1
+1 –2 +1
+1 -2
+1 -1
MgO
+2
H2O
-2
拓展:不同位置的“2”的意义
2:氧化镁中镁元素的化合价是正二价
2:水中氧元素的化合价是负二价
0
(1)金属全部显 价,非金属一般显 价。
(2)化合物中,通常氢显 价,氧显 价,非金属元素与氧结合时显 。
(3)部分元素可显示不同的化合价;
同一元素在同一化合物中可显不同的化合价。
例:Fe有+2(亚铁)、+3价 Cu有+1(亚铜)、+2价
NH4NO3
3、化合价规则
-3 +5
正
负
+1
-2
正价
(4)单质中元素的化合价为0。
(5)化合物中元素的正负化合价代数和为0。
注意:原子团的化合价是原子团中每个元素化合价的代数和。
4.化合物的读法
(1)由两种元素组成的化合物:“某化某”
如:KCl CaO CuO Na2S NaCl HCl
注意:氧化物有时要读出各原子的个数:“几氧化几某”
如:Fe3O4 Fe2O3 CO2 CO P2O5
MnO2 SO2 SO3 NO NO2 Al2O3
从右向左读 某化某 某酸某
氯化钾
氧化钙
氧化铜
硫化钠
四氧化三铁
二氧化碳
三氧化二铁
一氧化碳
氯化钠
五氧化二磷
二氧化锰
三氧化硫
二氧化硫
一氧化氮
二氧化氮
氯化氢
三氧化二铝
(2)含有原子团的化合物:“某酸某” “氢氧化某”
如Na2CO3 AgNO3 K2SO4 AlPO4 (NH4)2SO4
NaOH Ca(OH)2 Fe(OH)3 Ba(OH)2
注意:如果酸根与H组合,直接读“某酸”
如H2CO3 H2SO4 HNO3 H3PO4
碳酸钠
硫酸铵
氢氧化钠
碳酸
氢氧化钙
硝酸银
硫酸
硝酸
磷酸
我叫盐酸,
HCl
磷酸铝
硫酸钾
氢氧化铁
氢氧化钡
MgO NaCl CuO HCl KI ZnCl2
SO2 CO2 P2O5 Fe3O4 Al2O3
Fe2O3 Na2CO3 CaCO3 K2SO4 Fe2(SO4) 3
NH4NO3 Cu(NO3 )2 KClO3 H2CO3 HNO3
Cu(OH)2 Fe(OH)3 NaOH KMnO4 K2MnO4
氧化镁 氯化钠 氧化铜 氯化氢\盐酸 碘化钾 氯化锌
二氧化硫 二氧化碳 五氧化二磷 四氧化三铁 三氧化二铝
三氧化二铁 碳酸钠 碳酸钙 硫酸钾 硫酸铁
硝酸铵 硝酸铜 氯酸钾 碳酸 硝酸
氢氧化铜 氢氧化铁 氢氧化钠 高锰酸钾 锰酸钾
氧化亚铁
FeO
Fe(OH)2
FeSO4
氢氧化亚铁
硫酸亚铁
Cl2
NH4Cl
氯化铵
氯气
Cu2O
氧化亚铜
(2)方法:正价前,负价后,标出价,相交叉
5.根据化合价书写化合物的化学式
(1)原则:化合物中个元素的化合价代数和为0
①写出化合物的元素,正价前 负价后
②在元素的正上方标出化合价
③约简交叉(绝对值),把原子数写在各元素符号右下方。
④写出化学式并检查化合价代数和是否为零。
注意:酸根个数大于1时酸根带括号,括号外写角标
练习1 已知磷为+5价,氧为-2价,写出五氧化二磷的这种化合物的化学式。
例2 已知钙为+2价,氧为-2价,写出氧化钙的化学式。
例1 已知氢为+1价,氧为-2价,写出水的这种化合物的化学式。
练习2 已知镁为+2价,氧为-2价,写出氧化镁的化学式。
练习3已知钾为+1价,氢氧根为-1价,写出氢氧化钾的化学式。
例4 已知钠为+1价,碳酸根为-2价,写出碳酸钠的化学式。
例3 已知钠为+1价,氢氧根为-1价,写出氢氧化钠的化学式。
练习4 已知镁为+2价,碳酸根为-2价,写出碳酸镁的化学式。
练习5 已知钙为+2价,硝酸根为-1价,写出硝酸钙的化学式。
例6 已知铵根为+1价,硫酸根为-2价,写出硫酸铵的化学式。
例5 已知镁为+2价,硝酸根为-1价,写出硝酸镁的化学式。
练习6 已知铵根为+1价,碳酸根为-2价,写出碳酸铵的化学式。
(1) NH3和CH4
-3 +1 -4 +1
都是正价后负价前!!!
氨气
甲烷
(2)酸是由氢离子和酸根离子(硫酸根离子、碳
酸根离子、硝酸根离子和磷酸根离子)结合形成的
H
CO3
+1 -2
H2CO3
注意:
写出下列物质的化学式:
氧化铁 氧化铝 氧化锌 氧化汞
氧化钙 硫化氢 氢氧化钙 氢氧化钡
氢氧化铜 氢氧化铝 氢氧化铁 氯化钡
氯化亚铁 氯化银
硫酸铜 碳酸钠 碳酸钙 碳酸钡 磷酸钠
硫酸钠 硫酸钡 硫酸亚铁 硫酸铁 硫酸铝
硝酸钠 硝酸亚铁 硝酸铁 硝酸铝 硝酸铜
硝酸锌 硝酸铵 氯化铵 硫酸铵 碳酸铵 磷酸铵
盐酸 硫酸 硝酸 碳酸 磷酸
高锰酸钾 锰酸钾 氯酸钾
甲烷 氨气 氦气 氖气 氩气 氯气
1.写出下列物质的化学式:
氧化铁( )、氧化亚铁( )、氧化锌( )、
氯化银( )、氯化铜 ( )、氯化铁( )、
氯化亚铁( )、氯化钠( )
Fe2O3
FeO
ZnO
AgCl
CuCl2
FeCl3
FeCl2
NaCl
2.下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ____,氯化铁 FeCl2 ______, 氯化锌 ZnCl _____,
硫化铝 Al3 S2 ____,氢氧化铜CuOH _______,氯化钠ClNa _____
CaO
FeCl3
ZnCl2
Al2S3
Cu(OH)2
NaCl
3.判断下列化学式是否正确
Zn(SO4)2 Na(OH)3 BaCO3 Al2(SO4)3
ZnSO4
NaOH
6.化合价的应用
(1)由化学价判断化学式正误
依据:化合物中各元素化合价代数和为0
例:CuO Al2O
(2)由化学式求元素的化合价
例:求氯酸钾中氯元素的化合价
先写出化学式
KClO3
设未知数
解:设KClO3中Cl的化合价为X
列等式 (正负总价和为0)
+1+X+(-2)×3=0
解答
答:氯酸钾中氯元素的化合价为+5价
+5
X=+5
依据:化合物中各元素化合价代数和为0
注意:原子团一个整体带一定单位的电荷,原子团里每种元素的化合价代数和为离子所带电荷数!
例:硫酸根离子(SO42- )的化合价为负二价,求其中硫元素的化合价。
解:设SO42- 中S的化合价为X。
X+(-2)×4=-2
答:硫酸根离子中碳元素的化合价为+4价。
X=+6
2、已知在H3RO4中,氢元素为+1价,氧为-2价,则其中R的化合价为( ) A +3 B +4 C +5 D +6
3、下列化合物中,氮元素为+5价的是( )
A NO B NO2 C NH3 D KNO3
C
D
+5 +6 +7 +4 +5 +5 +6 +5
-3 +7 +1
4、元素R的氧化物的化学式为R2O3,则R元素与OH-组 成的物质的化学式为( )
A ROH B R(OH)2 C R(OH)3 D R(OH)4
C
1、求下列物质中元素的化合价
P2O5 K2MnO4 KMnO4 MnO2 KClO3 NO3- SO42- PO43-
NH4+ HClO4 HClO
1.相对分子质量(Mr)的计算
例2.计算 NH4NO3 的相对分子质量
解:Mr(NH4NO3 )
= 14×2+1×4+16×3
= 80
五、化学式的计算
相对分子质量:化学式中各原子的相对原子质量总和。
注意:相对分子质量也是比值,单位为1!!!
例1.计算水的相对分子质量
解:Mr(H2O)
= 1×2+16×1
= 18
例3.计算硫酸铝 Al2(SO4)3 的相对分子质量
解:Mr[Al2(SO4)3 ]
= 27×2+(32×1+16×4)×3
= 342
例5.计算CuSO4·5H2O的相对分子质量
例4.计算5H2O的相对分子质量
解:Mr[5H2O]
= 5×(1×2+16×1)
= 90
=64×1+32×1+16×4 + 5×(1×2+16×1)
解:Mr[CuSO4·5H2O]
=250
例6.计算KAl(SO4)2·5H2O的相对分子质量
=39+27+(32+16×4) ×2 + 12×(1×2+16)
解:Mr[KAl(SO4)·12H2O]
=474
2.化学式中各元素质量比
例2.计算Fe2O3中铁、氧元素两种元素的质量比
=56×2:16×3
= 7 : 3
解:
铁元素的质量:氧元素的质量
mFe : mO
注意:一定不要漏掉原子的个数!!!
a元素原子的相对原子质量×a原子的个数:
b元素原子的相对原子质量×b原子的个数(最简比)
例1.计算H2O中氢、氧元素两种元素的质量比
解:mH : mO
=1×2 : 16×1
= 1 : 8
练习
1.硝酸铵(NH4NO3)中各元素的质量比
2.硫酸铵 (NH4)2SO4中各元素的质量比
3.五水硫酸铜(CuSO4.5H2O)中硫元素与氧元素的质量比
相对原子质量:H-1、O-16、N-14 、S-32、Cu-64
解:mN:mH:mo = 14×2 :1×4 :16×3 = 7 :1 :12
解:mN:mH:ms:mo =7 : 2 :8: 16
解:ms:mo =32×1 : 16×9 = 2 : 9
3.化合物中某元素的质量分数
质量分数:元素的质量与化合物相对分子质量之比
某元素的质量分数=
该元素的相对原子质量×该原子的个数
化合物的相对分子质量
×100%
例1.求水(H2O)中氢元素的质量分数?
解:H%=
×100%≈11.1%
1×2+16×1
1 × 2
答:水中氢元素的质量分数约为11.1%。
注意:计算过程中除不尽时保留一位小数!
例2.计算硝酸铵NH4NO3中氮元素质量分数
硝酸铵中氮元素的质量分数
=
14 × 2
14×2+1×4+16×3
×100%
=35%
答:硝酸铵中氮元素的质量分数为35%。
氮原子个数×氮元素相对原子质量
硝酸铵相对分子质量
×100%
=
N%
解:
1.求CaCO3中氧元素的质量分数?
??
2. 求CO(NH2)2中氮元素的质量分数?
?
相对原子质量:H-1、C-12、N-14、O-16、Ca-40
=48%?
≈46.7%
=
16 × 3
14×2+1×4+16×3
×100%
O%
=
14 × 2
12×1+16×1+14×2+1×4
×100%
N%
4.求化合物中某元素的质量
例2.80g硝酸铵中含氮元素多少克?
= 80g ×
2×14
80
×100%
= 28g
解:80g硝酸铵中含氮元素的质量
某元素的质量 = 化合物总质量×该元素的质量分数
例1.18g水(H2O )中含多少克氢元素?
18g×
×100%
1×2+16×1
1 × 2
解:氢元素的质量=
=2g
5.求化合物的质量
例2.计算多少克二氧化硫中含硫元素32g?
解:设质量为 x 的二氧化硫中含硫元素32克
X ×
32
64
×100%
=32g
X = 64g
化合物的质量=
某元素的质量
÷
某元素的质量分数
例1.多少克水中含有20克氢元素?
=20g
x=180g
1×2
×100%
X ×
1×2+16×1
解:(1)
(2)
20g
1×2
×100%
1×2+16×1
=180g
纯净物的质量
混合物的质量
×100%
=
混合物中某物质的质量分数(纯度)
例2.鸡蛋壳中碳酸钙的纯度为75%,求5g鸡蛋壳中碳酸钙
的质量?
=3.75g
解:5g×75%
例1.20g加碘食盐中氯化钠的质量是19g,氯化钠的纯度?
解:
=95%
19g
×100%
20g
6.不纯物质的计算
练1.计算100g含碳酸钙90%的石灰石中含钙元素的质量
解:含钙元素的质量
=
100g ×90%
×
40
40+12+16×3
×100%
= 90g ×
40%
= 36g
答:100g含碳酸钙90%的石灰石中含钙元素36g。
练2.90克含硝酸铵80%的化肥中含氮元素的质量为多少?
=
90g ×80% ×
×100%
2×14
80
= 25.2g
答:
90克含硝酸铵80%的化肥中含氮元素25.2克。
解:氮元素的质量
X
·
14×2
12×1+16×1+14×2+1×2
×100%
练3.多少克尿素[CO(NH2)2]与80g硝酸铵(NH4NO3)中所含氮元素的质量相等?
解:设X尿素与80g硝酸铵中所含氮元素的质量相等
80g
×
14×2
14×2+1×4+16×3
×100%
=
X= 60g
答:60g尿素与80g硝酸铵中所含氮元素的质量相等。
X×尿素中N% = 80g×硝酸铵中N%
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
