3.3常见的盐——复分解反应 同步课件
文档属性
| 名称 | 3.3常见的盐——复分解反应 同步课件 |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-10-22 15:27:55 | ||
图片预览











文档简介
(共47张PPT)
复分解反应
华师大版 九年级上
新知导入
(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
分析:这些化学反应有什么规律?
属于什么反应类型?
新知讲解
复分解反应
复分解反应的概念:两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
表达式:AB+CD → AD+CB
特 点:双交换,价不变。
新知讲解
复分解反应实质
拓展:复分解反应的实质是什么?
HCl+ NaOH = H2O + NaCl
实质:H++OH- = H2O
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
实质:2H++CO32- = CO2↑+H2O
Na2CO3+Ca(OH)2 = 2NaCl+CaCO3↓
实质:Ca2++CO32- = CaCO3↓
复分解反应的实质是离子反应。反应物中这些离子结合生成气体或沉淀或水。
新知讲解
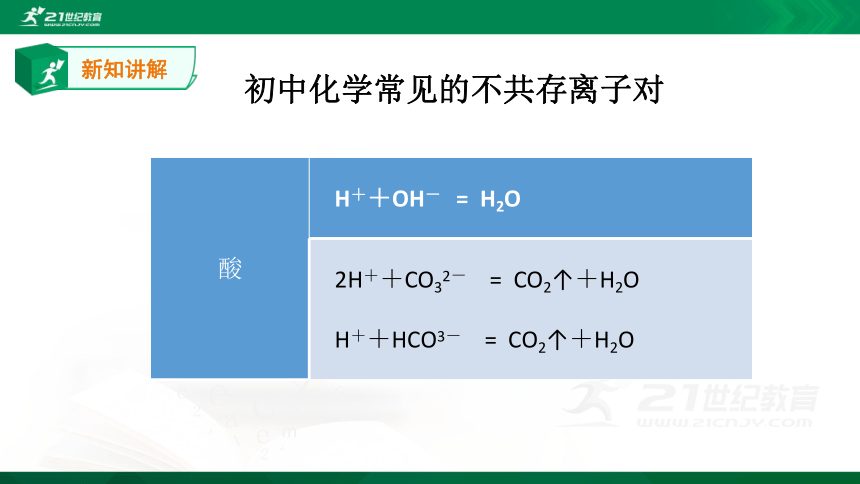
初中化学常见的不共存离子对
酸 H++OH- = H2O
2H++CO32- = CO2↑+H2O
H++HCO3- = CO2↑+H2O
新知讲解
初中化学常见的不共存离子对
碱溶钾、钠、铵(易分解)、钡、钙(微溶)
碱 OH-+NH4+= NH3↑+H2O
2 OH-+Mg2+ = Mg(OH)2↓(白色)
2 OH-+Cu2+ = Cu(OH)2↓(蓝色)
3 OH-+Fe3+ = Fe(OH)3↓(红褐色)
新知讲解
初中化学常见的不共存离子对
碱溶钾、钠、铵(易分解)、钡、钙(微溶)
碱 OH-+NH4+= NH3↑+H2O
2 OH-+Mg2+ = Mg(OH)2↓(白色)
2 OH-+Cu2+ = Cu(OH)2↓(蓝色)
3 OH-+Fe3+ = Fe(OH)3↓(红褐色)
课堂讲解
钾、钠、铵、硝皆可溶。
盐酸盐里银不溶。
硫酸盐里钡不溶。
碳酸盐溶钾、钠、铵
盐
Ag++Cl- = AgCl↓(白色)
Ba2++SO42- = BaSO4↓(白色)
Ba2++CO32- = BaCO3↓(白色)
Ca2++CO32- = CaCO3↓(白色)
课堂练习
一、判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
2HNO3 + K2CO3——
KNO3 + NaOH——
拓展提高
复分解的应用:离子共存
离子共存问题:即同一溶液中如离子之间符合下列三个条件之一就会发生离子反应,离子之间便不能在溶液中共存。
(1) 生成难溶物或微溶物:如SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与 CO32-、SO32-、PO43-等不能大量共存
(2) 生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO32-等不能大量共存。
(3) 生成水:OH-与H+不能大量共存
课堂练习
课堂练习
拓展提高
复分解的应用:物质鉴别
(一)物理方法: “看、闻、摸、溶、吸”等方式进行鉴别。 “看”就是要看物质的颜色、状态、形状等,如:大理石是块状固体、氢氧化钠是片状固体、氢氧化钙是粉末状固体,氢气和氧气是气体、酒精有是液体;硫酸铜溶液是蓝色的、氯化铁溶液是棕黄色的、其它常见的物质只要不含 Cu2+、 Fe3+和MnO4-的化合物的水溶液一般都是无色的。
“闻”可以闻某些气体的气味
“摸”可以通过摸容器的外壁,感觉是否有热量的改变
“溶”看物质是否能溶解
“吸”看是否能被磁铁吸引。
实验室鉴别切不能用“尝”!
拓展提高
复分解的应用:物质鉴别
(二)化学方法:
1、含“H + ”的化合物(如 HCl、H2SO4)的鉴别方法。
(1)用紫色的石蕊试液。酸溶液都能使紫色的石蕊试液变成红色,如硫酸溶液能使紫色的石蕊试液变成红 色。
(2)用 PH 试纸。酸(含 H+的化合物)溶液的 PH<7,如:醋酸溶液的 PH<7。
(3)用镁、铝、锌、铁等活泼金属。这些金属与酸反应的现象有气泡生成。如 Mg+H2SO 4 ==MgSO4 +H2↑
(4)用含有“CO 3 2- ”的物质,如:碳酸钠与盐酸反应产生无色的气体,该气体能使澄清的石灰水变浑浊。
拓展提高
复分解的应用:物质鉴别
2、含“OH - ”的化合物(如 NaOH、Ca(OH) 2)的鉴别方法。
(1)用紫色的石蕊试液或者无色的酚酞试液。观察到的现象是:含 OH-的化合物才能使紫色的石蕊试液变 成蓝色,能使无色的酚酞试液变成红色。
(2)用 PH 试纸。含 OH - 的化合物的水溶液的 PH>7
(3)用含有 Cu 2+ 等离子的盐溶液,会产生不同颜色的沉淀。
拓展提高
复分解的应用:物质鉴别
3、含“CO3 2- ”的化合物(如 Na2CO3 )的鉴别方法。
最常用的方法是稀盐酸和澄清的石灰水,看到的现象 是:加入稀盐酸后有无色气体产生,该气体能使澄清的石灰水变浑浊。
4、含有“Cl- ”的化合物(NaCl 等)的鉴别方法。鉴别含“Cl -”的化合物依据的原理是:它与含“Ag + ”的 化合物结合成 AgCl,它是一种不溶于水也不溶于酸的沉淀。
5、含“SO4 2- ”的化合物(如 Na2SO4)有鉴别方法。鉴别这类化合物的原理是:SO4 2- 离子与 Ba2+ 离子结合成不溶于水也不溶于酸的白色沉淀。
拓展提高
复分解的应用:分离、除杂
1. 分离与提纯的基本原理
(1)分离:就是用物理或化学的方法将混合物巾的各组分分开,并将物质恢复到原状态。
(2)提纯和除杂:用物理或化学的方法把混合物中的杂质除去而得到纯物质。 在提纯过程中,如果杂质发生了化学变化,不必恢复成原物质。
拓展提高
复分解的应用:分离、除杂
2.分离和提纯应遵循的原则
(1)不能“玉石俱焚”:即试剂一般要求与杂质反应,不与要保留的物质反应。但在特殊情况下,所加试剂 可和保留物质反应,但最终要转化成需要保留的物质。
如除去 FeCl 3 ,溶液中的 NaCl,
可加过量的 NaOH 溶液→过滤→洗涤→加适量稀盐酸。
拓展提高
复分解的应用:分离、除杂
(2)“不增““不减”:即不增加新的杂质,不减少要保留的物质 如除去 FeCl 3 中的少量 Fe 2 (SO4) 3 应选用 BaCl 2 而不应选用 Ba(NO 3 ) 2
(3)易分离:反应后,物质的状态不同,便于分离。
(4)不污染环境:即耍求所选用的除杂方法不能产生可污染环境的物质。
(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。
拓展提高
复分解的应用:推断
物质的推断就是运用物质的特殊性质和特征反应.根据实验现象得出正确的结论。同一推断题可能存在多个突破点,可以从不同角度或不同种方法寻找解题突破口,同叫检验推断结果,保证答案的准确性。
推断题题型具备考查知识面广、综合性强、题型多变、思维容量大等特点。要解好此类题口,要求大家要有扎实的元素化合物的基础知识和实验技能,还必须具备科学、严密的思维方法和良好的分析问题、解决问题的能力。
复分解反应类型
有酸可不溶,无酸必须溶解
1、碱性氧化物+酸→盐+H2O
2、碱+酸→盐+H2O
3、酸+盐→新盐+新酸
4、盐 1+盐 2→新盐 1+新盐 2 (反应物需都可溶)
5、盐+碱→新盐+新碱(反应物需都可溶)
课堂总结
板书设计
表达式 :AB+CD=AD+CB
概念 :两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
特点 :双交换、价不变
条件:反应产生沉淀或气体或水。
实质:离子反应
复分解反应
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
复分解反应
华师大版 九年级上
新知导入
(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
分析:这些化学反应有什么规律?
属于什么反应类型?
新知讲解
复分解反应
复分解反应的概念:两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
表达式:AB+CD → AD+CB
特 点:双交换,价不变。
新知讲解
复分解反应实质
拓展:复分解反应的实质是什么?
HCl+ NaOH = H2O + NaCl
实质:H++OH- = H2O
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
实质:2H++CO32- = CO2↑+H2O
Na2CO3+Ca(OH)2 = 2NaCl+CaCO3↓
实质:Ca2++CO32- = CaCO3↓
复分解反应的实质是离子反应。反应物中这些离子结合生成气体或沉淀或水。
新知讲解
初中化学常见的不共存离子对
酸 H++OH- = H2O
2H++CO32- = CO2↑+H2O
H++HCO3- = CO2↑+H2O
新知讲解
初中化学常见的不共存离子对
碱溶钾、钠、铵(易分解)、钡、钙(微溶)
碱 OH-+NH4+= NH3↑+H2O
2 OH-+Mg2+ = Mg(OH)2↓(白色)
2 OH-+Cu2+ = Cu(OH)2↓(蓝色)
3 OH-+Fe3+ = Fe(OH)3↓(红褐色)
新知讲解
初中化学常见的不共存离子对
碱溶钾、钠、铵(易分解)、钡、钙(微溶)
碱 OH-+NH4+= NH3↑+H2O
2 OH-+Mg2+ = Mg(OH)2↓(白色)
2 OH-+Cu2+ = Cu(OH)2↓(蓝色)
3 OH-+Fe3+ = Fe(OH)3↓(红褐色)
课堂讲解
钾、钠、铵、硝皆可溶。
盐酸盐里银不溶。
硫酸盐里钡不溶。
碳酸盐溶钾、钠、铵
盐
Ag++Cl- = AgCl↓(白色)
Ba2++SO42- = BaSO4↓(白色)
Ba2++CO32- = BaCO3↓(白色)
Ca2++CO32- = CaCO3↓(白色)
课堂练习
一、判断下列复分解反应能否发生:
H2SO4 + NaNO3——
Na2SO4 + BaCl2——
2HNO3 + K2CO3——
KNO3 + NaOH——
拓展提高
复分解的应用:离子共存
离子共存问题:即同一溶液中如离子之间符合下列三个条件之一就会发生离子反应,离子之间便不能在溶液中共存。
(1) 生成难溶物或微溶物:如SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-、S2-;Mg2+、Ba2+、Ca2+与 CO32-、SO32-、PO43-等不能大量共存
(2) 生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO32-等不能大量共存。
(3) 生成水:OH-与H+不能大量共存
课堂练习
课堂练习
拓展提高
复分解的应用:物质鉴别
(一)物理方法: “看、闻、摸、溶、吸”等方式进行鉴别。 “看”就是要看物质的颜色、状态、形状等,如:大理石是块状固体、氢氧化钠是片状固体、氢氧化钙是粉末状固体,氢气和氧气是气体、酒精有是液体;硫酸铜溶液是蓝色的、氯化铁溶液是棕黄色的、其它常见的物质只要不含 Cu2+、 Fe3+和MnO4-的化合物的水溶液一般都是无色的。
“闻”可以闻某些气体的气味
“摸”可以通过摸容器的外壁,感觉是否有热量的改变
“溶”看物质是否能溶解
“吸”看是否能被磁铁吸引。
实验室鉴别切不能用“尝”!
拓展提高
复分解的应用:物质鉴别
(二)化学方法:
1、含“H + ”的化合物(如 HCl、H2SO4)的鉴别方法。
(1)用紫色的石蕊试液。酸溶液都能使紫色的石蕊试液变成红色,如硫酸溶液能使紫色的石蕊试液变成红 色。
(2)用 PH 试纸。酸(含 H+的化合物)溶液的 PH<7,如:醋酸溶液的 PH<7。
(3)用镁、铝、锌、铁等活泼金属。这些金属与酸反应的现象有气泡生成。如 Mg+H2SO 4 ==MgSO4 +H2↑
(4)用含有“CO 3 2- ”的物质,如:碳酸钠与盐酸反应产生无色的气体,该气体能使澄清的石灰水变浑浊。
拓展提高
复分解的应用:物质鉴别
2、含“OH - ”的化合物(如 NaOH、Ca(OH) 2)的鉴别方法。
(1)用紫色的石蕊试液或者无色的酚酞试液。观察到的现象是:含 OH-的化合物才能使紫色的石蕊试液变 成蓝色,能使无色的酚酞试液变成红色。
(2)用 PH 试纸。含 OH - 的化合物的水溶液的 PH>7
(3)用含有 Cu 2+ 等离子的盐溶液,会产生不同颜色的沉淀。
拓展提高
复分解的应用:物质鉴别
3、含“CO3 2- ”的化合物(如 Na2CO3 )的鉴别方法。
最常用的方法是稀盐酸和澄清的石灰水,看到的现象 是:加入稀盐酸后有无色气体产生,该气体能使澄清的石灰水变浑浊。
4、含有“Cl- ”的化合物(NaCl 等)的鉴别方法。鉴别含“Cl -”的化合物依据的原理是:它与含“Ag + ”的 化合物结合成 AgCl,它是一种不溶于水也不溶于酸的沉淀。
5、含“SO4 2- ”的化合物(如 Na2SO4)有鉴别方法。鉴别这类化合物的原理是:SO4 2- 离子与 Ba2+ 离子结合成不溶于水也不溶于酸的白色沉淀。
拓展提高
复分解的应用:分离、除杂
1. 分离与提纯的基本原理
(1)分离:就是用物理或化学的方法将混合物巾的各组分分开,并将物质恢复到原状态。
(2)提纯和除杂:用物理或化学的方法把混合物中的杂质除去而得到纯物质。 在提纯过程中,如果杂质发生了化学变化,不必恢复成原物质。
拓展提高
复分解的应用:分离、除杂
2.分离和提纯应遵循的原则
(1)不能“玉石俱焚”:即试剂一般要求与杂质反应,不与要保留的物质反应。但在特殊情况下,所加试剂 可和保留物质反应,但最终要转化成需要保留的物质。
如除去 FeCl 3 ,溶液中的 NaCl,
可加过量的 NaOH 溶液→过滤→洗涤→加适量稀盐酸。
拓展提高
复分解的应用:分离、除杂
(2)“不增““不减”:即不增加新的杂质,不减少要保留的物质 如除去 FeCl 3 中的少量 Fe 2 (SO4) 3 应选用 BaCl 2 而不应选用 Ba(NO 3 ) 2
(3)易分离:反应后,物质的状态不同,便于分离。
(4)不污染环境:即耍求所选用的除杂方法不能产生可污染环境的物质。
(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。
拓展提高
复分解的应用:推断
物质的推断就是运用物质的特殊性质和特征反应.根据实验现象得出正确的结论。同一推断题可能存在多个突破点,可以从不同角度或不同种方法寻找解题突破口,同叫检验推断结果,保证答案的准确性。
推断题题型具备考查知识面广、综合性强、题型多变、思维容量大等特点。要解好此类题口,要求大家要有扎实的元素化合物的基础知识和实验技能,还必须具备科学、严密的思维方法和良好的分析问题、解决问题的能力。
复分解反应类型
有酸可不溶,无酸必须溶解
1、碱性氧化物+酸→盐+H2O
2、碱+酸→盐+H2O
3、酸+盐→新盐+新酸
4、盐 1+盐 2→新盐 1+新盐 2 (反应物需都可溶)
5、盐+碱→新盐+新碱(反应物需都可溶)
课堂总结
板书设计
表达式 :AB+CD=AD+CB
概念 :两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
特点 :双交换、价不变
条件:反应产生沉淀或气体或水。
实质:离子反应
复分解反应
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
