高二年级上册选修四:原电池
图片预览




文档简介
课件27张PPT。第四章 第一节
原电池
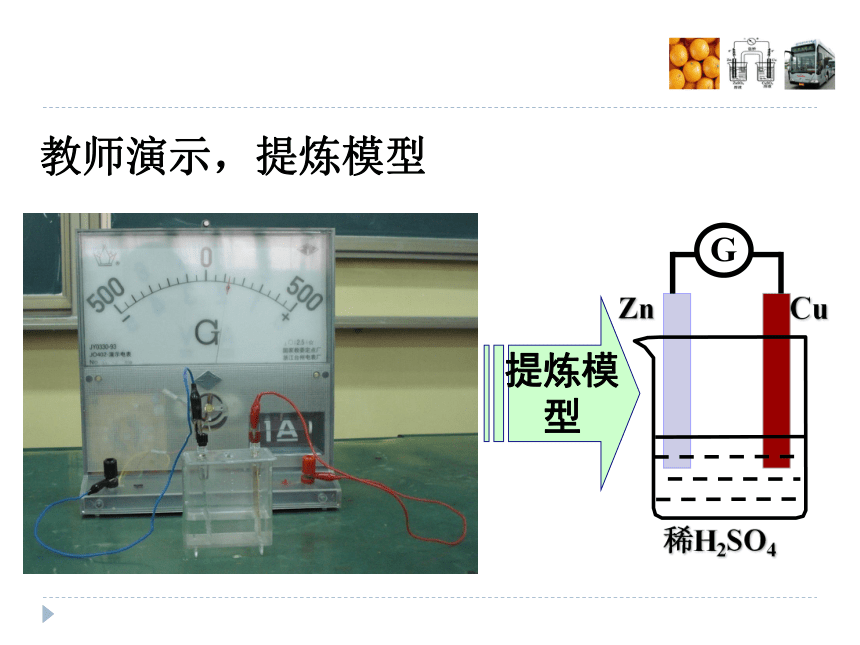
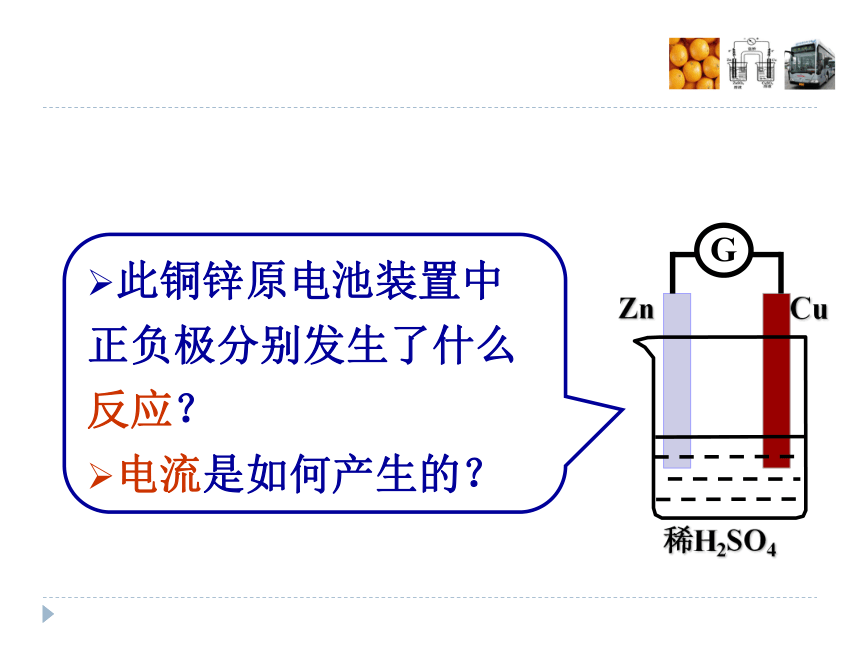
电池化学能→电能教师演示,提炼模型提炼模型此铜锌原电池装置中正负极分别发生了什么反应?
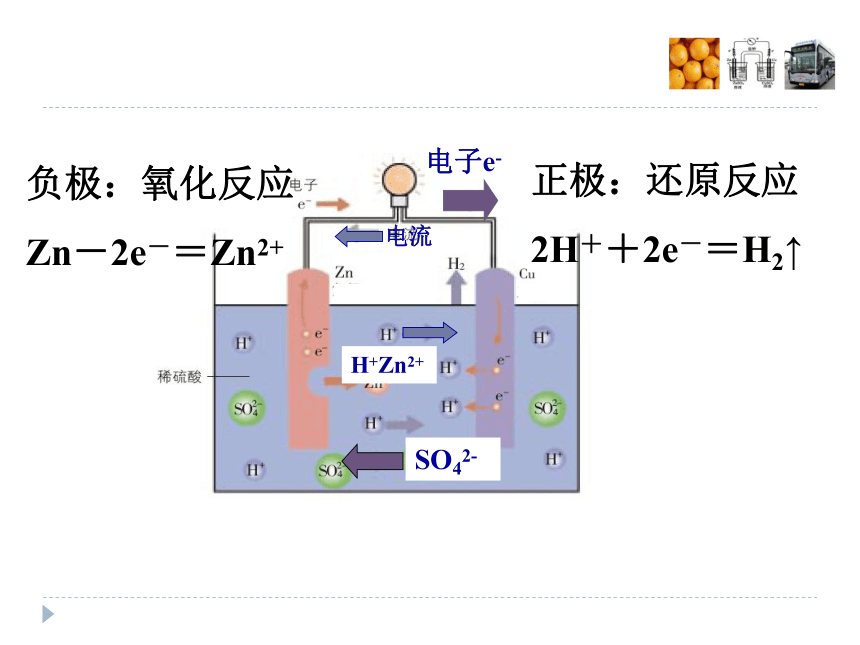
电流是如何产生的?正极:还原反应
2H++2e-=H2↑负极:氧化反应
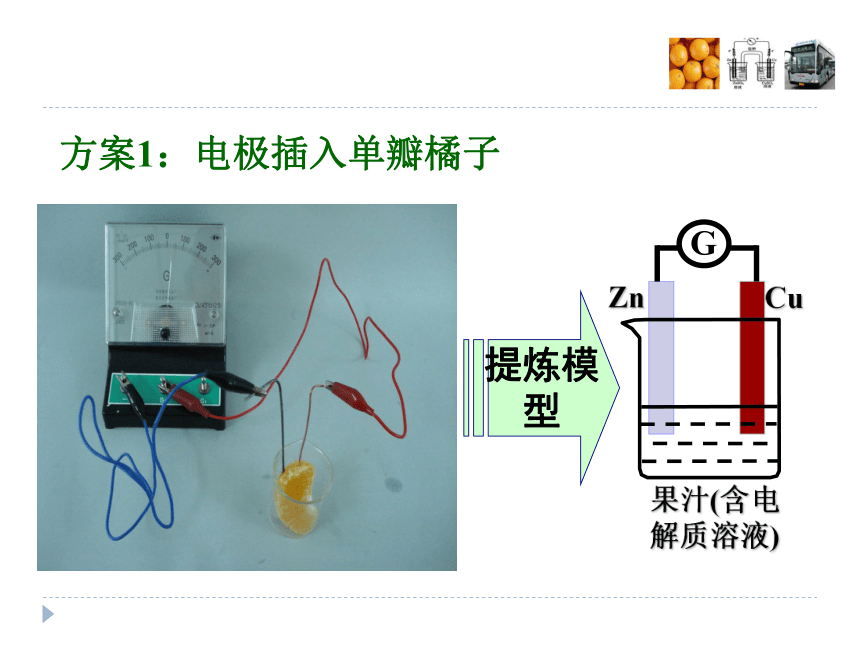
Zn-2e-=Zn2+电子e-SO42-电流H+Zn2+ 以上单液电池因氧化剂与还原剂直接接触(会发生非原电池反应),放电时间短,转化为电能的效率不高,如何提高效率呢?下面我们做专门探究。 橘子实验提炼模型仪器和药品:灵敏电流计、铜片、锌片、导线、培养皿、橘子
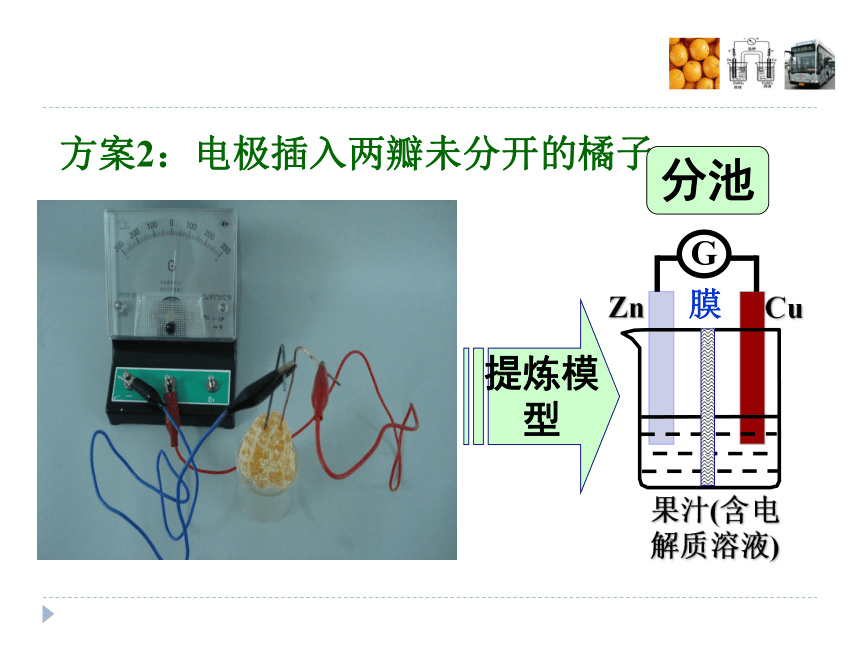
注意:铜片、锌片较尖锐,使用时小心。请利用所给材料设计橘子电池,观察实验现象并提炼出原电池模型。学生小组实验:设计橘子电池方案1:电极插入单瓣橘子提炼模型方案2:电极插入两瓣未分开的橘子提炼模型分池方案2:电极插入两瓣未分开的橘子为何两瓣未分开的橘子也能产生电流?强调“膜”的功能:分区但又允许离子通过。方案3:电极插入两瓣分开的橘子两瓣分开的橘子不能产生电流,如何改进才能产生电流?方案3:两瓣分开的橘子——改进产生电流2.两瓣接触3.“连隧道”4.“搭桥”1.加NaCl溶液方案3:两瓣分开的橘子——改进产生电流3.“连隧道”4.“搭桥”这两种方法为何能产生电流?请提炼模型?建立盐桥模型介绍盐桥盐桥中通常装有含琼胶的KCl饱和溶液单池分池膜分池盐桥分析盐桥模型的工作原理此装置中正负极分别发生了什么反应?
电流是如何产生的?理论分析果汁(含电解质溶液)ZnCuG正极:还原反应
(得电子)负极:氧化反应
(失电子)电子e-Yn-电流H+根据反应Zn+CuSO4=ZnSO4+Cu设计原电池,说说你的设计思路。思考交流,根据反应设计电池。氧化还原反应拆分成电极反应根据电极反应选择电极和电解质溶液仪器和药品:灵敏电流计、铜片、锌片、导线、培养皿、ZnSO4溶液、NaCl溶液、CuSO4溶液、浸有NaCl溶液的滤纸条(盐桥)。
注意:及时清洗电极。按图中装置及所给材料,根据Zn+CuSO4=ZnSO4+Cu设计原电池并实验。学生探究实验:Zn-CuSO4电池可能设计的方案:Zn+CuSO4=ZnSO4+Cu对比分析各方案为何Zn表面变黑?分析异常现象认识能量损耗对比分析各方案此装置中为何能产生电流?结合模型,进行理论分析 CuSO4ZnCu提供电子的物质接受电子的物质负极:氧化反应
Zn-2e- =Zn2+正极:还原反应
Cu2++2e- = Cu负极液作用正极液作用电子e-Yn-电流H+三个模型 理论发展双
池
双
液双
池
单
液单
池
单
液提供电子的物质接受电子的物质阴离子负极:氧化反应
Zn-2e- =Zn2+正极:还原反应
Cu2++2e- = Cu导线中的电子导电负极液正极液盐桥或膜阳离子应用思维模型解决问题人类对电池的研究与发展:回顾历史发展创新伏打电堆1799年1836年1839年丹尼尔电池W.R.Grove提出氢氧燃料电池由电池发展史
你想到些什么?
原电池
电池化学能→电能教师演示,提炼模型提炼模型此铜锌原电池装置中正负极分别发生了什么反应?
电流是如何产生的?正极:还原反应
2H++2e-=H2↑负极:氧化反应
Zn-2e-=Zn2+电子e-SO42-电流H+Zn2+ 以上单液电池因氧化剂与还原剂直接接触(会发生非原电池反应),放电时间短,转化为电能的效率不高,如何提高效率呢?下面我们做专门探究。 橘子实验提炼模型仪器和药品:灵敏电流计、铜片、锌片、导线、培养皿、橘子
注意:铜片、锌片较尖锐,使用时小心。请利用所给材料设计橘子电池,观察实验现象并提炼出原电池模型。学生小组实验:设计橘子电池方案1:电极插入单瓣橘子提炼模型方案2:电极插入两瓣未分开的橘子提炼模型分池方案2:电极插入两瓣未分开的橘子为何两瓣未分开的橘子也能产生电流?强调“膜”的功能:分区但又允许离子通过。方案3:电极插入两瓣分开的橘子两瓣分开的橘子不能产生电流,如何改进才能产生电流?方案3:两瓣分开的橘子——改进产生电流2.两瓣接触3.“连隧道”4.“搭桥”1.加NaCl溶液方案3:两瓣分开的橘子——改进产生电流3.“连隧道”4.“搭桥”这两种方法为何能产生电流?请提炼模型?建立盐桥模型介绍盐桥盐桥中通常装有含琼胶的KCl饱和溶液单池分池膜分池盐桥分析盐桥模型的工作原理此装置中正负极分别发生了什么反应?
电流是如何产生的?理论分析果汁(含电解质溶液)ZnCuG正极:还原反应
(得电子)负极:氧化反应
(失电子)电子e-Yn-电流H+根据反应Zn+CuSO4=ZnSO4+Cu设计原电池,说说你的设计思路。思考交流,根据反应设计电池。氧化还原反应拆分成电极反应根据电极反应选择电极和电解质溶液仪器和药品:灵敏电流计、铜片、锌片、导线、培养皿、ZnSO4溶液、NaCl溶液、CuSO4溶液、浸有NaCl溶液的滤纸条(盐桥)。
注意:及时清洗电极。按图中装置及所给材料,根据Zn+CuSO4=ZnSO4+Cu设计原电池并实验。学生探究实验:Zn-CuSO4电池可能设计的方案:Zn+CuSO4=ZnSO4+Cu对比分析各方案为何Zn表面变黑?分析异常现象认识能量损耗对比分析各方案此装置中为何能产生电流?结合模型,进行理论分析 CuSO4ZnCu提供电子的物质接受电子的物质负极:氧化反应
Zn-2e- =Zn2+正极:还原反应
Cu2++2e- = Cu负极液作用正极液作用电子e-Yn-电流H+三个模型 理论发展双
池
双
液双
池
单
液单
池
单
液提供电子的物质接受电子的物质阴离子负极:氧化反应
Zn-2e- =Zn2+正极:还原反应
Cu2++2e- = Cu导线中的电子导电负极液正极液盐桥或膜阳离子应用思维模型解决问题人类对电池的研究与发展:回顾历史发展创新伏打电堆1799年1836年1839年丹尼尔电池W.R.Grove提出氢氧燃料电池由电池发展史
你想到些什么?
