第三单元 课题2 原子的结构(共63张PPT)
文档属性
| 名称 | 第三单元 课题2 原子的结构(共63张PPT) | 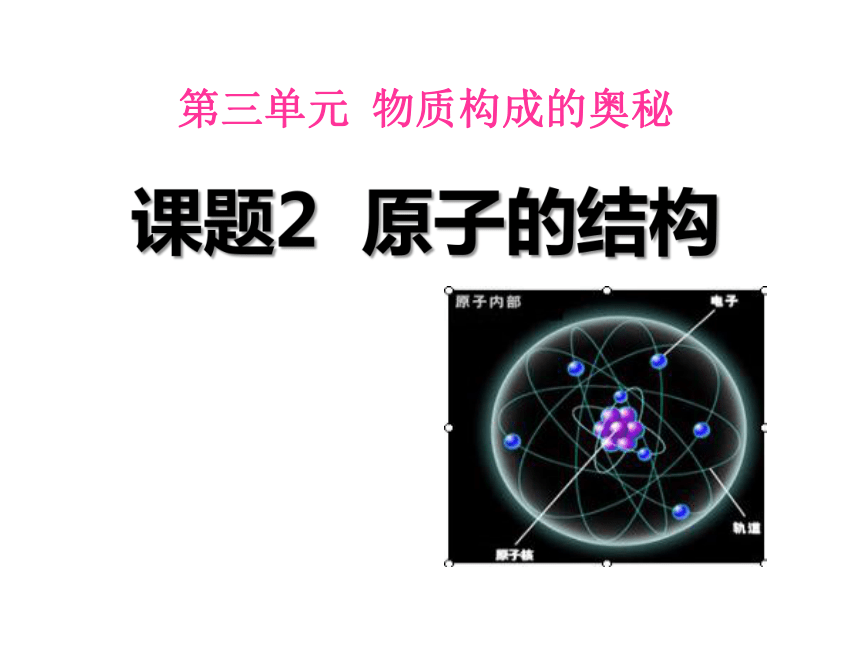 | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-30 09:09:49 | ||
图片预览




文档简介
课件63张PPT。第三单元 物质构成的奥秘课题2 原子的结构一、学习目的:
1.能说出构成原子的各种粒子及带电情况。(重点)
2.知道相对原子质量表示的意义,会查相对原子质量表。(难点)
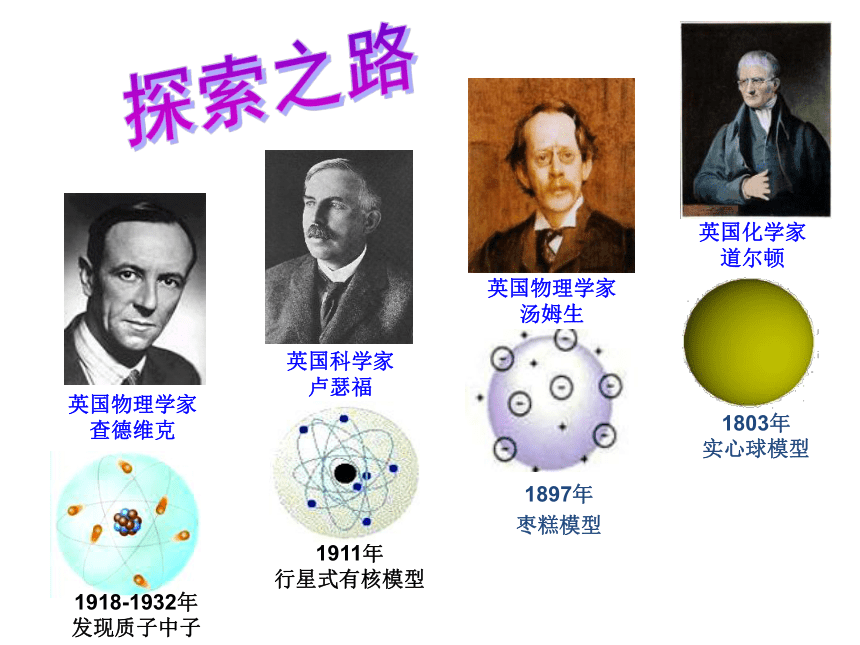
探索之路英国化学家
道尔顿英国物理学家
汤姆生英国科学家
卢瑟福英国物理学家 查德维克1803年 实心球模型1918-1932年 发现质子中子1897年 枣糕模型1911年
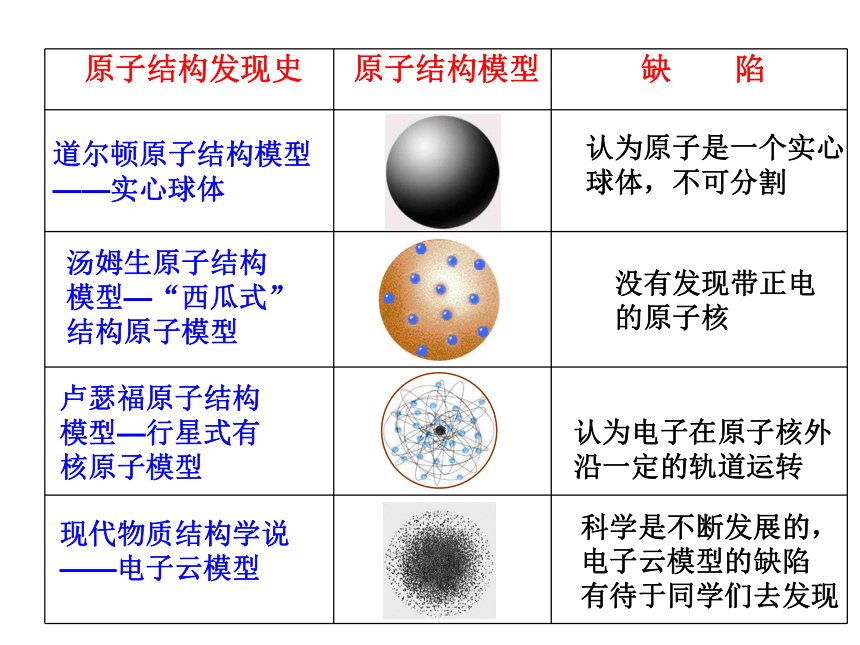
行星式有核模型 道尔顿原子结构模型
——实心球体认为原子是一个实心
球体,不可分割汤姆生原子结构
模型—“西瓜式”
结构原子模型没有发现带正电
的原子核卢瑟福原子结构
模型—行星式有
核原子模型现代物质结构学说
——电子云模型认为电子在原子核外
沿一定的轨道运转科学是不断发展的,
电子云模型的缺陷
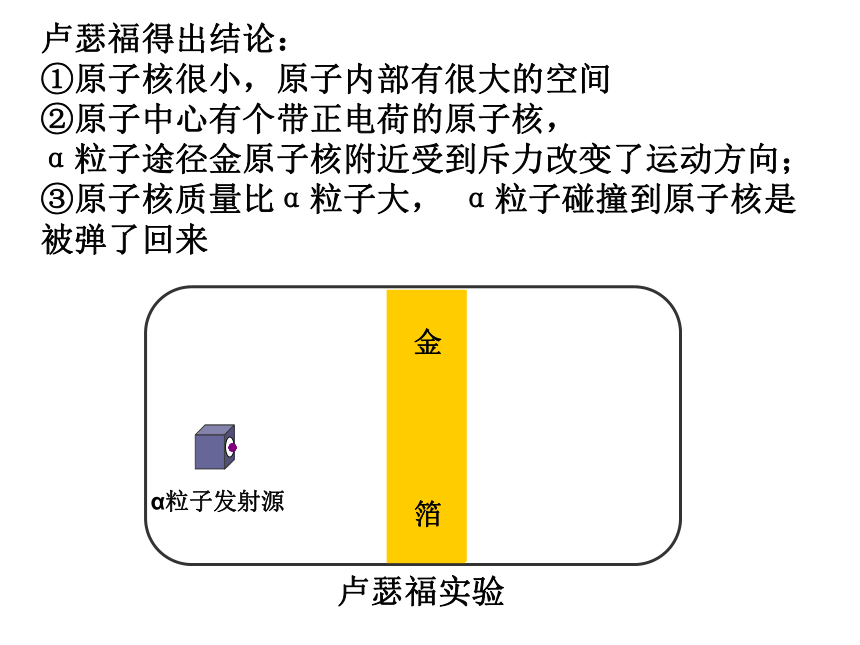
有待于同学们去发现1911年著名物理学家卢瑟福做了著名的卢瑟福实验,用一速带正电的质量比电子大很多的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔并不改变原来的方向,但也有一小部分改变了原来的方向,甚至有极少数α粒子被反弹了回来。卢瑟福得出结论:
①原子核很小,原子内部有很大的空间
②原子中心有个带正电荷的原子核,
α粒子途径金原子核附近受到斥力改变了运动方向;
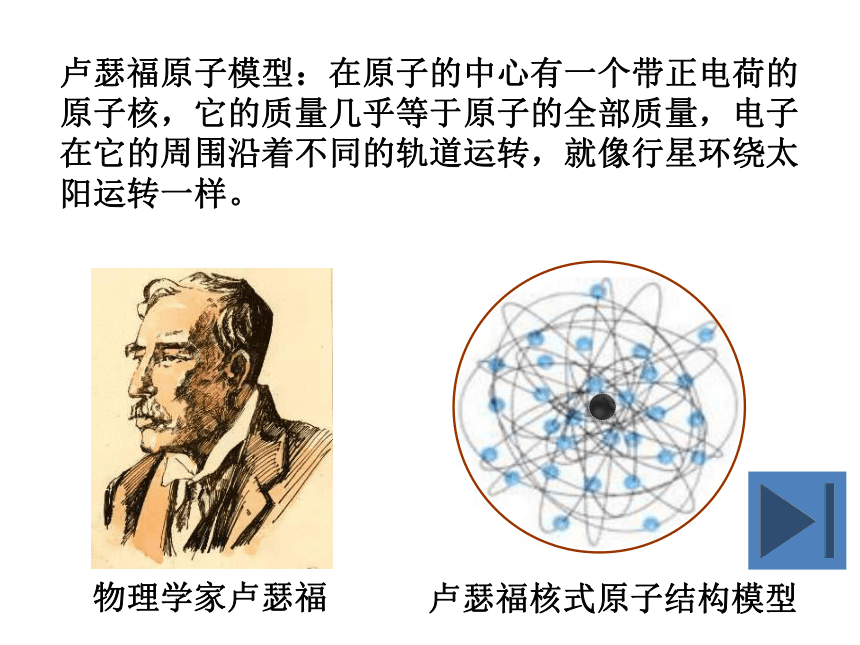
③原子核质量比α粒子大, α粒子碰撞到原子核是被弹了回来卢瑟福原子模型:在原子的中心有一个带正电荷的原子核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。 在过氧化氢分解制氧气的实验中,过氧化氢 破裂为氢 和氧 ,该反应的文字表达为: __。可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。
(提示:填“分子”或“原子”) 分子 原子 原子 再分 原子 原子 过氧化氢 水 + 氧气二氧化锰那原子还能再分吗?英国物理学家卢瑟福α粒子散射实验大部分α粒子在穿过金属箔片;
少数的α粒子方向明显发生大角度改变原子不是简单而不可分割的实心球体。原子的结构PPT模板:www.1ppt.com/moban/ PPT素材:www.1ppt.com/sucai/
PPT背景:www.1ppt.com/beijing/ PPT图表:www.1ppt.com/tubiao/
PPT下载:www.1ppt.com/xiazai/ PPT教程: www.1ppt.com/powerpoint/
资料下载:www.1ppt.com/ziliao/ 范文下载:www.1ppt.com/fanwen/
试卷下载:www.1ppt.com/shiti/ 教案下载:www.1ppt.com/jiaoan/
PPT论坛:www.1ppt.cn PPT课件:www.1ppt.com/kejian/
语文课件:www.1ppt.com/kejian/yuwen/ 数学课件:www.1ppt.com/kejian/shuxue/
英语课件:www.1ppt.com/kejian/yingyu/ 美术课件:www.1ppt.com/kejian/meishu/
科学课件:www.1ppt.com/kejian/kexue/ 物理课件:www.1ppt.com/kejian/wuli/
化学课件:www.1ppt.com/kejian/huaxue/ 生物课件:www.1ppt.com/kejian/shengwu/
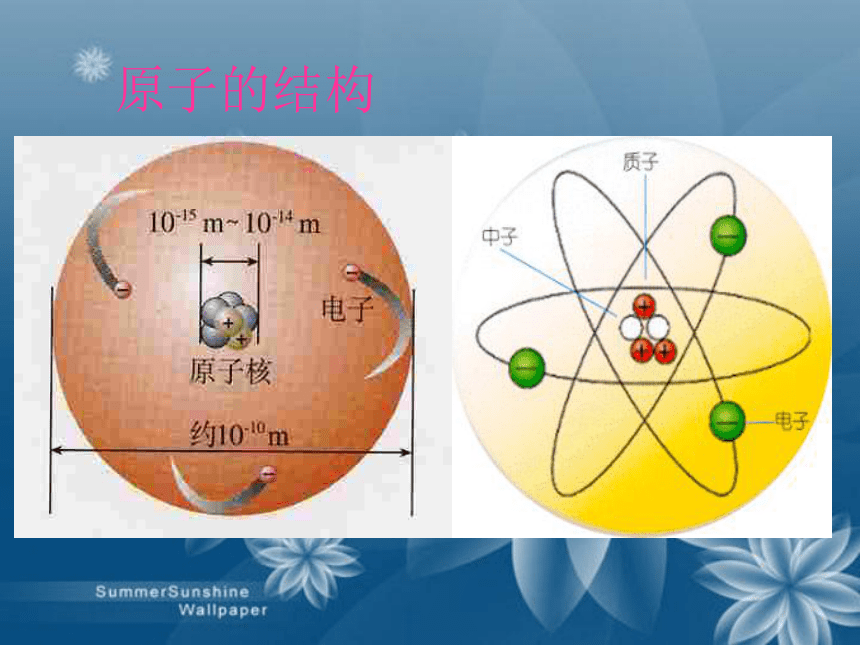
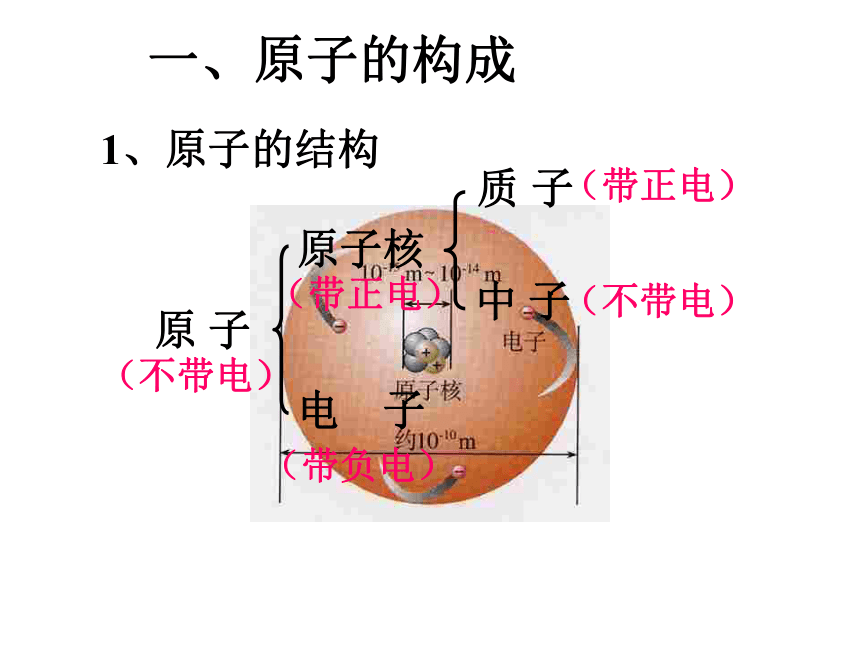
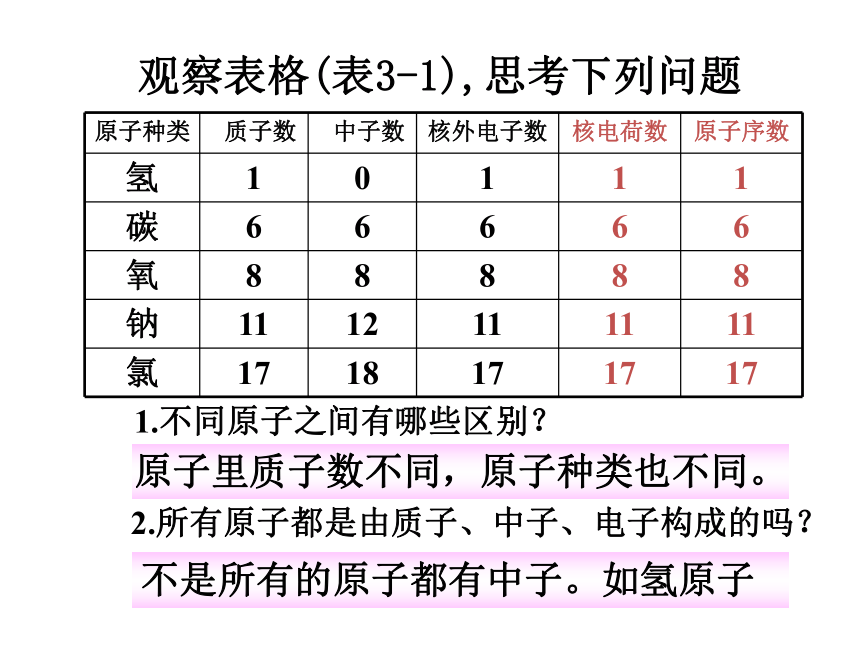
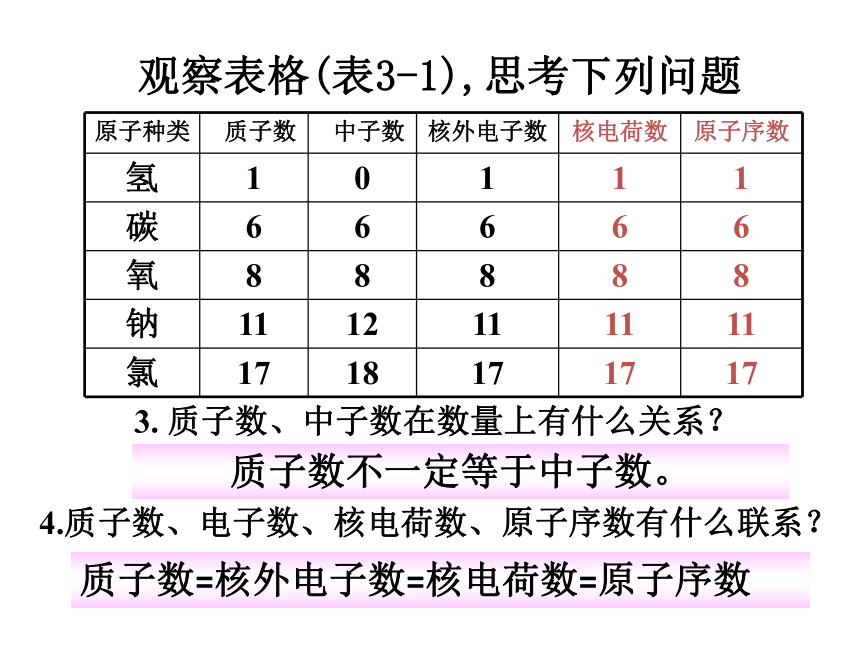
地理课件:www.1ppt.com/kejian/dili/ 历史课件:www.1ppt.com/kejian/lishi/ 一、原子的构成原 子(带正电)(不带电) (带负电) (带正电)(不带电) 1、原子的结构观察表格(表3-1),思考下列问题1.不同原子之间有哪些区别?2.所有原子都是由质子、中子、电子构成的吗?原子里质子数不同,原子种类也不同。不是所有的原子都有中子。如氢原子观察表格(表3-1),思考下列问题3. 质子数、中子数在数量上有什么关系?4.质子数、电子数、核电荷数、原子序数有什么联系?质子数不一定等于中子数。质子数=核外电子数=核电荷数=原子序数1.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。 2.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有 、 、 。 3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子, 161个中子,则该元素核外电子数是_____ 。正电负电质子中子相等相反不显分子原子质子和原子核中子111原子分子你知道吗? 原子核的半径为原子半径
的十万分之一原子核的体积为原子体积
的千亿分之一 所以在原子核外有很大的空间,电子就在这广阔的空间里高速运动。核外电子是怎样运动的? 观看原子的核外电子运动的模拟动画。氢原子的结构
(1个电子)行星绕太阳运功二 电子在原子核外一定区域内出现,这些区域叫作叫做“电子层”,核外电子是在不同的电子层内运动的,此现象叫做核外电子的分层排布。二 原子核外电子的排布1、核外电子是分层排布的电子层 一 二 三 四 五 六 七K L M N O P Q离核远近:近远能量高低:低高(2)第一层最多排2个,第二层最多排8个;(3)最外层最多排8个电子
(只有一个电子层时最多 2个电子);(1)先 “里”后“外” .(能量最低原则)2.核外电子分层排布的规律(仅限前3层)(4)每个电子层最多容纳2n2个电子 (n代表电子层数).111822610228212833287217请你动手试一试:第一层(2个)第二层(8个)第三层(1个)
(最外层)钠原子的结构
(11个电子)11+原子核电荷种类质子数电子层128第二层第一层第三层最外层该层的电子数目钠原子结构示意图次外层3.原子结构示意图
画法:画圆圈,标核电,
弧线呈扇面,数字一条线。 Na3.原子结构示意图
例如:O和P的原子结构示意图:OP第一层(2个)第二层(6个)
(最外层)【亲手尝试】根据氧原子的结构图画出结构示意图 请按以下排列格式画出1~18号元素的原子结构示意图:
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar比一比,看一看你画对了吗? P54 3-12C氢 H 氦He锂 Li 铍 Be 硼 B 碳 C 氮N 氧O 氟 F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P 硫 S 氯Cl 氩Ar金属元素非金属元素稀有气体元素 这三大类元素的原子最外层电子数有什么规律?一般<4易失去电子一般>4易得到电子 容易发生化学反应等于8
(氦等于2)稳定结构 难发生化学反应金属元素非金属元素稀有气体元素稳定不稳定不稳定4.元素的性质与原子最外层电子数的关系【结论】元素的化学性质与原子核外电子的排布,特别是最外层电子数有密切关系。 ⑴在同一周期中,从左到右,原子的电子层数相同(核外电子层数等于周期数),最外层电子数依次增大。
⑵在同一族中,最外层电子数相同但电子层数从上到下依次递增。
⑶同族元素原子的最外层电子数相同,具有相似的化学性质。1、“嫦蛾一号”的任务之一是探测月球上的氦-3资源,He-3的原子结构示意图为 ,图中x为( )。
A.1 B. 2 C. 3 D. 4B2、下列原子结构示意图所表示的元素,化学性质最稳定的是( )。
ABCDA4. 下列具有相似化学性质的元素组别是( )。 3.这是磷原子的结构示意图 ,该原子的核电荷数是__,共有__个电子层,第二电子层上有__个电子,最外层上的电子数是__。15385CD 5.已知碘元素(I)原子结构示意图为 ,请回答下列问题:
⑴ x 的值为__;
⑵(多选)一般情况下,元素原子最外层电子数相同,具有相似化学性质.碘元素的化学性质与下列元素的化学性质最相似的是( ).
A.B.C.D.53AB 我们学习了原子的结构及原子结构示意图的画法,要熟练掌握1~18号元素的原子结构示意图画法并能灵活运用。
【作业】
⑴ 及时复习今天的新课内容,预习离子的形成。
⑵把1~18号元素的原子结构示意图工整的画到作业本上交。钠在氯气中燃烧 钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?想一想钠原子氯原子钠+氯气 氯化钠加热三 离子的形成NaNa+失去e-ClCl-得到e-钠与氯气反应生成氯化钠的形成过程Na+Cl-e-NaNa+ 失去
1个电子Mg 失去
2个电子Mg2+Al 失去
3个电子Al3+原子阳离子金属原子 阳离子失去电子原子结构离子结构钠原子钠离子镁原子镁离子铝原子铝离子ClSP 得到
1个电子8Cl - 得到
2个电子8S2- 得到
3个电子P3-8原子阴离子原子结构离子结构氯原子氯离子硫原子硫离子磷原子磷离子非金属原子 阴离子得到电子三 离子的形成离子:带电荷的原子或原子团叫做离子。1.离子的定义⑴阳离子:带正电荷的原子或原子团。 2.离子的分类⑵阴离子:带负电荷的原子或原子团。3.离子的表示方法⑴用离子符号来表示离子。氢离子 钠离子 钾离子 镁离子 铝离子 铵根离子 水合氢离子H+ Na+ K+ Mg2+ Al3+ NH4+ H3O+阳离子:阴离子:F- Cl- O2- S2- 硝酸根离子 氢氧根离子 碳酸根离子 硫酸根离子NO3- OH- CO32- SO42-氟离子 氯离子 氧离子 硫离子 先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面。⑵离子的写法镁离子: Mg2 +;5个硫酸根离子:5 SO42-4.离子符号的意义2Mg2+ 表示每个镁离子带2个单位的正电荷 表示2个镁离子3.离子的表示方法1.说出下列离子符号前面的数字和右上角数字的含义。2O2- 6Na+ 3Al3+ 2Cl-原 子:质子数 核外电子数阳离子:质子数 核外电子数阴离子:质子数 核外电子数Al Al3+ S S2-2.说出下列四个符号的含义及完成填空。=><+ 11128+ 17287+8钠原子氯原子Na+Cl-Na+Cl- 阴、阳离子由于静电作用而形成不带电性的离子化合物.可见,离子也是构成物质的离子.5.离子化合物的形成过程【拓展】我们再看看氯化镁的形成过程:阳离子和阴离子由于静电作用而结合生成化合物。 原子和阴,阳离子之间是怎样相互转化的?失电子得电子得电子失电子原
子阳
离
子阴
离
子讨论2Mg2+表示2个镁离子表示每个镁离子带2个单位的正电荷练习:说出下列符号中数值“2”的含义。
H2 __________________________
2H _____________________________
Ca2+ _____________________________
2H+ _____________________________表示每个氢分子是由2个氢原子构成表示每个钙离子带2个单位的正电荷表示2个氢离子表示2个氢原子[模拟训练]
点燃条件下,镁带可以在空气中燃烧生成氧化镁。这个反应在微观世界里是怎样发生的?镁原子(Mg)镁离子(Mg2+ )阳离子氧原子(O)阴离子氧离子( O2- )6、离子也是构成物质的一种粒子宏
观
物质微
观
粒子构
成构
成构
成稀有气体、
金属等氧气、水、
氢气等氯化钠、氧化镁等分子原子离子 ①1个H2中含多少个质子和电子?
②1个H3中含多少个质子和电子?
③1个H3+中含多少个质子和电子?
④1个H3O+中含多少个质子和电子?
⑤1个NH4+中含多少个质子和电子?想一想1.某元素原子最外层上有2个电子,则此元素﹙ ﹚
A:一定是非金属元素 B:一定是金属元素 C:一定是稀有气体元素 D:以上说法都不正确D2.某元素的原子结构示意图为 ,该元素原子核内有_____个质子,核外共有_____个电子层,最外电子层上有_____个电子,它容易_____(填“得”或“失”)电子,形成_____(填“阴”或“阳”)离子。 1636得阴第3题图第4题图3.某粒子的结构示意图如图所示,则m= ,n= ,
x= 。该粒子是 (填粒子的化学符号)4.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是 ;若该粒子带2个单位正电荷,它的化学符号是 ;若该粒子不显电性,它的化学符号是 。1628SO2-Mg2+Ne四 相对原子质量(Ar)P56 阅读上表 (表3-2),能得出什么结论?1、质子和中子的质量很小且很接近,但比电子大很多。2、整个原子的质量主要集中在原子核上。原子的质量测定值一个氢原子的质量是:
0.00000000000000000000000000167千克
即1.67×10-27千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个碳原子的质量是:
0.00000000000000000000000001992千克
即1.992×10-26千克 原子的质量很小,记忆、计算都很不方便,那怎么办?请你想办法。 相对原子质量就是以一种碳原子质量的1/12(1.66×10-27kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量标准碳原子质量的1/12 (kg)Ar=(1)“相对原子质量”是一个比值;
(2)“相对原子质量”单位为“ 1 ”,可省略。质子、中子的相对质量约为:1
氢原子的相对原子质量约为:1
氧原子的相对原子质量约为:16四 相对原子质量(Ar)P56相对原子质量的近似值核电荷数=质子数=核外电子数相对原子质量≈质子数+中子数P62 3-4 阅读上表 (表3-4),能得到什么信息?相对原子质量(Ar)=某原子的质量(kg)标准碳原子质量的1/12 (kg)某原子的质量(kg) = m总(质子) + m总(中子) + m总(电子)Ar=m总(质子) + m总(中子) + m总(电子)标准碳原子质量的1/12 m总(质子)m总(中子)m总(电子)1.66×10-271.66×10-271.66×10-27Ar=+++Ar=x×m(质子)y×m(中子)x×m(电子)+1.66×10-271.66×10-271.66×10-27x× 1.6726×10-27y× 1.6749×10-27+1.66×10-271.66×10-27Ar≈Ar ≈ 质子数 + 中子数我国科学院院士
张青莲教授 我国科学院院士张青莲教授为相对原子质量的测定做出了卓越的贡献,他主持测定了铟 、铱 、锑、铈、铕、铒、锗、锌、镝几种元素的相对原子质量新值,被国际原子量委员会采用为相对原子质量数据标准。四、课堂小结:通过本节课的学习,你收获了什么? 1、填表:2、氧原子的相对原子质量为( )
A、16g B、16 C、2.657×10-26kg D、16g
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。 B114175114 1 0 12 26 30 1 1 12 12 26 在分子、原子、质子、中子、电子、原子核这些粒子中,选择合适的答案,填在空格上。
(1)能保持物质化学性质的最小粒子有:
(2)在化学变化中最小的粒子是:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)原子的质量主要集中在:
比一比速度、准确度分子 原子 原子分子 原子 中子质子、原子核电子电子原子核(质子 中子)、电子原子核 1、某微粒的结构示意图如下表示:
下列说法正确的是( )A.该微粒的原子核内有18个质子
B.该微粒的结构比较稳定
C.该微粒的原子核外有7个电子
D.该微粒的原子属于非金属原子3.据中央电视台报道,考古学家通过测定古生物遗骸中
的碳-14原子的含量来推测古生物的年代。碳-14原子
的质子数是6,原子内的粒子总数是20,下列有关
碳-14原子的叙述正确的是( )
A.其核外有8个电子 B.其核内有14个中子
C.核电荷数为6 D.该原子的相对原子质量为14C4.卢瑟福在测定原子构成时做了如下实验:取一极薄的金箔,用一高速运动的带正电荷的粒子轰击,结果发现大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出的以下结论中,正确的是( )。
A.金原子是实心球体,紧密结合排列
B.相对于金原子而言,金原子核体积小
C.金原子带正电荷
D.金原子带负电荷B
1.能说出构成原子的各种粒子及带电情况。(重点)
2.知道相对原子质量表示的意义,会查相对原子质量表。(难点)
探索之路英国化学家
道尔顿英国物理学家
汤姆生英国科学家
卢瑟福英国物理学家 查德维克1803年 实心球模型1918-1932年 发现质子中子1897年 枣糕模型1911年
行星式有核模型 道尔顿原子结构模型
——实心球体认为原子是一个实心
球体,不可分割汤姆生原子结构
模型—“西瓜式”
结构原子模型没有发现带正电
的原子核卢瑟福原子结构
模型—行星式有
核原子模型现代物质结构学说
——电子云模型认为电子在原子核外
沿一定的轨道运转科学是不断发展的,
电子云模型的缺陷
有待于同学们去发现1911年著名物理学家卢瑟福做了著名的卢瑟福实验,用一速带正电的质量比电子大很多的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔并不改变原来的方向,但也有一小部分改变了原来的方向,甚至有极少数α粒子被反弹了回来。卢瑟福得出结论:
①原子核很小,原子内部有很大的空间
②原子中心有个带正电荷的原子核,
α粒子途径金原子核附近受到斥力改变了运动方向;
③原子核质量比α粒子大, α粒子碰撞到原子核是被弹了回来卢瑟福原子模型:在原子的中心有一个带正电荷的原子核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。 在过氧化氢分解制氧气的实验中,过氧化氢 破裂为氢 和氧 ,该反应的文字表达为: __。可见,分子很小,但在化学反应中可以 ,而 在化学变化中不可再分,所以说 是化学变化中的最小的粒子。
(提示:填“分子”或“原子”) 分子 原子 原子 再分 原子 原子 过氧化氢 水 + 氧气二氧化锰那原子还能再分吗?英国物理学家卢瑟福α粒子散射实验大部分α粒子在穿过金属箔片;
少数的α粒子方向明显发生大角度改变原子不是简单而不可分割的实心球体。原子的结构PPT模板:www.1ppt.com/moban/ PPT素材:www.1ppt.com/sucai/
PPT背景:www.1ppt.com/beijing/ PPT图表:www.1ppt.com/tubiao/
PPT下载:www.1ppt.com/xiazai/ PPT教程: www.1ppt.com/powerpoint/
资料下载:www.1ppt.com/ziliao/ 范文下载:www.1ppt.com/fanwen/
试卷下载:www.1ppt.com/shiti/ 教案下载:www.1ppt.com/jiaoan/
PPT论坛:www.1ppt.cn PPT课件:www.1ppt.com/kejian/
语文课件:www.1ppt.com/kejian/yuwen/ 数学课件:www.1ppt.com/kejian/shuxue/
英语课件:www.1ppt.com/kejian/yingyu/ 美术课件:www.1ppt.com/kejian/meishu/
科学课件:www.1ppt.com/kejian/kexue/ 物理课件:www.1ppt.com/kejian/wuli/
化学课件:www.1ppt.com/kejian/huaxue/ 生物课件:www.1ppt.com/kejian/shengwu/
地理课件:www.1ppt.com/kejian/dili/ 历史课件:www.1ppt.com/kejian/lishi/ 一、原子的构成原 子(带正电)(不带电) (带负电) (带正电)(不带电) 1、原子的结构观察表格(表3-1),思考下列问题1.不同原子之间有哪些区别?2.所有原子都是由质子、中子、电子构成的吗?原子里质子数不同,原子种类也不同。不是所有的原子都有中子。如氢原子观察表格(表3-1),思考下列问题3. 质子数、中子数在数量上有什么关系?4.质子数、电子数、核电荷数、原子序数有什么联系?质子数不一定等于中子数。质子数=核外电子数=核电荷数=原子序数1.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。 2.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有 、 、 。 3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子, 161个中子,则该元素核外电子数是_____ 。正电负电质子中子相等相反不显分子原子质子和原子核中子111原子分子你知道吗? 原子核的半径为原子半径
的十万分之一原子核的体积为原子体积
的千亿分之一 所以在原子核外有很大的空间,电子就在这广阔的空间里高速运动。核外电子是怎样运动的? 观看原子的核外电子运动的模拟动画。氢原子的结构
(1个电子)行星绕太阳运功二 电子在原子核外一定区域内出现,这些区域叫作叫做“电子层”,核外电子是在不同的电子层内运动的,此现象叫做核外电子的分层排布。二 原子核外电子的排布1、核外电子是分层排布的电子层 一 二 三 四 五 六 七K L M N O P Q离核远近:近远能量高低:低高(2)第一层最多排2个,第二层最多排8个;(3)最外层最多排8个电子
(只有一个电子层时最多 2个电子);(1)先 “里”后“外” .(能量最低原则)2.核外电子分层排布的规律(仅限前3层)(4)每个电子层最多容纳2n2个电子 (n代表电子层数).111822610228212833287217请你动手试一试:第一层(2个)第二层(8个)第三层(1个)
(最外层)钠原子的结构
(11个电子)11+原子核电荷种类质子数电子层128第二层第一层第三层最外层该层的电子数目钠原子结构示意图次外层3.原子结构示意图
画法:画圆圈,标核电,
弧线呈扇面,数字一条线。 Na3.原子结构示意图
例如:O和P的原子结构示意图:OP第一层(2个)第二层(6个)
(最外层)【亲手尝试】根据氧原子的结构图画出结构示意图 请按以下排列格式画出1~18号元素的原子结构示意图:
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar比一比,看一看你画对了吗? P54 3-12C氢 H 氦He锂 Li 铍 Be 硼 B 碳 C 氮N 氧O 氟 F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P 硫 S 氯Cl 氩Ar金属元素非金属元素稀有气体元素 这三大类元素的原子最外层电子数有什么规律?一般<4易失去电子一般>4易得到电子 容易发生化学反应等于8
(氦等于2)稳定结构 难发生化学反应金属元素非金属元素稀有气体元素稳定不稳定不稳定4.元素的性质与原子最外层电子数的关系【结论】元素的化学性质与原子核外电子的排布,特别是最外层电子数有密切关系。 ⑴在同一周期中,从左到右,原子的电子层数相同(核外电子层数等于周期数),最外层电子数依次增大。
⑵在同一族中,最外层电子数相同但电子层数从上到下依次递增。
⑶同族元素原子的最外层电子数相同,具有相似的化学性质。1、“嫦蛾一号”的任务之一是探测月球上的氦-3资源,He-3的原子结构示意图为 ,图中x为( )。
A.1 B. 2 C. 3 D. 4B2、下列原子结构示意图所表示的元素,化学性质最稳定的是( )。
ABCDA4. 下列具有相似化学性质的元素组别是( )。 3.这是磷原子的结构示意图 ,该原子的核电荷数是__,共有__个电子层,第二电子层上有__个电子,最外层上的电子数是__。15385CD 5.已知碘元素(I)原子结构示意图为 ,请回答下列问题:
⑴ x 的值为__;
⑵(多选)一般情况下,元素原子最外层电子数相同,具有相似化学性质.碘元素的化学性质与下列元素的化学性质最相似的是( ).
A.B.C.D.53AB 我们学习了原子的结构及原子结构示意图的画法,要熟练掌握1~18号元素的原子结构示意图画法并能灵活运用。
【作业】
⑴ 及时复习今天的新课内容,预习离子的形成。
⑵把1~18号元素的原子结构示意图工整的画到作业本上交。钠在氯气中燃烧 钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?想一想钠原子氯原子钠+氯气 氯化钠加热三 离子的形成NaNa+失去e-ClCl-得到e-钠与氯气反应生成氯化钠的形成过程Na+Cl-e-NaNa+ 失去
1个电子Mg 失去
2个电子Mg2+Al 失去
3个电子Al3+原子阳离子金属原子 阳离子失去电子原子结构离子结构钠原子钠离子镁原子镁离子铝原子铝离子ClSP 得到
1个电子8Cl - 得到
2个电子8S2- 得到
3个电子P3-8原子阴离子原子结构离子结构氯原子氯离子硫原子硫离子磷原子磷离子非金属原子 阴离子得到电子三 离子的形成离子:带电荷的原子或原子团叫做离子。1.离子的定义⑴阳离子:带正电荷的原子或原子团。 2.离子的分类⑵阴离子:带负电荷的原子或原子团。3.离子的表示方法⑴用离子符号来表示离子。氢离子 钠离子 钾离子 镁离子 铝离子 铵根离子 水合氢离子H+ Na+ K+ Mg2+ Al3+ NH4+ H3O+阳离子:阴离子:F- Cl- O2- S2- 硝酸根离子 氢氧根离子 碳酸根离子 硫酸根离子NO3- OH- CO32- SO42-氟离子 氯离子 氧离子 硫离子 先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面。⑵离子的写法镁离子: Mg2 +;5个硫酸根离子:5 SO42-4.离子符号的意义2Mg2+ 表示每个镁离子带2个单位的正电荷 表示2个镁离子3.离子的表示方法1.说出下列离子符号前面的数字和右上角数字的含义。2O2- 6Na+ 3Al3+ 2Cl-原 子:质子数 核外电子数阳离子:质子数 核外电子数阴离子:质子数 核外电子数Al Al3+ S S2-2.说出下列四个符号的含义及完成填空。=><+ 11128+ 17287+8钠原子氯原子Na+Cl-Na+Cl- 阴、阳离子由于静电作用而形成不带电性的离子化合物.可见,离子也是构成物质的离子.5.离子化合物的形成过程【拓展】我们再看看氯化镁的形成过程:阳离子和阴离子由于静电作用而结合生成化合物。 原子和阴,阳离子之间是怎样相互转化的?失电子得电子得电子失电子原
子阳
离
子阴
离
子讨论2Mg2+表示2个镁离子表示每个镁离子带2个单位的正电荷练习:说出下列符号中数值“2”的含义。
H2 __________________________
2H _____________________________
Ca2+ _____________________________
2H+ _____________________________表示每个氢分子是由2个氢原子构成表示每个钙离子带2个单位的正电荷表示2个氢离子表示2个氢原子[模拟训练]
点燃条件下,镁带可以在空气中燃烧生成氧化镁。这个反应在微观世界里是怎样发生的?镁原子(Mg)镁离子(Mg2+ )阳离子氧原子(O)阴离子氧离子( O2- )6、离子也是构成物质的一种粒子宏
观
物质微
观
粒子构
成构
成构
成稀有气体、
金属等氧气、水、
氢气等氯化钠、氧化镁等分子原子离子 ①1个H2中含多少个质子和电子?
②1个H3中含多少个质子和电子?
③1个H3+中含多少个质子和电子?
④1个H3O+中含多少个质子和电子?
⑤1个NH4+中含多少个质子和电子?想一想1.某元素原子最外层上有2个电子,则此元素﹙ ﹚
A:一定是非金属元素 B:一定是金属元素 C:一定是稀有气体元素 D:以上说法都不正确D2.某元素的原子结构示意图为 ,该元素原子核内有_____个质子,核外共有_____个电子层,最外电子层上有_____个电子,它容易_____(填“得”或“失”)电子,形成_____(填“阴”或“阳”)离子。 1636得阴第3题图第4题图3.某粒子的结构示意图如图所示,则m= ,n= ,
x= 。该粒子是 (填粒子的化学符号)4.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是 ;若该粒子带2个单位正电荷,它的化学符号是 ;若该粒子不显电性,它的化学符号是 。1628SO2-Mg2+Ne四 相对原子质量(Ar)P56 阅读上表 (表3-2),能得出什么结论?1、质子和中子的质量很小且很接近,但比电子大很多。2、整个原子的质量主要集中在原子核上。原子的质量测定值一个氢原子的质量是:
0.00000000000000000000000000167千克
即1.67×10-27千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个碳原子的质量是:
0.00000000000000000000000001992千克
即1.992×10-26千克 原子的质量很小,记忆、计算都很不方便,那怎么办?请你想办法。 相对原子质量就是以一种碳原子质量的1/12(1.66×10-27kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量标准碳原子质量的1/12 (kg)Ar=(1)“相对原子质量”是一个比值;
(2)“相对原子质量”单位为“ 1 ”,可省略。质子、中子的相对质量约为:1
氢原子的相对原子质量约为:1
氧原子的相对原子质量约为:16四 相对原子质量(Ar)P56相对原子质量的近似值核电荷数=质子数=核外电子数相对原子质量≈质子数+中子数P62 3-4 阅读上表 (表3-4),能得到什么信息?相对原子质量(Ar)=某原子的质量(kg)标准碳原子质量的1/12 (kg)某原子的质量(kg) = m总(质子) + m总(中子) + m总(电子)Ar=m总(质子) + m总(中子) + m总(电子)标准碳原子质量的1/12 m总(质子)m总(中子)m总(电子)1.66×10-271.66×10-271.66×10-27Ar=+++Ar=x×m(质子)y×m(中子)x×m(电子)+1.66×10-271.66×10-271.66×10-27x× 1.6726×10-27y× 1.6749×10-27+1.66×10-271.66×10-27Ar≈Ar ≈ 质子数 + 中子数我国科学院院士
张青莲教授 我国科学院院士张青莲教授为相对原子质量的测定做出了卓越的贡献,他主持测定了铟 、铱 、锑、铈、铕、铒、锗、锌、镝几种元素的相对原子质量新值,被国际原子量委员会采用为相对原子质量数据标准。四、课堂小结:通过本节课的学习,你收获了什么? 1、填表:2、氧原子的相对原子质量为( )
A、16g B、16 C、2.657×10-26kg D、16g
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为 ,中子数为 ,核外电子数为 。 B114175114 1 0 12 26 30 1 1 12 12 26 在分子、原子、质子、中子、电子、原子核这些粒子中,选择合适的答案,填在空格上。
(1)能保持物质化学性质的最小粒子有:
(2)在化学变化中最小的粒子是:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)原子的质量主要集中在:
比一比速度、准确度分子 原子 原子分子 原子 中子质子、原子核电子电子原子核(质子 中子)、电子原子核 1、某微粒的结构示意图如下表示:
下列说法正确的是( )A.该微粒的原子核内有18个质子
B.该微粒的结构比较稳定
C.该微粒的原子核外有7个电子
D.该微粒的原子属于非金属原子3.据中央电视台报道,考古学家通过测定古生物遗骸中
的碳-14原子的含量来推测古生物的年代。碳-14原子
的质子数是6,原子内的粒子总数是20,下列有关
碳-14原子的叙述正确的是( )
A.其核外有8个电子 B.其核内有14个中子
C.核电荷数为6 D.该原子的相对原子质量为14C4.卢瑟福在测定原子构成时做了如下实验:取一极薄的金箔,用一高速运动的带正电荷的粒子轰击,结果发现大多数粒子通过了金箔,极少数粒子发生偏转或被弹回。根据上述现象得出的以下结论中,正确的是( )。
A.金原子是实心球体,紧密结合排列
B.相对于金原子而言,金原子核体积小
C.金原子带正电荷
D.金原子带负电荷B
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
