人教版九年级化学第5单元课题3利用化学方程式的简单计算 (共33张PPT)
文档属性
| 名称 | 人教版九年级化学第5单元课题3利用化学方程式的简单计算 (共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 242.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-30 00:00:00 | ||
图片预览










文档简介
(共31张PPT)
课题 3
课题3 利用化学方程式的简单计算
第一课时
研究物质的变化常常要涉及量的计算,根据化学方程式可以从量的方面研究物质的变化,例如一定量的原料可以生产出多少产品,制备一定量的产品需要多少原料等等通过这些计算,可以加强生产的计划性,并有利于合理的利用资源。
应 用
学完本课题你应该知道
1、根据实际参加反应的一种反应物或生成物的
质量,可以计算出另一种反应物或生成物的
质量。
2、规范化学方程式计算的书写格式。
加热分解6.3克高锰酸钾,可以得到多少克氧气?
该怎么计算呢?
方法和步骤
同学们,现在我们来学习利用化学方程式计算的——
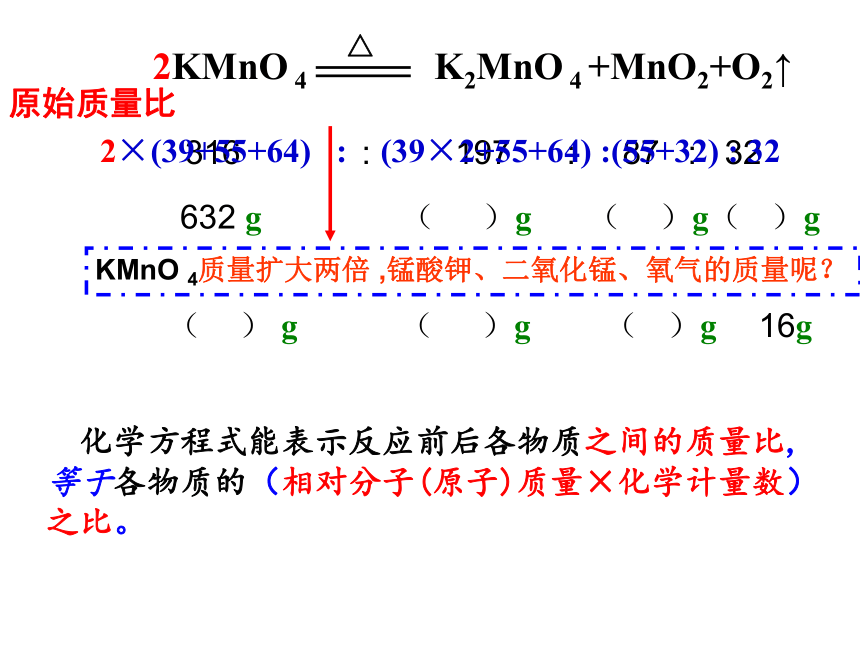
2KMnO 4 K2MnO 4 +MnO2+O2↑
△
原始质量比
316 : 197 : 87 : 32
632 g ( )g ( )g( )g
KMnO 4质量扩大两倍 ,锰酸钾、二氧化锰、氧气的质量呢?
( ) g ( )g ( )g 16g
化学方程式能表示反应前后各物质之间的质量比,等于各物质的(相对分子(原子)质量×化学计量数)之比。
2×(39+55+64) : (39×2+55+64) :(55+32) : 32
恍
然
大
悟
也就是说,反应物与生成物之间质量比是成 关系。因此,只要知道 反应物或生成物的质量,我们就可以求出 未知物的质量。
正比例
一种
其他
这种解题方法称为“比例法”。
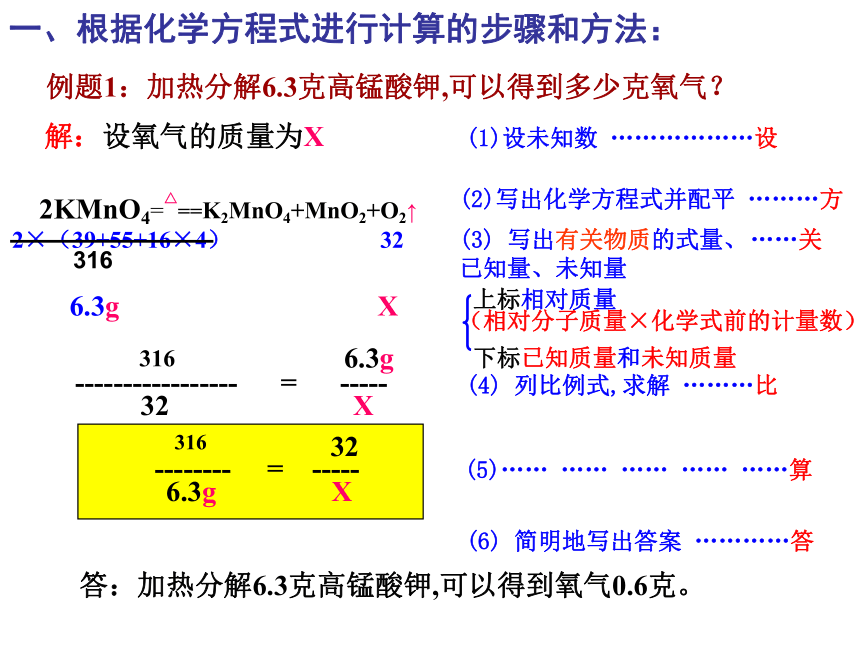
例题1:加热分解6.3克高锰酸钾,可以得到多少克氧气?
解:设氧气的质量为X
2KMnO4=△==K2MnO4+MnO2+O2↑
2×(39+55+16×4) 32
6.3g X
316
----------------- = -----
6.3g
32
X
X = ------------
32×6.3g
316
= 0.6 g
答:加热分解6.3克高锰酸钾,可以得到氧气0.6克。
一、根据化学方程式进行计算的步骤和方法:
(1)设未知数 ………………设
(2)写出化学方程式并配平 ………方
(3) 写出有关物质的式量、已知量、未知量
……关
上标相对质量
下标已知质量和未知质量
(4) 列比例式,求解 ………比
(6) 简明地写出答案 …………答
(相对分子质量×化学式前的计量数)
316
(5)…… …… …… …… ……算
-------- = -----
32
6.3g
X
316
例题1:加热分解6.3克高锰酸钾,可以得到多少克氧气?
解:设加热分解6.3克高锰酸钾,可以得到氧气的质量为X
2KMnO4=△==K2MnO4+MnO2+O2↑
316
----------------- = -----
32
6.3g
X
X = ------------
32×6.3g
316
= 0.6 g
答:加热分解6.3克高锰酸钾,可以得到氧气0.6克。
用一个字概括用化学方程式进行计算的每一个步骤
32
6.3g X
316
三个要领: (1)步骤要完整(解、设、方、关、比、算、答);
(2)格式要规范;
(3)得数要准确(除不尽保留一位小数);
温馨提示
1. 反应的化学方程式为:略
2. 三瓶氧气的总质量约为 0.96g。
3. 相对原子质量 K 39 Mn 55 O16
制取三瓶氧气,最少取用多少克高锰酸钾才能既满足实验要求又不浪费药品呢?
帮你解答
根据化学方程式计算的注意事项:
1. 设未知量时注意不要写单位,已知量和未知量单位要写,不一致的,先换算成一致的再进行计算.
2. 化学方程式一定要注意配平,标明反应条件、气体、沉淀符号,注意化学方程式的完整性.
3. 相关物质的相对分子质量写在相应的化学式下,一定要注意用相对分子质量×化学式前的系数,已知质量和未知质量(即x)写在相应相对分子质量的下边.
4. 计算结果的小数位保留按题中要求进行,若题中没有要求,又除不尽时,一般保留一位小数.
例2、工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要碳酸钙多少吨?
解:设制取10吨氧化钙需要碳酸钙的质量为x。
CaCO3
高温
CaO + CO2↑
=
100×10t
=17.9t
x
56
x
10t
=
100
56
x
10t
100
56
答:需要碳酸钙的质量为17.9t。
y = ---------------
245
245
96×12.25克
96
245
x
12.25克
△
MnO2
练习:(1) 12.25克氯酸钾和3克二氧化锰混合加热 完全反应可得到多少克的氧气 同时生成氯化钾多少克?
(2) 制取4.8克氧气,需要氯酸钾多少克
(1)解:设可得到氧气的质量为x,
2KClO3
======
2KCl
+3O2
↑
245
96
12.25克
x
-------
=
-------
x =
--------------
= 4.8 克
答:加热分解5.8克氯酸钾可得到氧气 2.3克,
149
245
------- = ------
149
149×12.25克
同时生成氯化钾7.45克.
生成氯化钾的质量为y。
y
= 7.45克
12.25克
y
MnO2
(2) 解:设:需要氯酸钾的质量为x。
2KClO3
======
2KCl
+3O2
245
96
△
↑
4.8克
X
245
x
4.8克
96
=
-------
-------
x = --------------
4.8克×245
96
= 12.25克
答:需要氯酸钾12.25克.
课堂小结:
同学们,通过本节课的学习,你有什么收获?
1.根据化学方程式计算的解题步骤
(1)设未知量
(2)写出反应的化学方程式
(3)计算相关物质的质量比×化学式前的化学计量数
标出已知质量、未知质量
(4)列比例式
解出未知数
(5)简明地写出答语
2.根据化学方程式计算的三个要领和三个关键
三个要领: (1)步骤要完整(解、设、方、关、比、算、答);
(2)格式要规范;
(3)得数要准确(除不尽保留一位小数);
三个关键:(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程);
课题 3
课题3 利用化学方程式的简单计算
第二课时
解题注意:
化学方程要配平,
需将纯量代方程;
关系式对关系量,
计算单位不能忘;
关系量间成比例,
解设方关比算答要牢记。
记住哦!
练习1:15.5克红磷在氧气中充分燃烧,可生成五氧化二磷多少克
(找出下列所解答案中的错误)
解:设可生成x克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 x
31 142
------- = ---------
15.5 x
x = --------------
142×15.5
31
= 71
答:可生成五氧化二磷71克
×
×
×
×
质量比计算错误
计算结果错误且无单位
×
想一想
未注明单位
未配平
未知数带了单位
(写出正确的解题步骤)
根据化学方程式计算的注意事项:
(1)设的时候应该用:
“设…的质量为x”,无单位
(2)化学方程式书写正确,物质的化学式一定要正确,化学方程式一定要配平!!
(3)相对分子质量(有系数要记得×系数)计算要准确,且要将已知量化成质量单位
(4)列比例式时,横比=横比(书上用)
或竖比=竖比(推荐使用)
例题1:高炉炼铁的主要反应是:
Fe2O3 +3 CO 2 Fe + 3 CO2
计算20吨含氧化铁80%的铁矿石,可以炼出多少吨铁?
高温
挑战题
纯物质的质量=不纯物质质量×纯净物的质量分数(纯度)
=不纯物质质量×(1-杂质的质量分数)
提示:所有代入化学方程计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
练习:有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?
提示:
解:设参加反应的锌的质量为x
65
x
2
0.2g
答:锌的纯度为81%。
×
81%
100%
8g
6.5g
=
锌的纯度为=
例题2:氯酸钾和二氧化锰的混合物6g加热,
当氧气不再产生为止,余下的固体为4.08g,求:
①产生氧气多少克?
②4.08g固体中有哪些物质,各是多少?
知识拓展
提示:所有代入化学方程计算的质量必须是纯净物的
质量,如果是不纯物,则需要转换(做差)。
★解题关键:
运用质量守恒定律,正确理解:
1、反应前后固体质量为何变化?
2、其变量是多少?实际上就是哪种物质的质量?
注意先审题
②设原混合物中氯酸钾的质量为x。
245
96
X= 4.9g
X
1.92g
解:
①根据质量守恒定律,O2的质量为
KClO3 KCl + O2↑
△
MnO2
2
3
2
245
——
X
=
96
——
1.92g
6g - 4.08g = 1.92g
KClO3 和MnO2
KCl 和MnO2
6克
4.08克
6g - 4.9g = 1.1g
4.08g - 1.1g = 2.98g
答:①……②……
练习:把1g二氧化锰加到34g过氧化氢溶液中,当氧气不再产生为止,余下的物质为33.4g,求:
①生成氧气多少克?
②过氧化氢溶液中过氧化氢的质量分数是多少?
知识拓展
注意先审题
例3:A+3B==2C+2D中,A与B的相对分子质量之比为9:11,已知1.8gA与一定量的B恰好完全反应生成5.1gD,
则此反应中B和C的质量比为_______
2:1
根据化学方程式的计算中,牢记两点:
1、实际质量与系数无关;
2、相对分子质量与系数有关。
因为:物质间的实际质量之比等于相对分子质量与其系数的乘积之比
3.在一密闭容器里有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
已知甲的相对分子质量为n,丁的相对分子质量为2n,则该反应的化学方程式中甲与丁的系数比为 ( )
A.1∶2 B.2∶1 C.1∶3 D.1∶1
反应前质量
(克)
反应后质量
(克)
物质
甲
乙
丙
丁
4
10
1
25
未测
21
10
9
思路:
根据质量的变化判断出反应物、生成物;
反应后质量
(克)
反应前质量
(克)
物质
甲
乙
丙
丁
4
10
1
25
未测
21
10
9
思路:
根据质量的变化判断出反应物、生成物;
乙:从10克到21克,增加11克
丙:从1克到10克,增加9克
丁:从25克到9克,减少16克
乙生成物
丙生成物
丁反应物
甲:
是反应物还是生成物?
11+9>16克
∴甲是反应物
甲反应掉4克
xA + yD ==== mB + nC
设化学式为A
设化学式为B
设化学式为C
设化学式为D
x×n
y×2n
4克
16克
讨论:
从中你受到的启示是什么?
H:1 O:16
若将1g氢气和10g氧气混合在一密闭的容器中使之充分反应,生成水的质量为多少?
(思考:你代入的应是氢气的质量还是氧气的质量)
提示:涉及某些物质过量的化学方程式的计算
某些反应物在反应后有剩余,我们说这些物质在反应中过量,因为它们没有都参加反应,因此计算时,不能用此物质进行求算。
过量问题
化学反应计算中的几种方法
计算方法 适用范围
1、利用化学式进行计算
2、利用化学方程式计算
3、利用质量守恒定律计算
物质中的某元素完全转化
到另一种物质中
已知任何一种物质的质量,
可求其他物质的质量
所有反应物和生成物中只
有一种未知
课堂作业:
2:有氯酸钾和二氧化锰混合物15克,加热使它完
全反应,结果发现试管内固体物质为10.2克,
试回答:
(1)生成多少克氧气?
(2)充分反应后,试管内含有那些固体物质?
其质量分别为少克?
1:含杂质质量分数为5%的锌粒6.84克,与足量
稀硫酸充分反应( Zn+H2SO4=ZnSO4+H2↑)可生
成氢气多少克 (杂质不跟稀硫酸反应,在标准
状况下,氢气的密度为0.09g/L。)
1.表示化学反应
2.根据化学方程式进行计算
3.计算题格式:解、设、方、关、比、算、答
化学方程式
概念:
用化学式来表示化学反应的式子
涵义
表示反应物、生成物和反应条件
表示反应物、生成物之间的质量比、微粒个数比
书写原则
以客观事实为依据
遵守质量守恒定律
书写步骤
应用
1.写
方法
—质量守恒定律
—最小公倍数法、观察法等
5.查
—检查化学方程式
4.注—
注明条件以及生成物的状态“↓、↑”
—将短线改为等号
3.等
2.配
依据
—短线左边反应物,右边生成物
复习总结
课题 3
课题3 利用化学方程式的简单计算
第一课时
研究物质的变化常常要涉及量的计算,根据化学方程式可以从量的方面研究物质的变化,例如一定量的原料可以生产出多少产品,制备一定量的产品需要多少原料等等通过这些计算,可以加强生产的计划性,并有利于合理的利用资源。
应 用
学完本课题你应该知道
1、根据实际参加反应的一种反应物或生成物的
质量,可以计算出另一种反应物或生成物的
质量。
2、规范化学方程式计算的书写格式。
加热分解6.3克高锰酸钾,可以得到多少克氧气?
该怎么计算呢?
方法和步骤
同学们,现在我们来学习利用化学方程式计算的——
2KMnO 4 K2MnO 4 +MnO2+O2↑
△
原始质量比
316 : 197 : 87 : 32
632 g ( )g ( )g( )g
KMnO 4质量扩大两倍 ,锰酸钾、二氧化锰、氧气的质量呢?
( ) g ( )g ( )g 16g
化学方程式能表示反应前后各物质之间的质量比,等于各物质的(相对分子(原子)质量×化学计量数)之比。
2×(39+55+64) : (39×2+55+64) :(55+32) : 32
恍
然
大
悟
也就是说,反应物与生成物之间质量比是成 关系。因此,只要知道 反应物或生成物的质量,我们就可以求出 未知物的质量。
正比例
一种
其他
这种解题方法称为“比例法”。
例题1:加热分解6.3克高锰酸钾,可以得到多少克氧气?
解:设氧气的质量为X
2KMnO4=△==K2MnO4+MnO2+O2↑
2×(39+55+16×4) 32
6.3g X
316
----------------- = -----
6.3g
32
X
X = ------------
32×6.3g
316
= 0.6 g
答:加热分解6.3克高锰酸钾,可以得到氧气0.6克。
一、根据化学方程式进行计算的步骤和方法:
(1)设未知数 ………………设
(2)写出化学方程式并配平 ………方
(3) 写出有关物质的式量、已知量、未知量
……关
上标相对质量
下标已知质量和未知质量
(4) 列比例式,求解 ………比
(6) 简明地写出答案 …………答
(相对分子质量×化学式前的计量数)
316
(5)…… …… …… …… ……算
-------- = -----
32
6.3g
X
316
例题1:加热分解6.3克高锰酸钾,可以得到多少克氧气?
解:设加热分解6.3克高锰酸钾,可以得到氧气的质量为X
2KMnO4=△==K2MnO4+MnO2+O2↑
316
----------------- = -----
32
6.3g
X
X = ------------
32×6.3g
316
= 0.6 g
答:加热分解6.3克高锰酸钾,可以得到氧气0.6克。
用一个字概括用化学方程式进行计算的每一个步骤
32
6.3g X
316
三个要领: (1)步骤要完整(解、设、方、关、比、算、答);
(2)格式要规范;
(3)得数要准确(除不尽保留一位小数);
温馨提示
1. 反应的化学方程式为:略
2. 三瓶氧气的总质量约为 0.96g。
3. 相对原子质量 K 39 Mn 55 O16
制取三瓶氧气,最少取用多少克高锰酸钾才能既满足实验要求又不浪费药品呢?
帮你解答
根据化学方程式计算的注意事项:
1. 设未知量时注意不要写单位,已知量和未知量单位要写,不一致的,先换算成一致的再进行计算.
2. 化学方程式一定要注意配平,标明反应条件、气体、沉淀符号,注意化学方程式的完整性.
3. 相关物质的相对分子质量写在相应的化学式下,一定要注意用相对分子质量×化学式前的系数,已知质量和未知质量(即x)写在相应相对分子质量的下边.
4. 计算结果的小数位保留按题中要求进行,若题中没有要求,又除不尽时,一般保留一位小数.
例2、工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要碳酸钙多少吨?
解:设制取10吨氧化钙需要碳酸钙的质量为x。
CaCO3
高温
CaO + CO2↑
=
100×10t
=17.9t
x
56
x
10t
=
100
56
x
10t
100
56
答:需要碳酸钙的质量为17.9t。
y = ---------------
245
245
96×12.25克
96
245
x
12.25克
△
MnO2
练习:(1) 12.25克氯酸钾和3克二氧化锰混合加热 完全反应可得到多少克的氧气 同时生成氯化钾多少克?
(2) 制取4.8克氧气,需要氯酸钾多少克
(1)解:设可得到氧气的质量为x,
2KClO3
======
2KCl
+3O2
↑
245
96
12.25克
x
-------
=
-------
x =
--------------
= 4.8 克
答:加热分解5.8克氯酸钾可得到氧气 2.3克,
149
245
------- = ------
149
149×12.25克
同时生成氯化钾7.45克.
生成氯化钾的质量为y。
y
= 7.45克
12.25克
y
MnO2
(2) 解:设:需要氯酸钾的质量为x。
2KClO3
======
2KCl
+3O2
245
96
△
↑
4.8克
X
245
x
4.8克
96
=
-------
-------
x = --------------
4.8克×245
96
= 12.25克
答:需要氯酸钾12.25克.
课堂小结:
同学们,通过本节课的学习,你有什么收获?
1.根据化学方程式计算的解题步骤
(1)设未知量
(2)写出反应的化学方程式
(3)计算相关物质的质量比×化学式前的化学计量数
标出已知质量、未知质量
(4)列比例式
解出未知数
(5)简明地写出答语
2.根据化学方程式计算的三个要领和三个关键
三个要领: (1)步骤要完整(解、设、方、关、比、算、答);
(2)格式要规范;
(3)得数要准确(除不尽保留一位小数);
三个关键:(1)准确书写化学方程式;
(2)准确计算相对分子质量;
(3)代入量均指纯净物的质量(单位要代入计算过程);
课题 3
课题3 利用化学方程式的简单计算
第二课时
解题注意:
化学方程要配平,
需将纯量代方程;
关系式对关系量,
计算单位不能忘;
关系量间成比例,
解设方关比算答要牢记。
记住哦!
练习1:15.5克红磷在氧气中充分燃烧,可生成五氧化二磷多少克
(找出下列所解答案中的错误)
解:设可生成x克五氧化二磷
点燃
P + O 2 ====== P 2 O 5
31 142
15.5 x
31 142
------- = ---------
15.5 x
x = --------------
142×15.5
31
= 71
答:可生成五氧化二磷71克
×
×
×
×
质量比计算错误
计算结果错误且无单位
×
想一想
未注明单位
未配平
未知数带了单位
(写出正确的解题步骤)
根据化学方程式计算的注意事项:
(1)设的时候应该用:
“设…的质量为x”,无单位
(2)化学方程式书写正确,物质的化学式一定要正确,化学方程式一定要配平!!
(3)相对分子质量(有系数要记得×系数)计算要准确,且要将已知量化成质量单位
(4)列比例式时,横比=横比(书上用)
或竖比=竖比(推荐使用)
例题1:高炉炼铁的主要反应是:
Fe2O3 +3 CO 2 Fe + 3 CO2
计算20吨含氧化铁80%的铁矿石,可以炼出多少吨铁?
高温
挑战题
纯物质的质量=不纯物质质量×纯净物的质量分数(纯度)
=不纯物质质量×(1-杂质的质量分数)
提示:所有代入化学方程计算的量必须是纯净物的质量,如果是不纯物,则需要转换。
练习:有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?
提示:
解:设参加反应的锌的质量为x
65
x
2
0.2g
答:锌的纯度为81%。
×
81%
100%
8g
6.5g
=
锌的纯度为=
例题2:氯酸钾和二氧化锰的混合物6g加热,
当氧气不再产生为止,余下的固体为4.08g,求:
①产生氧气多少克?
②4.08g固体中有哪些物质,各是多少?
知识拓展
提示:所有代入化学方程计算的质量必须是纯净物的
质量,如果是不纯物,则需要转换(做差)。
★解题关键:
运用质量守恒定律,正确理解:
1、反应前后固体质量为何变化?
2、其变量是多少?实际上就是哪种物质的质量?
注意先审题
②设原混合物中氯酸钾的质量为x。
245
96
X= 4.9g
X
1.92g
解:
①根据质量守恒定律,O2的质量为
KClO3 KCl + O2↑
△
MnO2
2
3
2
245
——
X
=
96
——
1.92g
6g - 4.08g = 1.92g
KClO3 和MnO2
KCl 和MnO2
6克
4.08克
6g - 4.9g = 1.1g
4.08g - 1.1g = 2.98g
答:①……②……
练习:把1g二氧化锰加到34g过氧化氢溶液中,当氧气不再产生为止,余下的物质为33.4g,求:
①生成氧气多少克?
②过氧化氢溶液中过氧化氢的质量分数是多少?
知识拓展
注意先审题
例3:A+3B==2C+2D中,A与B的相对分子质量之比为9:11,已知1.8gA与一定量的B恰好完全反应生成5.1gD,
则此反应中B和C的质量比为_______
2:1
根据化学方程式的计算中,牢记两点:
1、实际质量与系数无关;
2、相对分子质量与系数有关。
因为:物质间的实际质量之比等于相对分子质量与其系数的乘积之比
3.在一密闭容器里有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
已知甲的相对分子质量为n,丁的相对分子质量为2n,则该反应的化学方程式中甲与丁的系数比为 ( )
A.1∶2 B.2∶1 C.1∶3 D.1∶1
反应前质量
(克)
反应后质量
(克)
物质
甲
乙
丙
丁
4
10
1
25
未测
21
10
9
思路:
根据质量的变化判断出反应物、生成物;
反应后质量
(克)
反应前质量
(克)
物质
甲
乙
丙
丁
4
10
1
25
未测
21
10
9
思路:
根据质量的变化判断出反应物、生成物;
乙:从10克到21克,增加11克
丙:从1克到10克,增加9克
丁:从25克到9克,减少16克
乙生成物
丙生成物
丁反应物
甲:
是反应物还是生成物?
11+9>16克
∴甲是反应物
甲反应掉4克
xA + yD ==== mB + nC
设化学式为A
设化学式为B
设化学式为C
设化学式为D
x×n
y×2n
4克
16克
讨论:
从中你受到的启示是什么?
H:1 O:16
若将1g氢气和10g氧气混合在一密闭的容器中使之充分反应,生成水的质量为多少?
(思考:你代入的应是氢气的质量还是氧气的质量)
提示:涉及某些物质过量的化学方程式的计算
某些反应物在反应后有剩余,我们说这些物质在反应中过量,因为它们没有都参加反应,因此计算时,不能用此物质进行求算。
过量问题
化学反应计算中的几种方法
计算方法 适用范围
1、利用化学式进行计算
2、利用化学方程式计算
3、利用质量守恒定律计算
物质中的某元素完全转化
到另一种物质中
已知任何一种物质的质量,
可求其他物质的质量
所有反应物和生成物中只
有一种未知
课堂作业:
2:有氯酸钾和二氧化锰混合物15克,加热使它完
全反应,结果发现试管内固体物质为10.2克,
试回答:
(1)生成多少克氧气?
(2)充分反应后,试管内含有那些固体物质?
其质量分别为少克?
1:含杂质质量分数为5%的锌粒6.84克,与足量
稀硫酸充分反应( Zn+H2SO4=ZnSO4+H2↑)可生
成氢气多少克 (杂质不跟稀硫酸反应,在标准
状况下,氢气的密度为0.09g/L。)
1.表示化学反应
2.根据化学方程式进行计算
3.计算题格式:解、设、方、关、比、算、答
化学方程式
概念:
用化学式来表示化学反应的式子
涵义
表示反应物、生成物和反应条件
表示反应物、生成物之间的质量比、微粒个数比
书写原则
以客观事实为依据
遵守质量守恒定律
书写步骤
应用
1.写
方法
—质量守恒定律
—最小公倍数法、观察法等
5.查
—检查化学方程式
4.注—
注明条件以及生成物的状态“↓、↑”
—将短线改为等号
3.等
2.配
依据
—短线左边反应物,右边生成物
复习总结
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
