人教版化学九上第三单元课题2原子结构(共56张PPT)
文档属性
| 名称 | 人教版化学九上第三单元课题2原子结构(共56张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 804.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-30 10:09:55 | ||
图片预览









文档简介
课件56张PPT。(1)原子的结构:原子
(一个原子只有一个原子核) (2) 核外电子占 据 原 子 的 绝 大 部 分 体 积.
每个电子带一个单位的负电荷
每个质子带一个单位的正电荷
不带电复习上节知识原子构成的规律: ⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)⑵、原子不显电性。 ⑶、原子中不一定含有中子。
⑷、不种类的原子,质子数和电子数都不相同。四、分子与原子的比较学习目标1、知道原子核外电子排布的规律。2、了解原子最外层电子数与元素性质的关系。
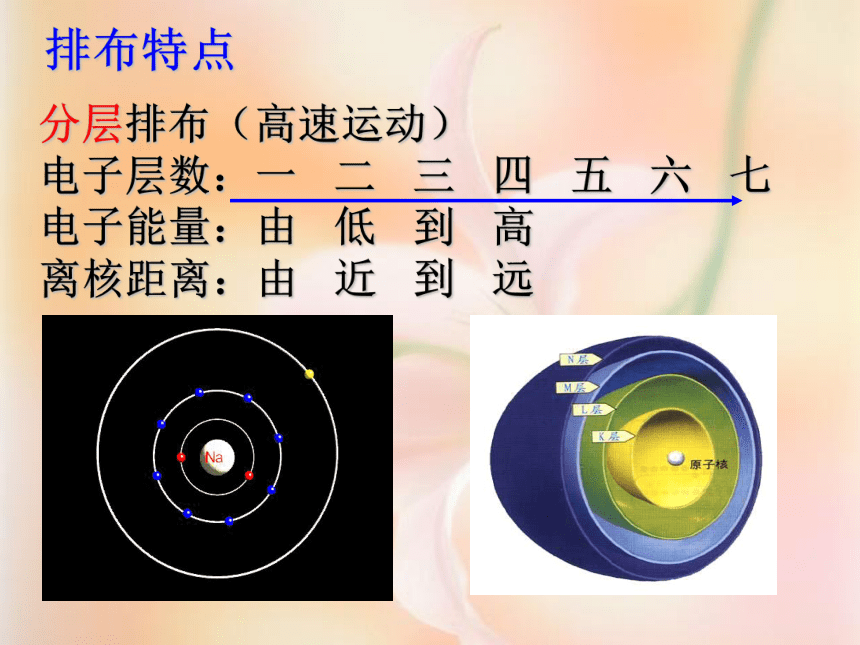
学习重点了解原子最外层电子数与元素性质的关系。 学习难点初步了解离子的形成过程。 3、了解离子的形成过程。 自学指导(一) 观察课本第54页图3-12,4分钟后,完成下列问题:1、核外电子排布有什么规律?① 原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个(只有1层的不超过2个)。② 核外电子总是先排在能量较低的电子层,排满第一层2个电子,再排第二层,排满第二层8个电子,再排第三层.(先排内层, 后排外层 )2、各类元素最外层电子数有什么特点? 电子的能量低,就在离核近的区域运动;反之,电子的能量高就在离核远的区域运动.排布特点分层排布(高速运动)
电子层数:一 二 三 四 五 六 七
电子能量:由 低 到 高
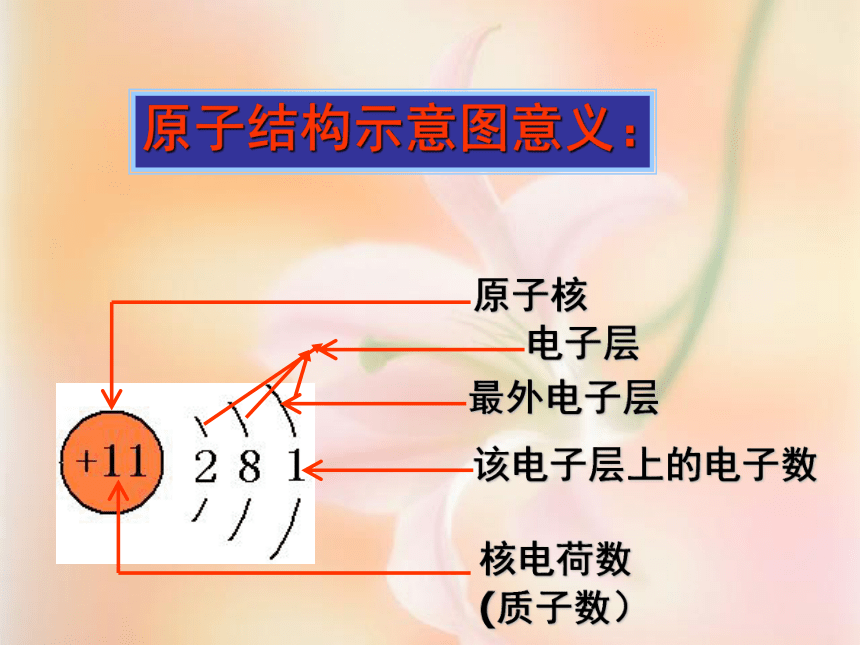
离核距离:由 近 到 远原子结构示意图意义:(1)、画法 :画圆圈,标核电,弧线呈扇面,数字一条线 。 圆圈和圆圈内的数字分别表示原子核和质子数
弧线表示电子层;
弧线上的数字表示该电子层上排布的电子数(2)、含义:【思考】先对下列元素进行分类,再分析各类元素的原子核外电子排布有什么特点?金属元素的原子最外层电子数一般少于4个非金属元素的原子最外层电子数一般
等于或多于4个稀有气体元素的原子最外层电子数一般等于8个,氦为2个。氦氢 1.稀有气体元素的最外层电子数等于8(氦元素是2).把最外层电子数是8(最外层是第一层时,电子数是2)的结构,称为稳定结构.2.金属元素的最外层电子数一般小于4,在化学变化中容易失去最外层电子,形成稳定结构.3.非金属元素的最外层电子数一般大于等于4,在化学变化中容易得到电子,而形成稳定结构. 4. 原子的最外层电子数决定了元素的化学性质原子最外层电子数决定元素的化学性质结构性质决定一般少于4个
一般等于或多于4个8个(氦为2个)
不稳定不稳定稳定易失去最外层电子而达稳定结构
易得到电子而达稳定结构不易失去也不易得到电子认真阅读课本55页2-3自然段。观察图3-13,3分钟后完成下列问题:1、离子是如何形成的? 3、怎样判断阴离子、阳离子、原子? 2、什么叫离子?分为几类? 离子是由原子失去或得到电子形成的。 根据原子结构示意图质子数和中子数的大小关系来判断。带电的原子或原子团叫做离子。分为阳离子和阴离子两类。自主学习(一)四、分子与原子的比较一自信学前展示1、学生分组回忆稀有气体、金属和非金属原子核外电子的排布特点?
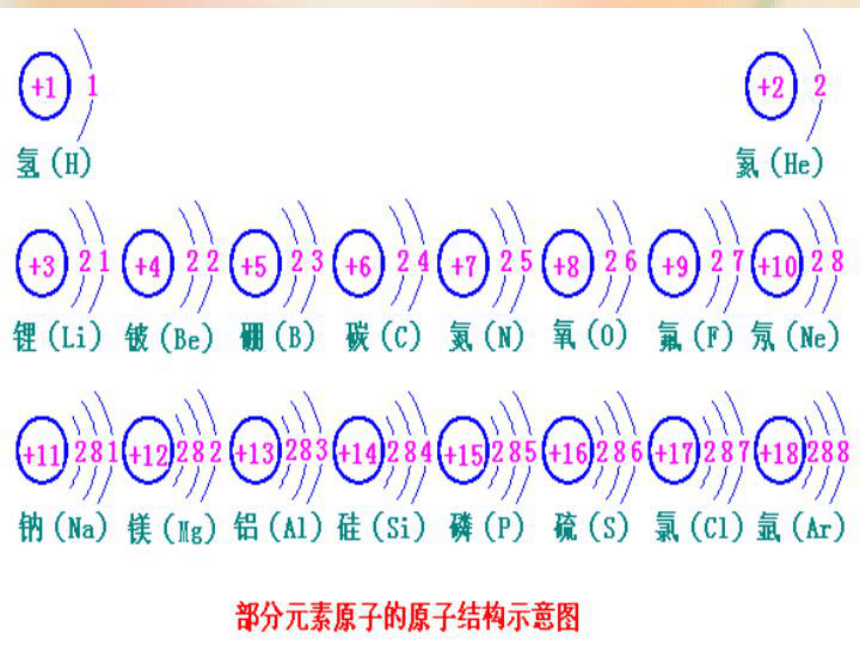
2、回忆1—20号原子的名称排序及元素符号?
某天放学后,小建和小康一起到学校附近的文具店买圆珠笔.圆珠笔的价格为8元,小建的钱包里有9元,要买一支圆珠笔绝对没问题,可是,小康只有7元,怎么办呢?
向来乐于助人的小建,不假思索的把自己多余的1元借给小康,这样,他俩都可以买下圆珠笔.你知道在化学世界里,元素的原子之间也懂得发扬互相帮助的精神吗?精彩激趣导入故事感知四、分子与原子的比较一离子的形成认真阅读课本55页2-3自然段。小组成员互相完成下列问题:1、离子是如何形成的?举例说明 3、怎样判断阴离子、阳离子、原子? 2、什么叫离子?分为几类? 快乐自主学习(一)钠原子和氯原子钠离子和氯离子+11281+1128质子数核外电子数=质子数核外电子数>+17287+17288NaCl质子数核外电子数=质子数
核外电子数<一、离子的形成失去一个电子得到一个电子阳离子阴离子 阳离子:带正电荷的原子
阴离子:带负电荷的原子举例Als2.离子归纳总结1.离 子:带电荷的原子
离子所带的电荷数=原子得失的电子数离子所带的电荷数=核电荷数—核外电子数判断:微粒A是 微粒B是 ,
微粒C是 。Al3+Cl_A B CO练练吧原子:核内质子数 核外电子数阳离子:核内质子数 核外电子数>阴离子:核内质子数 核外电子数<=带电荷的原子团也叫离子碳酸根离子硫酸根离子硝酸根离子氢氧根离子铵根离子拓展延伸4、离子符号如何表示?快乐自主学习(二)5、离子符号表示的意义?6、我们吃的食盐(氯化钠NaCl )是如何形成的?认真阅读课本55页2-3自然段。小组成员互相完成下列问题:3、离子的表示方法—离子符号在元素符号或原子团的右上角先写数字后标正负(数字为1时,1省略不写)Na+Cl-Al3+S2-NH4+OH-Al3+34、离子符号表示的意义离子符号前面的系数只表示离子的个数练练吧离子符号右上角数字表示一个离子所带电荷数激情合作探究阳离子阴离子氯化纳(NaCl)的形成过程 5、离子化合物:由阴、阳离子相互作用而形成的化合物离子也是构成物质的粒子1.原子和阴,阳离子之间是怎样相互转化的?2.原子与离子之间有什么区别和联系?
失电子得电子得电子失电子阴离子阳离子 原子 讨论五、构成物质的粒子(分子、原子离子都是构成物质的基本粒子)1、由分子构成的物质,分子是保持其化学性质的最小粒子水,大多数气体,蔗糖,酒精等物质都是由分子构成2、由原子构成的物质,原子是保持其化学性质的最小粒子金属,固体非金属(碘除外),稀有气体都是由原子构成3、由离子构成的物质,阴、阳离子是保持其化学性质的最小粒子氯化钠是由钠离子和氯离子构成的,保持氯化钠化学性质的最小粒子是钠离子和氯离子魅力精讲点拨1.下列粒子中表示带2个单位正电荷的阳离子的是
多元拓展提升一( )C( ) A.一定失去电子 B.一定得到电子
C.电子层一定变化 D.得失电子都可能D2.一种元素的原子变成离子时( )D4.某粒子结构示意图为则该粒子是( )A.一定是稀有气体原子 B.一定是阳离子
C.一定是阴离子 D.以上三种都有可能3.下列粒子结构示意图中,表示阴离子的是D一.写出氟离子,锂离子,钾离子,钙离子的离子符号
并说出各离子符号所表示的意义?二.说出下面这些元素符号,离子符号前面数字的意思拓展提升二
1.如果该图表示的是原子,X值为___,
该原子的符号是____。
2.如果该图表示的是带2个单位正电荷
的阳离子,X值为___,符号是____。
3.如果该图表示的是带2个单位负电荷
的阴离子,X值为___,符号是____。10Ne128根据右边的结构图回答:能力提高1、离子的概念
2、离子的形成
3、离子的种类——原子和离子的区别和联系
4、离子符号的书写和读法
5、离子符号的意义
6、构成物质的粒子
补充知识:几种常见原子团的读法和写法课堂小结作业布置课后习题57页阴阳离子之间由于静电作用而结合成稳定的不带电性的化合物如:NaCl讨论:镁元素和氯元素之间怎么化合成稳定的化合物Mg ClClMgCl2再见!心灵沟通 化学世界里,元素的原子是怎样发挥互相帮助的精神的?
同学们在日常生活,学习中有没有过互相帮助的经历?请大家谈一谈阴阳离子之间由于静电作用而结合成稳定的不带电性的化合物如:NaCl讨论:镁元素和氯元素之间怎么化合成稳定的化合物Mg ClClMgCl2离子化合物:由阴、阳离子相互作用而形成的化合物常见的离子化合物有:注意由金属元素和非金属元素形成的化合物一般都是离子化合物1.原子和阴,阳离子之间是怎样相互转化的?2.原子与离子之间有什么区别和联系?
失电子得电子得电子失电子阴离子阳离子 原子 讨论 5.由下面的卡通图分析得出的结论错误的是( )A.钠原子在化学反应中容易失去电子 B.钠原子与钠离子都不显电性
C.氯原子得一个电子形成氯离子 D.氯化钠由氯离子和钠离子构成D拓展延伸带电荷的原子团也叫离子
1.如果该图表示的是原子,X值为___,
该原子的符号是____。
2.如果该图表示的是带2个单位正电荷
的阳离子,X值为___,符号是____。
3.如果该图表示的是带2个单位负电荷
的阴离子,X值为___,符号是____。能力提高:10Ne128根据右边的结构图回答:5、离子的表示方法:离子符号在元素符号或原子团的右上角标出离子所带的电荷数及电荷的正负。(先写数字后标性质,当离子所带电荷数为1时,1不写。)Na+Cl-Al3+S2-离子所带的电荷数=原子得失的电子数离子所带的电荷数=核电荷数—核外电子数练习:写出下列离子的符号:氧离子、氟离子、镁离子、钾离子、钙离子NH4+OH-二、相对原子质量:一个氢原子的质量:
一个氧原子的质量:0.00000000000000000000000000167Kg0.00000000000000000000000002657Kg一个碳原子质量:1.67×10-27Kg相对原子量的定义:1.表达式:Ar =m(某原子)m(C12)×1/12= 12m(某原子)m(C12)2.单位:为“1”,通常不写,不表示原子的实际质量(符号为Ar)引伸:以C12原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,即为该原子的相对原子质量4.一个质子、中子和氢原子的相对原子质量均约等于13.相对原子质量 质子数+中子数=——原子的质量集中在原子核上练习:1.1992年,我国科学家首次发现了汞元素的一
种新原子。这种汞原子的相对原子质量为208,
核电荷数为80,这种汞原子的中子数为( )
A、80 B、128 C、208 D、288
2.相对原子质量是
A.原子质量的简称 B.原子数量的简称
C.原子质量与一种碳原子质量的1/12的比
D.原子的实际质量
3.原子中决定相对原子质量大小的主要粒子是
A.质子 B.中子和电子
C. 质子和中子 D.质子和电子7.下列物质各1g,其中所含原子数最多的是( ) A.Fe B.Al C.P D.C 8.在分子、原子、原子核、质子、中子、电子等粒子,找出符合下列条件的粒子,填在相应的空格内:①能直接构成纯净物的是( ) ②能保持物质化学性质的是( ) ③化学变化中的最小粒子是( ) ④带正电荷的粒子是( ) ⑤不显电性的是( ) ⑥质量最小的是( ) ⑦质量与氢原子质量近似相等的是( ) ⑧在同一原子中数目相等的是
(一个原子只有一个原子核) (2) 核外电子占 据 原 子 的 绝 大 部 分 体 积.
每个电子带一个单位的负电荷
每个质子带一个单位的正电荷
不带电复习上节知识原子构成的规律: ⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)⑵、原子不显电性。 ⑶、原子中不一定含有中子。
⑷、不种类的原子,质子数和电子数都不相同。四、分子与原子的比较学习目标1、知道原子核外电子排布的规律。2、了解原子最外层电子数与元素性质的关系。
学习重点了解原子最外层电子数与元素性质的关系。 学习难点初步了解离子的形成过程。 3、了解离子的形成过程。 自学指导(一) 观察课本第54页图3-12,4分钟后,完成下列问题:1、核外电子排布有什么规律?① 原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个(只有1层的不超过2个)。② 核外电子总是先排在能量较低的电子层,排满第一层2个电子,再排第二层,排满第二层8个电子,再排第三层.(先排内层, 后排外层 )2、各类元素最外层电子数有什么特点? 电子的能量低,就在离核近的区域运动;反之,电子的能量高就在离核远的区域运动.排布特点分层排布(高速运动)
电子层数:一 二 三 四 五 六 七
电子能量:由 低 到 高
离核距离:由 近 到 远原子结构示意图意义:(1)、画法 :画圆圈,标核电,弧线呈扇面,数字一条线 。 圆圈和圆圈内的数字分别表示原子核和质子数
弧线表示电子层;
弧线上的数字表示该电子层上排布的电子数(2)、含义:【思考】先对下列元素进行分类,再分析各类元素的原子核外电子排布有什么特点?金属元素的原子最外层电子数一般少于4个非金属元素的原子最外层电子数一般
等于或多于4个稀有气体元素的原子最外层电子数一般等于8个,氦为2个。氦氢 1.稀有气体元素的最外层电子数等于8(氦元素是2).把最外层电子数是8(最外层是第一层时,电子数是2)的结构,称为稳定结构.2.金属元素的最外层电子数一般小于4,在化学变化中容易失去最外层电子,形成稳定结构.3.非金属元素的最外层电子数一般大于等于4,在化学变化中容易得到电子,而形成稳定结构. 4. 原子的最外层电子数决定了元素的化学性质原子最外层电子数决定元素的化学性质结构性质决定一般少于4个
一般等于或多于4个8个(氦为2个)
不稳定不稳定稳定易失去最外层电子而达稳定结构
易得到电子而达稳定结构不易失去也不易得到电子认真阅读课本55页2-3自然段。观察图3-13,3分钟后完成下列问题:1、离子是如何形成的? 3、怎样判断阴离子、阳离子、原子? 2、什么叫离子?分为几类? 离子是由原子失去或得到电子形成的。 根据原子结构示意图质子数和中子数的大小关系来判断。带电的原子或原子团叫做离子。分为阳离子和阴离子两类。自主学习(一)四、分子与原子的比较一自信学前展示1、学生分组回忆稀有气体、金属和非金属原子核外电子的排布特点?
2、回忆1—20号原子的名称排序及元素符号?
某天放学后,小建和小康一起到学校附近的文具店买圆珠笔.圆珠笔的价格为8元,小建的钱包里有9元,要买一支圆珠笔绝对没问题,可是,小康只有7元,怎么办呢?
向来乐于助人的小建,不假思索的把自己多余的1元借给小康,这样,他俩都可以买下圆珠笔.你知道在化学世界里,元素的原子之间也懂得发扬互相帮助的精神吗?精彩激趣导入故事感知四、分子与原子的比较一离子的形成认真阅读课本55页2-3自然段。小组成员互相完成下列问题:1、离子是如何形成的?举例说明 3、怎样判断阴离子、阳离子、原子? 2、什么叫离子?分为几类? 快乐自主学习(一)钠原子和氯原子钠离子和氯离子+11281+1128质子数核外电子数=质子数核外电子数>+17287+17288NaCl质子数核外电子数=质子数
核外电子数<一、离子的形成失去一个电子得到一个电子阳离子阴离子 阳离子:带正电荷的原子
阴离子:带负电荷的原子举例Als2.离子归纳总结1.离 子:带电荷的原子
离子所带的电荷数=原子得失的电子数离子所带的电荷数=核电荷数—核外电子数判断:微粒A是 微粒B是 ,
微粒C是 。Al3+Cl_A B CO练练吧原子:核内质子数 核外电子数阳离子:核内质子数 核外电子数>阴离子:核内质子数 核外电子数<=带电荷的原子团也叫离子碳酸根离子硫酸根离子硝酸根离子氢氧根离子铵根离子拓展延伸4、离子符号如何表示?快乐自主学习(二)5、离子符号表示的意义?6、我们吃的食盐(氯化钠NaCl )是如何形成的?认真阅读课本55页2-3自然段。小组成员互相完成下列问题:3、离子的表示方法—离子符号在元素符号或原子团的右上角先写数字后标正负(数字为1时,1省略不写)Na+Cl-Al3+S2-NH4+OH-Al3+34、离子符号表示的意义离子符号前面的系数只表示离子的个数练练吧离子符号右上角数字表示一个离子所带电荷数激情合作探究阳离子阴离子氯化纳(NaCl)的形成过程 5、离子化合物:由阴、阳离子相互作用而形成的化合物离子也是构成物质的粒子1.原子和阴,阳离子之间是怎样相互转化的?2.原子与离子之间有什么区别和联系?
失电子得电子得电子失电子阴离子阳离子 原子 讨论五、构成物质的粒子(分子、原子离子都是构成物质的基本粒子)1、由分子构成的物质,分子是保持其化学性质的最小粒子水,大多数气体,蔗糖,酒精等物质都是由分子构成2、由原子构成的物质,原子是保持其化学性质的最小粒子金属,固体非金属(碘除外),稀有气体都是由原子构成3、由离子构成的物质,阴、阳离子是保持其化学性质的最小粒子氯化钠是由钠离子和氯离子构成的,保持氯化钠化学性质的最小粒子是钠离子和氯离子魅力精讲点拨1.下列粒子中表示带2个单位正电荷的阳离子的是
多元拓展提升一( )C( ) A.一定失去电子 B.一定得到电子
C.电子层一定变化 D.得失电子都可能D2.一种元素的原子变成离子时( )D4.某粒子结构示意图为则该粒子是( )A.一定是稀有气体原子 B.一定是阳离子
C.一定是阴离子 D.以上三种都有可能3.下列粒子结构示意图中,表示阴离子的是D一.写出氟离子,锂离子,钾离子,钙离子的离子符号
并说出各离子符号所表示的意义?二.说出下面这些元素符号,离子符号前面数字的意思拓展提升二
1.如果该图表示的是原子,X值为___,
该原子的符号是____。
2.如果该图表示的是带2个单位正电荷
的阳离子,X值为___,符号是____。
3.如果该图表示的是带2个单位负电荷
的阴离子,X值为___,符号是____。10Ne128根据右边的结构图回答:能力提高1、离子的概念
2、离子的形成
3、离子的种类——原子和离子的区别和联系
4、离子符号的书写和读法
5、离子符号的意义
6、构成物质的粒子
补充知识:几种常见原子团的读法和写法课堂小结作业布置课后习题57页阴阳离子之间由于静电作用而结合成稳定的不带电性的化合物如:NaCl讨论:镁元素和氯元素之间怎么化合成稳定的化合物Mg ClClMgCl2再见!心灵沟通 化学世界里,元素的原子是怎样发挥互相帮助的精神的?
同学们在日常生活,学习中有没有过互相帮助的经历?请大家谈一谈阴阳离子之间由于静电作用而结合成稳定的不带电性的化合物如:NaCl讨论:镁元素和氯元素之间怎么化合成稳定的化合物Mg ClClMgCl2离子化合物:由阴、阳离子相互作用而形成的化合物常见的离子化合物有:注意由金属元素和非金属元素形成的化合物一般都是离子化合物1.原子和阴,阳离子之间是怎样相互转化的?2.原子与离子之间有什么区别和联系?
失电子得电子得电子失电子阴离子阳离子 原子 讨论 5.由下面的卡通图分析得出的结论错误的是( )A.钠原子在化学反应中容易失去电子 B.钠原子与钠离子都不显电性
C.氯原子得一个电子形成氯离子 D.氯化钠由氯离子和钠离子构成D拓展延伸带电荷的原子团也叫离子
1.如果该图表示的是原子,X值为___,
该原子的符号是____。
2.如果该图表示的是带2个单位正电荷
的阳离子,X值为___,符号是____。
3.如果该图表示的是带2个单位负电荷
的阴离子,X值为___,符号是____。能力提高:10Ne128根据右边的结构图回答:5、离子的表示方法:离子符号在元素符号或原子团的右上角标出离子所带的电荷数及电荷的正负。(先写数字后标性质,当离子所带电荷数为1时,1不写。)Na+Cl-Al3+S2-离子所带的电荷数=原子得失的电子数离子所带的电荷数=核电荷数—核外电子数练习:写出下列离子的符号:氧离子、氟离子、镁离子、钾离子、钙离子NH4+OH-二、相对原子质量:一个氢原子的质量:
一个氧原子的质量:0.00000000000000000000000000167Kg0.00000000000000000000000002657Kg一个碳原子质量:1.67×10-27Kg相对原子量的定义:1.表达式:Ar =m(某原子)m(C12)×1/12= 12m(某原子)m(C12)2.单位:为“1”,通常不写,不表示原子的实际质量(符号为Ar)引伸:以C12原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,即为该原子的相对原子质量4.一个质子、中子和氢原子的相对原子质量均约等于13.相对原子质量 质子数+中子数=——原子的质量集中在原子核上练习:1.1992年,我国科学家首次发现了汞元素的一
种新原子。这种汞原子的相对原子质量为208,
核电荷数为80,这种汞原子的中子数为( )
A、80 B、128 C、208 D、288
2.相对原子质量是
A.原子质量的简称 B.原子数量的简称
C.原子质量与一种碳原子质量的1/12的比
D.原子的实际质量
3.原子中决定相对原子质量大小的主要粒子是
A.质子 B.中子和电子
C. 质子和中子 D.质子和电子7.下列物质各1g,其中所含原子数最多的是( ) A.Fe B.Al C.P D.C 8.在分子、原子、原子核、质子、中子、电子等粒子,找出符合下列条件的粒子,填在相应的空格内:①能直接构成纯净物的是( ) ②能保持物质化学性质的是( ) ③化学变化中的最小粒子是( ) ④带正电荷的粒子是( ) ⑤不显电性的是( ) ⑥质量最小的是( ) ⑦质量与氢原子质量近似相等的是( ) ⑧在同一原子中数目相等的是
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
