2019年新人教版第五单元《化学方程式》5.1质量守恒定律基础练习(word版有答案)
文档属性
| 名称 | 2019年新人教版第五单元《化学方程式》5.1质量守恒定律基础练习(word版有答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 154.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-10-30 00:00:00 | ||
图片预览

文档简介
第五单元《化学方程式》5.1质量守恒定律基础练习
一、选择题:
1、在化学反应前后,一定不变的是( )
①原子数目?②分子数目?③分子种类?④物质种类?⑤元素化合价⑥原子质量?⑦物质的总质量??⑧元素种类
A.①②⑥⑦ B.①⑥⑦⑧ C.①② D.⑦⑧
2、二氧化锰和浓盐酸共热会产生一种黄绿色的气体,该气体是( )
A.O2 B.HCl C.Cl2 D.SO2
3、“催化转化器”可将尾气中的有毒气体处理为无污染的气体。如图为该反应的微观示意图。下列说法正确的是( )
A.该反应前后原子数目发生改变
B.该反应中四种物质均为化合物
C.乙、丙中所含元素种类相同
D.甲、丁中同种元素化合价相同
4、推理是学习化学的一种重要方法,但推理必须科学、严谨。下列推理正确的是( )
A.木炭在氧气中能燃烧,所以氧气具有可燃性
B.化学反应前后原子的种类不变,所以反应前后元素的种类一定不变
C.原子核是由质子和中子构成的,故所有原子核中都一定含有质子和中子
D.催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂
5、在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表所示,则以下判断错误的是( )
物质
甲
乙
丙
丁
反应前质量/g
64
10
1
16
反应后质量/g
0
42
1
a
A.甲有64克参加反应,一定是反应物
B.乙反应后质量增多,一定是生成物
C.丙反应前后质量不变,一定是催化剂
D.丁反应后的质量a=48克
6、用作漂泊剂等的过二硫酸钾(K2S2O8)在高于100℃的条件下能发生反应:2K2S2O82K2SO4+2SO3↑+O2↑,则有( )
A.K2S2O8中的硫元素显+6价
B.该反应属于化合反应
C.生成物K2SO4属于氧化物
D.反应前后氧原子数目不变
7、某同学将蜡烛燃烧后的蜡油收集起来,发现质量变小。下列说法中,正确的是( )
A.蜡烛减少的质量一定等于生成物的质量
B.要分析此现象,必须考虑所有的反应物和生成物
C.燃烧后各生成物的质量一定等于燃烧前蜡烛的质量
D.蜡烛燃烧后质量变小,说明蜡烛燃烧时质量不再守恒
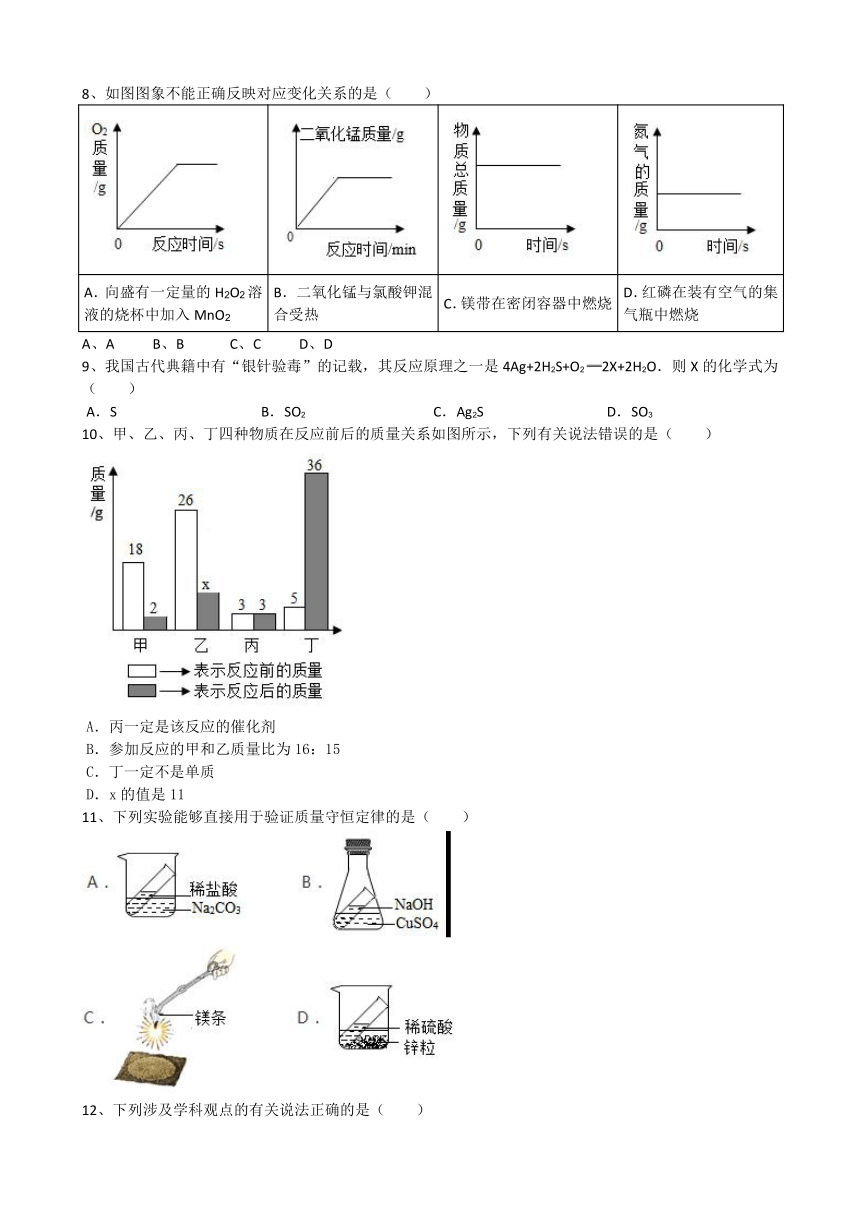
8、如图图象不能正确反映对应变化关系的是( )
?
A.向盛有一定量的H2O2溶液的烧杯中加入MnO2
B.二氧化锰与氯酸钾混合受热
C.镁带在密闭容器中燃烧
D.红磷在装有空气的集气瓶中燃烧
A、A B、B C、C D、D
9、我国古代典籍中有“银针验毒”的记载,其反应原理之一是4Ag+2H2S+O2?═2X+2H2O.则X的化学式为( )
A.S B.SO2 C.Ag2S D.SO3
10、甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
A.丙一定是该反应的催化剂
B.参加反应的甲和乙质量比为16:15
C.丁一定不是单质
D.x的值是11
11、下列实验能够直接用于验证质量守恒定律的是( )
12、下列涉及学科观点的有关说法正确的是( )
A.守恒观:化学反应前后分子个数一定不变
B.微粒观:水是由氢原子和氧原子构成的
C.转化观:氧气和水在一定条件下可相互转化
D.结构观:氯原子和氯离子的核外电子数不同,属于不同种元素
13、尿素[CONH2)2]是一种常用的化肥如图是工业上生产尿素的反应微观示意图,下列说法正确的是( )
A.D的化学式是CO2
B.该图没有反映出质量守恒定律
C.B和D所含的原子种类相同
D.A物质中氮、氢元素的质量比是1:3
14、已知某反应2A+B=3C+D,若15gA和10gB恰好完全反应生成5gC,则12gA和10gB反应能生成D为( )
A.2.5g B.5g C.16g D.10g
15、已知一定质量的纯净物A跟32g氧气恰好完全反应,生成22g二氧化碳和18g水,下列说法错误的是( )
A.参加反应的A的质量是8g
B.物质A中一定含有碳、氢元素,可能含有氧元素
C.该反应中氧气和二氧化碳的化学计量数之比为2:1
D.物质A的化学式可能是CH4
二、填空题:
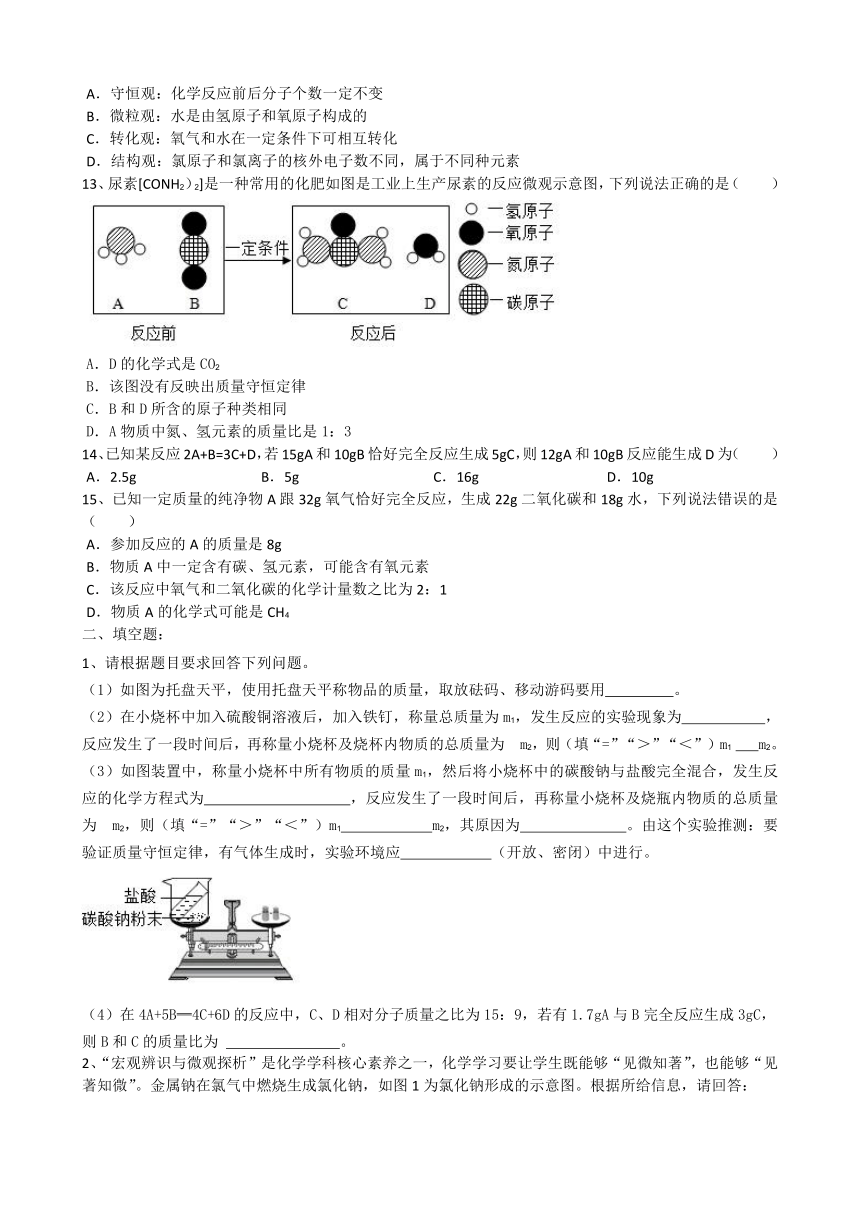
1、请根据题目要求回答下列问题。 (1)如图为托盘天平,使用托盘天平称物品的质量,取放砝码、移动游码要用 。 (2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,发生反应的实验现象为 ,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为?m2,则(填“=”“>”“<”)m1 m2。 (3)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,发生反应的化学方程式为 ,反应发生了一段时间后,再称量小烧杯及烧瓶内物质的总质量为?m2,则(填“=”“>”“<”)m1 m2,其原因为 。由这个实验推测:要验证质量守恒定律,有气体生成时,实验环境应 (开放、密闭)中进行。
(4)在4A+5B═4C+6D的反应中,C、D相对分子质量之比为15:9,若有1.7gA与B完全反应生成3gC,则B和C的质量比为 。
2、“宏观辨识与微观探析”是化学学科核心素养之一,化学学习要让学生既能够“见微知著”,也能够“见著知微”。金属钠在氯气中燃烧生成氯化钠,如图1为氯化钠形成的示意图。根据所给信息,请回答:
(1)钠原子的核外电子层数是 ,在化学反应中易 (填“得到”或“失去”)电子。 (2)元素的化学性质主要是由原子的 决定的。 (3)化学反应前后,氯元素的化合价为 。 (4)构成氯化钠的离子是 (填微粒符号)。 (5)自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用如图2表示: ①在A、B、C、D、E中属于单质的是 (填写化学式,下同),属于氧化物的是 。 ②乙图所示反应的基本反应类型为 ;标出物质D中氯元素的化合价 。 ③以甲图为例分析,你能总结出的一条结论是 。
3、如图是验证质量守恒定律的实验。
(1)实验A中气球的作用是 ,实验结束后冷却至室温,气球比原来更瘪的原因是 ,此时将锥形瓶倒置于水中,取下气球,可观察到 。 (2]实验B反应后天平的指针(填“偏左”、“偏右”、“不变”) ,原因是 ,该反应是否符合质量守恒定律? (填“符合”、“不符合”)。
4、质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题。 (1)化学反应前后背定没有变化的是 (填字母序号) ①原子数目②分子数目③元素种类④物质种类⑤原子种类⑥物质的总质量 A.①④⑥B.①③⑤⑥C.①②D.②③⑤ (2)舍勒是最早制得氧气的化学家之一,他获得氧气的其中一种方法是:用二氧化锰与浓硫酸加热:2MnO2+2H2SO4(浓)2MnSO4+2X+O2↑,物质X化学式为 ; (3)镁条在空气中完全燃烧后生成氧化镁固体(只考虑氧气参加反应,下同),化学方程式为 ,若固体质量变化用图1表示,则m2与m1之差表示 的质量。 (4)实验过程中,镁条点燃后实验现象如图2所示,镁条完全燃烧后,称量得知石棉网上留下固体质量反而比反应前镁条还轻,其原因可能是? 。
5、化学方程式是重要的化学用语,质量守恒定律是化学反应中的重要定律。 (1)根据化学方程式能获得的信息是 (填字母序号)。 A.化学反应的条件 B.化学反应的快慢 C.反应物和生成物的质量比 D.化学反应的反应物和生成物 (2)在一密闭容器里放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质
X
Y
Z
W
反应前的质量/g
10
5
20
8
反应后的质量/g
7.2
13.8
10.4
m
①表中m的数值为 。 ②反应中Y和Z变化的质量比为 。 ③若X,Z的相对分子质量之比为7:8,则它们的化学计量数之比 。 (3)无标签试剂瓶中有一种黑色不溶于水的固体,可能是硫化铜或硫化亚铜,查阅资料可知:硫化铜(CuS)和硫化亚铜(Cu2S)在空气中灼烧分别发生下列化学反应: 2CuS+3O22CuO+2SO2?????????????? Cu2S+2O22CuO+SO2 某同学用天平准确称量一定质量的待测黑色固体于坩埚中,在空气中充分灼烧,冷却后再称量剩余固体质量,若灼烧前后固体质量不变,则该固体的化学式 。
参考答案
一、选择题:
1、B 2、C 3、C 4、B 5、C 6、D 7、B 8、B 9、C 10、A
11、B 12、C 13、B 14、C 15、B
二、填空题:
1、答案为:(1)B; (2)铁钉上附着红色物质,溶液由蓝色逐渐变为浅绿色;=; (3)Na2CO3+2HCl═2NaCl+H2O+CO2↑;>;生成的二氧化碳逸散到空气中,依据质量守恒定律,反应前烧杯中反应物的总质量大于反应后烧杯中剩余物的总质量;密闭; (3)4:3。
2、答案: (1)3;失去; (2)最外层电子数; (3)0(价)变为-1(价)。 (4)Na+,Cl-。 (5)①Cl2、O2;H2O; ②分解反应;; ③同种元素在同一个反应中可能显示不同的化合价;
3、解:(1)实验A中气球的作用是平衡装置内外压强,防止瓶塞飞出; 实验结束后冷却至室温,气球比原来更瘪的原因是锥形瓶中的氧气被消耗; 此时将锥形瓶倒置于水中,取下气球,可观察到水进入锥形瓶,进入的体积约占锥形瓶中空气体积的五分之一。 故填:平衡装置内外压强,防止瓶塞飞出;锥形瓶中的氧气被消耗;水进入锥形瓶。 (2)实验B反应后天平的指针偏右,原因是,该反应符合质量守恒定律。 故填:偏右;碳酸钠和盐酸反应生成的二氧化碳逸出装置;符合。
4、解:(1)反应前后原子数目不变,元素种类不变,原子种类不变,物质的总质量不变;反应前后分子数目可能改变,也可能不变,物质种类一定改变。故填:B; (2)利用质量守恒定律反应前后元素种类不变,反应前有2个Mn、8个O、4个H、2个S;反应后有2个Mn、6个O、2个S;故2X中含有4个H,2个O;故X的化学式为H2O;故填:H2O; (3)镁燃烧的化学方程式为:2Mg+O22MgO,若固体质量变化用图1表示,则m2与m1之差表示参加反应的氧气的质量。故填:2Mg+O22MgO;参加反应的氧气; (4)通过观察可知,镁燃烧时,一部分生成的氧化镁扩散到了空气中,会导致石棉网上留下固体质量反而比反应前镁条还轻。故填:部分生成物散逸到空气中。
5、解:(1)根据化学方程式能获得的信息是化学反应的条件,反应物和生成物的质量比,化学反应的反应物和生成物。 故填:ACD。 (2)①表中m的数值为:10+5+20+8-7.2-13.8-10.4=11.6。 故填:11.6。 ②反应中Y和Z变化的质量比为:(13.8-5):(20-10.4)=11:12。 故填:11:12。 ③设它们的化学计量数之比是x:y, 根据题意有:
x:y=1:3, 故填:1:3。 (3)反应的化学方程式及其质量关系为: 2CuS+3O22CuO+2SO2, 192?????160 Cu2S+2O22CuO+SO2, 160?????160 由质量关系可知,在空气中充分灼烧,冷却后再称量剩余固体质量,若灼烧前后固体质量不变,则该固体的化学式是Cu2S。 故填:Cu2S。
一、选择题:
1、在化学反应前后,一定不变的是( )
①原子数目?②分子数目?③分子种类?④物质种类?⑤元素化合价⑥原子质量?⑦物质的总质量??⑧元素种类
A.①②⑥⑦ B.①⑥⑦⑧ C.①② D.⑦⑧
2、二氧化锰和浓盐酸共热会产生一种黄绿色的气体,该气体是( )
A.O2 B.HCl C.Cl2 D.SO2
3、“催化转化器”可将尾气中的有毒气体处理为无污染的气体。如图为该反应的微观示意图。下列说法正确的是( )
A.该反应前后原子数目发生改变
B.该反应中四种物质均为化合物
C.乙、丙中所含元素种类相同
D.甲、丁中同种元素化合价相同
4、推理是学习化学的一种重要方法,但推理必须科学、严谨。下列推理正确的是( )
A.木炭在氧气中能燃烧,所以氧气具有可燃性
B.化学反应前后原子的种类不变,所以反应前后元素的种类一定不变
C.原子核是由质子和中子构成的,故所有原子核中都一定含有质子和中子
D.催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂
5、在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表所示,则以下判断错误的是( )
物质
甲
乙
丙
丁
反应前质量/g
64
10
1
16
反应后质量/g
0
42
1
a
A.甲有64克参加反应,一定是反应物
B.乙反应后质量增多,一定是生成物
C.丙反应前后质量不变,一定是催化剂
D.丁反应后的质量a=48克
6、用作漂泊剂等的过二硫酸钾(K2S2O8)在高于100℃的条件下能发生反应:2K2S2O82K2SO4+2SO3↑+O2↑,则有( )
A.K2S2O8中的硫元素显+6价
B.该反应属于化合反应
C.生成物K2SO4属于氧化物
D.反应前后氧原子数目不变
7、某同学将蜡烛燃烧后的蜡油收集起来,发现质量变小。下列说法中,正确的是( )
A.蜡烛减少的质量一定等于生成物的质量
B.要分析此现象,必须考虑所有的反应物和生成物
C.燃烧后各生成物的质量一定等于燃烧前蜡烛的质量
D.蜡烛燃烧后质量变小,说明蜡烛燃烧时质量不再守恒
8、如图图象不能正确反映对应变化关系的是( )
?
A.向盛有一定量的H2O2溶液的烧杯中加入MnO2
B.二氧化锰与氯酸钾混合受热
C.镁带在密闭容器中燃烧
D.红磷在装有空气的集气瓶中燃烧
A、A B、B C、C D、D
9、我国古代典籍中有“银针验毒”的记载,其反应原理之一是4Ag+2H2S+O2?═2X+2H2O.则X的化学式为( )
A.S B.SO2 C.Ag2S D.SO3
10、甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
A.丙一定是该反应的催化剂
B.参加反应的甲和乙质量比为16:15
C.丁一定不是单质
D.x的值是11
11、下列实验能够直接用于验证质量守恒定律的是( )
12、下列涉及学科观点的有关说法正确的是( )
A.守恒观:化学反应前后分子个数一定不变
B.微粒观:水是由氢原子和氧原子构成的
C.转化观:氧气和水在一定条件下可相互转化
D.结构观:氯原子和氯离子的核外电子数不同,属于不同种元素
13、尿素[CONH2)2]是一种常用的化肥如图是工业上生产尿素的反应微观示意图,下列说法正确的是( )
A.D的化学式是CO2
B.该图没有反映出质量守恒定律
C.B和D所含的原子种类相同
D.A物质中氮、氢元素的质量比是1:3
14、已知某反应2A+B=3C+D,若15gA和10gB恰好完全反应生成5gC,则12gA和10gB反应能生成D为( )
A.2.5g B.5g C.16g D.10g
15、已知一定质量的纯净物A跟32g氧气恰好完全反应,生成22g二氧化碳和18g水,下列说法错误的是( )
A.参加反应的A的质量是8g
B.物质A中一定含有碳、氢元素,可能含有氧元素
C.该反应中氧气和二氧化碳的化学计量数之比为2:1
D.物质A的化学式可能是CH4
二、填空题:
1、请根据题目要求回答下列问题。 (1)如图为托盘天平,使用托盘天平称物品的质量,取放砝码、移动游码要用 。 (2)在小烧杯中加入硫酸铜溶液后,加入铁钉,称量总质量为m1,发生反应的实验现象为 ,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为?m2,则(填“=”“>”“<”)m1 m2。 (3)如图装置中,称量小烧杯中所有物质的质量m1,然后将小烧杯中的碳酸钠与盐酸完全混合,发生反应的化学方程式为 ,反应发生了一段时间后,再称量小烧杯及烧瓶内物质的总质量为?m2,则(填“=”“>”“<”)m1 m2,其原因为 。由这个实验推测:要验证质量守恒定律,有气体生成时,实验环境应 (开放、密闭)中进行。
(4)在4A+5B═4C+6D的反应中,C、D相对分子质量之比为15:9,若有1.7gA与B完全反应生成3gC,则B和C的质量比为 。
2、“宏观辨识与微观探析”是化学学科核心素养之一,化学学习要让学生既能够“见微知著”,也能够“见著知微”。金属钠在氯气中燃烧生成氯化钠,如图1为氯化钠形成的示意图。根据所给信息,请回答:
(1)钠原子的核外电子层数是 ,在化学反应中易 (填“得到”或“失去”)电子。 (2)元素的化学性质主要是由原子的 决定的。 (3)化学反应前后,氯元素的化合价为 。 (4)构成氯化钠的离子是 (填微粒符号)。 (5)自来水消毒过程中常会发生如下化学反应,其反应的微观过程可用如图2表示: ①在A、B、C、D、E中属于单质的是 (填写化学式,下同),属于氧化物的是 。 ②乙图所示反应的基本反应类型为 ;标出物质D中氯元素的化合价 。 ③以甲图为例分析,你能总结出的一条结论是 。
3、如图是验证质量守恒定律的实验。
(1)实验A中气球的作用是 ,实验结束后冷却至室温,气球比原来更瘪的原因是 ,此时将锥形瓶倒置于水中,取下气球,可观察到 。 (2]实验B反应后天平的指针(填“偏左”、“偏右”、“不变”) ,原因是 ,该反应是否符合质量守恒定律? (填“符合”、“不符合”)。
4、质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题。 (1)化学反应前后背定没有变化的是 (填字母序号) ①原子数目②分子数目③元素种类④物质种类⑤原子种类⑥物质的总质量 A.①④⑥B.①③⑤⑥C.①②D.②③⑤ (2)舍勒是最早制得氧气的化学家之一,他获得氧气的其中一种方法是:用二氧化锰与浓硫酸加热:2MnO2+2H2SO4(浓)2MnSO4+2X+O2↑,物质X化学式为 ; (3)镁条在空气中完全燃烧后生成氧化镁固体(只考虑氧气参加反应,下同),化学方程式为 ,若固体质量变化用图1表示,则m2与m1之差表示 的质量。 (4)实验过程中,镁条点燃后实验现象如图2所示,镁条完全燃烧后,称量得知石棉网上留下固体质量反而比反应前镁条还轻,其原因可能是? 。
5、化学方程式是重要的化学用语,质量守恒定律是化学反应中的重要定律。 (1)根据化学方程式能获得的信息是 (填字母序号)。 A.化学反应的条件 B.化学反应的快慢 C.反应物和生成物的质量比 D.化学反应的反应物和生成物 (2)在一密闭容器里放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
物质
X
Y
Z
W
反应前的质量/g
10
5
20
8
反应后的质量/g
7.2
13.8
10.4
m
①表中m的数值为 。 ②反应中Y和Z变化的质量比为 。 ③若X,Z的相对分子质量之比为7:8,则它们的化学计量数之比 。 (3)无标签试剂瓶中有一种黑色不溶于水的固体,可能是硫化铜或硫化亚铜,查阅资料可知:硫化铜(CuS)和硫化亚铜(Cu2S)在空气中灼烧分别发生下列化学反应: 2CuS+3O22CuO+2SO2?????????????? Cu2S+2O22CuO+SO2 某同学用天平准确称量一定质量的待测黑色固体于坩埚中,在空气中充分灼烧,冷却后再称量剩余固体质量,若灼烧前后固体质量不变,则该固体的化学式 。
参考答案
一、选择题:
1、B 2、C 3、C 4、B 5、C 6、D 7、B 8、B 9、C 10、A
11、B 12、C 13、B 14、C 15、B
二、填空题:
1、答案为:(1)B; (2)铁钉上附着红色物质,溶液由蓝色逐渐变为浅绿色;=; (3)Na2CO3+2HCl═2NaCl+H2O+CO2↑;>;生成的二氧化碳逸散到空气中,依据质量守恒定律,反应前烧杯中反应物的总质量大于反应后烧杯中剩余物的总质量;密闭; (3)4:3。
2、答案: (1)3;失去; (2)最外层电子数; (3)0(价)变为-1(价)。 (4)Na+,Cl-。 (5)①Cl2、O2;H2O; ②分解反应;; ③同种元素在同一个反应中可能显示不同的化合价;
3、解:(1)实验A中气球的作用是平衡装置内外压强,防止瓶塞飞出; 实验结束后冷却至室温,气球比原来更瘪的原因是锥形瓶中的氧气被消耗; 此时将锥形瓶倒置于水中,取下气球,可观察到水进入锥形瓶,进入的体积约占锥形瓶中空气体积的五分之一。 故填:平衡装置内外压强,防止瓶塞飞出;锥形瓶中的氧气被消耗;水进入锥形瓶。 (2)实验B反应后天平的指针偏右,原因是,该反应符合质量守恒定律。 故填:偏右;碳酸钠和盐酸反应生成的二氧化碳逸出装置;符合。
4、解:(1)反应前后原子数目不变,元素种类不变,原子种类不变,物质的总质量不变;反应前后分子数目可能改变,也可能不变,物质种类一定改变。故填:B; (2)利用质量守恒定律反应前后元素种类不变,反应前有2个Mn、8个O、4个H、2个S;反应后有2个Mn、6个O、2个S;故2X中含有4个H,2个O;故X的化学式为H2O;故填:H2O; (3)镁燃烧的化学方程式为:2Mg+O22MgO,若固体质量变化用图1表示,则m2与m1之差表示参加反应的氧气的质量。故填:2Mg+O22MgO;参加反应的氧气; (4)通过观察可知,镁燃烧时,一部分生成的氧化镁扩散到了空气中,会导致石棉网上留下固体质量反而比反应前镁条还轻。故填:部分生成物散逸到空气中。
5、解:(1)根据化学方程式能获得的信息是化学反应的条件,反应物和生成物的质量比,化学反应的反应物和生成物。 故填:ACD。 (2)①表中m的数值为:10+5+20+8-7.2-13.8-10.4=11.6。 故填:11.6。 ②反应中Y和Z变化的质量比为:(13.8-5):(20-10.4)=11:12。 故填:11:12。 ③设它们的化学计量数之比是x:y, 根据题意有:
x:y=1:3, 故填:1:3。 (3)反应的化学方程式及其质量关系为: 2CuS+3O22CuO+2SO2, 192?????160 Cu2S+2O22CuO+SO2, 160?????160 由质量关系可知,在空气中充分灼烧,冷却后再称量剩余固体质量,若灼烧前后固体质量不变,则该固体的化学式是Cu2S。 故填:Cu2S。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
