第2章 物质转化与材料利用 实验探究题(课件 35张ppt)
文档属性
| 名称 | 第2章 物质转化与材料利用 实验探究题(课件 35张ppt) | 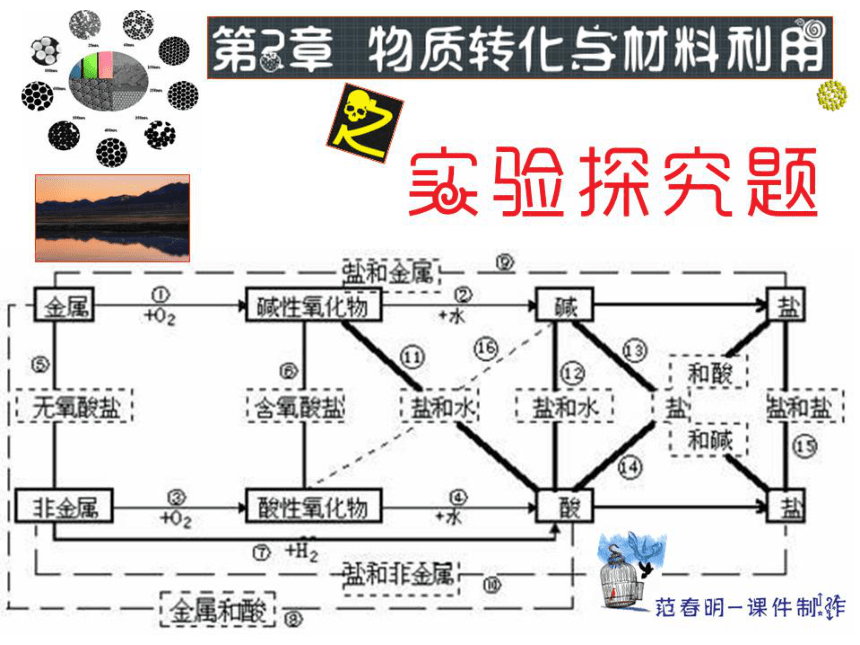 | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-10-30 07:57:29 | ||
图片预览






文档简介
(共52张PPT)
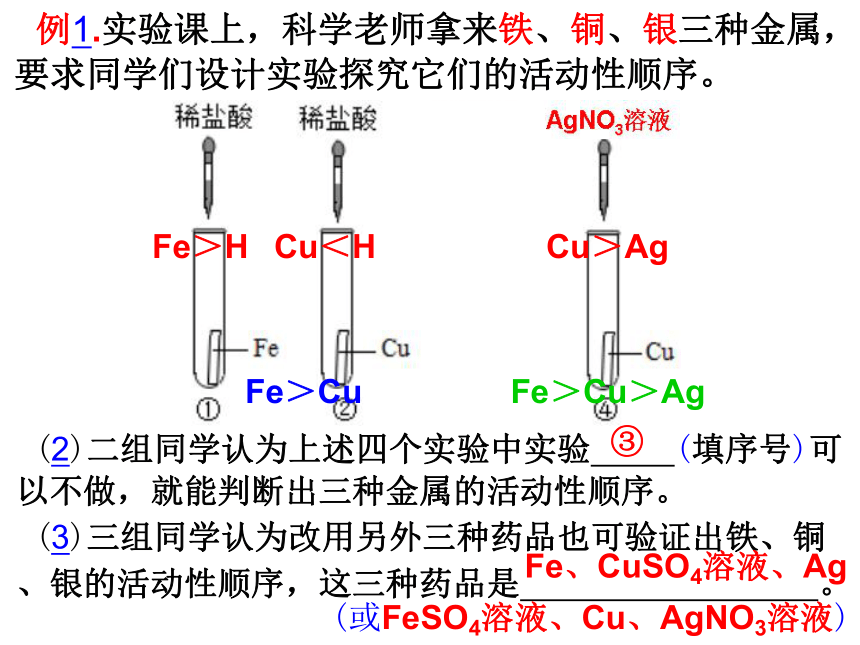
(1)一组同学做了如图所示的①②③三个实验,未能确定其活动性顺序,原因是 ,小明提出再补充实验④,就可验证这三种金属的活动性顺序,则实验④中的X溶液为 。
Cu、Ag均不与盐酸反应,无法比较两者的活动性顺序
AgNO3溶液
Fe>H
Cu<H
Ag<H
Fe>Cu、Ag
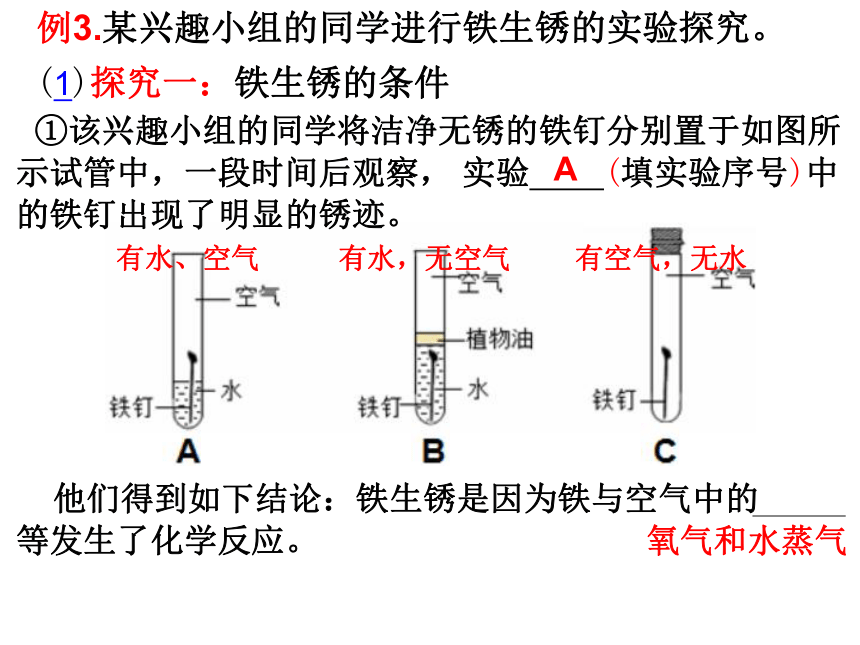
(2)二组同学认为上述四个实验中实验 (填序号)可以不做,就能判断出三种金属的活动性顺序。
(3)三组同学认为改用另外三种药品也可验证出铁、铜
、银的活动性顺序,这三种药品是 。
③
Fe、CuSO4溶液、Ag
(或FeSO4溶液、Cu、AgNO3溶液)
Fe>H
Cu<H
Ag<H
Fe>Cu、Ag
Cu>Ag
Fe>Cu>Ag
有气泡冒出,溶液由无色变为浅绿色
铜丝
铝丝
铝丝表面有一层黑色物质,溶液由浅绿色变无色
Fe>H
Cu<Fe
Al>Fe
(2)将铝丝插入前应进行的操作是 。
(3)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出活动性强弱“Al>Fe>H>Cu”的结论。小华要补充的实验是 。
(4)小强同学认为要得到活动性强弱“Al>Fe>H>Cu
”的结论,不必做补充实验,
只需将小明同学方案中插入
金属的顺序调整即可,你认
为调整后插入金属的顺序是
。
例2.同学们一起探究铝、铁、铜三种金属的活动性
,小刚设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
用砂纸打磨其表面的氧化铝
把铜丝插入稀盐酸中
Cu、Fe、Al
Cu<H
Fe<H
Al>Fe
氧气和水蒸气
A
有水、空气
有水,无空气
有空气,无水
将A装置中的空气换作氮气或二氧化碳
(2)探究二:影响铁生锈快慢的因素
乙同学说他妈妈常说菜刀沾有盐水生锈更快。这种说法对吗?同学们广泛查阅资料。
资料一:导电性强的溶液都可加速铁的生锈。
资料二:海上航行的轮船在与海水接触的部分镶嵌一锌块,能有效减小钢材被腐蚀的速率。
①将实验A中的蒸馏水改为下列液体中的 (填序号,下同),可使铁生锈的速率加快。
a.硫酸钠溶液 b.无水乙醇 c.蔗糖溶液
a
②一些铁制品表面覆盖了某些涂层。不同的涂层被破坏后,铁生锈的速率不同。你认为下列涂层破坏后,铁生锈的速率加大的为 。
a.镀锌铁 b.镀锡铁
③一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是 。
a.银粉 b.铜粉 c.镁粉
(3)交流与思考:写出一种防止菜刀生锈的作法:
。
b
Zn比Fe活泼,先氧化Zn
Fe比Sn活泼,先氧化Fe
因为镁在空气中能形成一层致密坚固的MgO薄膜,隔绝水分和氧气,起到防锈作用。
c
洗净擦干
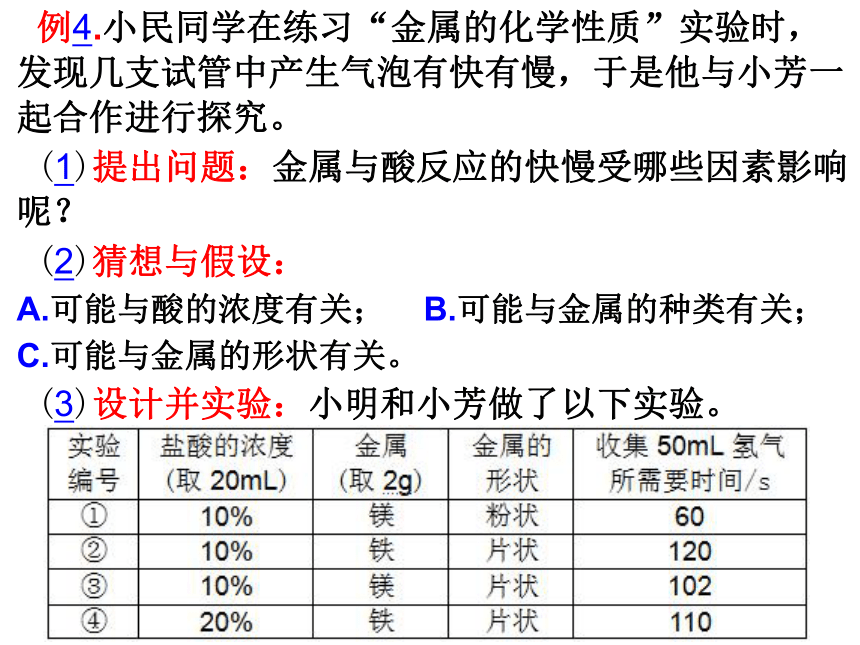
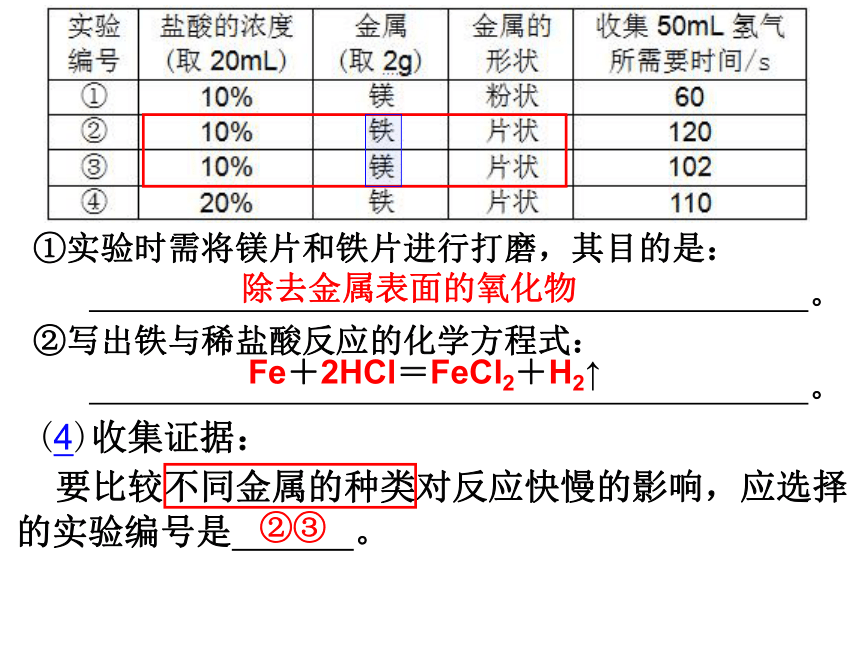
①实验时需将镁片和铁片进行打磨,其目的是:
。
②写出铁与稀盐酸反应的化学方程式:
。
(4)收集证据:
要比较不同金属的种类对反应快慢的影响,应选择的实验编号是 。
除去金属表面的氧化物
Fe+2HCl=FeCl2+H2↑
②③
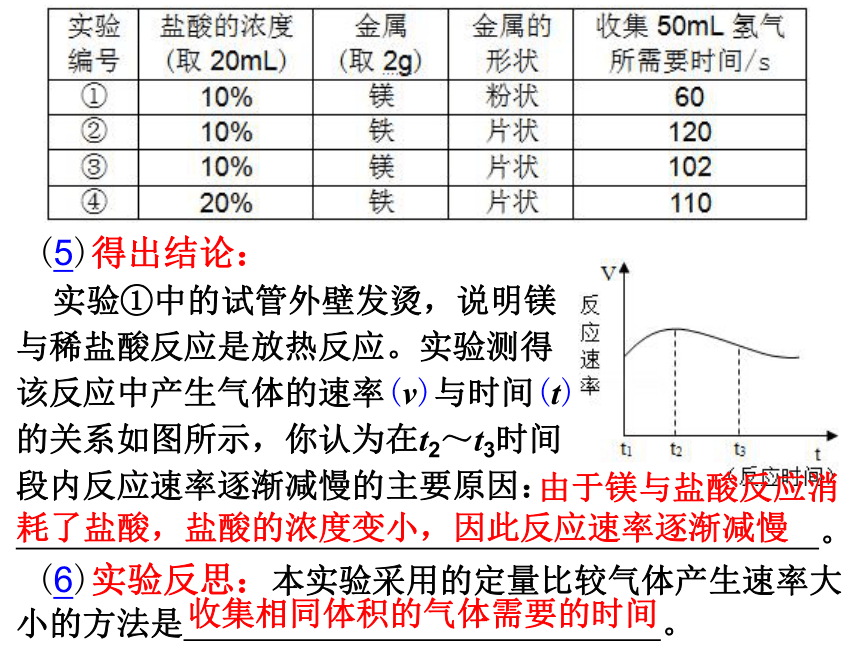
由于镁与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢
收集相同体积的气体需要的时间
浓度
(2)某同学分析实验1、3后得出了如下结论:不同金属的活动性是不同的。其他同学认为这个结论不可靠,你认为他们的理由是 。
(3)在实验1中,有同学用细针去刺破液态铝外的薄膜。观察到里面的液体铝依然没有流出来。实验后,同学们查阅资料获知该薄膜是氧化铝,其熔点明显高于酒精灯火焰的温度,由此推断,刺破薄膜后液态铝会迅速和 反应,重新形成致密的氧化膜,所以液态铝不会流出来。
只用镁、铝做实验,选择的金属样品种类太少
氧气
水和氧气
有氧气,无水
有水,无氧气
有氧气和水
1/5
试管内液面上升
铝易被氧气氧化生成致密
的氧化铝保护膜
M>Al>Cu
M>Al
Al>M>Cu
(4)交流与表达:同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 。
铝表面有一层氧化膜
M表面出现一层红色物质
2Al+3CuSO4=Al2(SO4)3+3Cu
Al>M
M>Cu
Al>Cu
丙
(6)解释与结论:通过以上实验,同学们得出了三种金属的活动性顺序。 (7)评价与反思:实验结束后,同学们对实验过程进行了如下反思:
①影响金属与酸反应快慢的因素,除了相互反应的金属和酸的性质外,还有 (任写一种)。
②探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 (任写一种)进行判断。
反应物接触面积(或反应温度)
与氧气反应的剧烈程度
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
(4)实验结论:上述实验中均未观察到_____色固体生成,由此判断猜想一错误。 实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
红
生成的氢氧化钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀
钠块的大小、硫酸铜溶液的浓度
方案二,隔绝空气加热,能避免钠在空气中被氧化
①为完成该实验,需要补充的一种仪器是 。
②曲线B对应的物质是 。
③请写出铁与稀盐酸反应的化学方程式:
。
④由此实验得到的结论是:
。
托盘天平(或者电子天平)
铁粉
Fe+2HCl=FeCl2+H2↑
金属的颗粒越小(或者金属的表面积越小),与酸反应的速率越快
(2)金属与不同溶质质量分数的盐酸反应的速率不同。
取质量相等的锌片,分别放入6%、25%的足量稀盐酸中。生成氢气的质量为m,反应时间为t,则25
%的盐酸与锌片反应的关系曲线如图乙所示。
①请在该图上补画出6%的盐酸与锌片反应的关系曲线。
②由此实验得到的结论是 。
盐酸的浓度越大,化学反应的速率越快(或者反应物的浓度越大,化学反应的速率越快)
(3)温度对金属与盐酸的反应速率也有影响。
取两个烧杯,分别加入等质量的 (填“同种”或“不同种”)金属,再分别加入足量的溶质质量分数 (填“相同”或“不相同”)的稀盐酸。生成氢气的质量(m)与反应时间(t)的关系如图丙所示,其中曲线C的温度比曲线D的温度高,由此实验得到的结论是 。
同种
相同
温度越高,化学反应的速率越大
有气泡产生,溶液由无色逐渐变为浅绿色
Fe+CuSO4=FeSO4+Cu
Fe>H
Ag<H<Fe
Fe>Cu
C
CuSO4
稀硫酸
蓝
CuO+H2SO4=CuSO4+H2O
氧气和水
取两支试管分别放入等体积的蒸馏水、加入食盐的蒸馏水,并分别放入洁净无锈的铁钉,浸入一半,静置一段时间
放入食盐水的铁钉先生锈,且生锈多
工业生产中用稀盐酸除去铁质器械表面的铁锈,请写出除锈的化学方程式 。
6HCl+Fe2O3=2FeCl3+3H2O
红
氧气浓度
温度
①分析以上实验,二氧化碳会促进铁的生锈,请结合以上实验和你学过的知识大胆分析其原因,你的分析是:
②除此之外,你还能从以上实验中得到的信息有(答一点即可):
由上述实验现象可知:除去二氧化碳的潮湿空气比潮湿的空气生锈少,而铁生锈需要氧气和水,实验1、2均具备,从而说明二氧化碳会促进铁生锈。
酸能更快促进铁生锈(合理均可)
除去水中溶解的氧气
铜生锈需要二氧化碳
氧气、水和二氧化碳
没有二氧化碳
有二氧化碳
(1)一组同学做了如图所示的①②③三个实验,未能确定其活动性顺序,原因是 ,小明提出再补充实验④,就可验证这三种金属的活动性顺序,则实验④中的X溶液为 。
Cu、Ag均不与盐酸反应,无法比较两者的活动性顺序
AgNO3溶液
Fe>H
Cu<H
Ag<H
Fe>Cu、Ag
(2)二组同学认为上述四个实验中实验 (填序号)可以不做,就能判断出三种金属的活动性顺序。
(3)三组同学认为改用另外三种药品也可验证出铁、铜
、银的活动性顺序,这三种药品是 。
③
Fe、CuSO4溶液、Ag
(或FeSO4溶液、Cu、AgNO3溶液)
Fe>H
Cu<H
Ag<H
Fe>Cu、Ag
Cu>Ag
Fe>Cu>Ag
有气泡冒出,溶液由无色变为浅绿色
铜丝
铝丝
铝丝表面有一层黑色物质,溶液由浅绿色变无色
Fe>H
Cu<Fe
Al>Fe
(2)将铝丝插入前应进行的操作是 。
(3)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出活动性强弱“Al>Fe>H>Cu”的结论。小华要补充的实验是 。
(4)小强同学认为要得到活动性强弱“Al>Fe>H>Cu
”的结论,不必做补充实验,
只需将小明同学方案中插入
金属的顺序调整即可,你认
为调整后插入金属的顺序是
。
例2.同学们一起探究铝、铁、铜三种金属的活动性
,小刚设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
用砂纸打磨其表面的氧化铝
把铜丝插入稀盐酸中
Cu、Fe、Al
Cu<H
Fe<H
Al>Fe
氧气和水蒸气
A
有水、空气
有水,无空气
有空气,无水
将A装置中的空气换作氮气或二氧化碳
(2)探究二:影响铁生锈快慢的因素
乙同学说他妈妈常说菜刀沾有盐水生锈更快。这种说法对吗?同学们广泛查阅资料。
资料一:导电性强的溶液都可加速铁的生锈。
资料二:海上航行的轮船在与海水接触的部分镶嵌一锌块,能有效减小钢材被腐蚀的速率。
①将实验A中的蒸馏水改为下列液体中的 (填序号,下同),可使铁生锈的速率加快。
a.硫酸钠溶液 b.无水乙醇 c.蔗糖溶液
a
②一些铁制品表面覆盖了某些涂层。不同的涂层被破坏后,铁生锈的速率不同。你认为下列涂层破坏后,铁生锈的速率加大的为 。
a.镀锌铁 b.镀锡铁
③一些建筑的大门刷上了一层银白色的金属,你认为该金属可能是 。
a.银粉 b.铜粉 c.镁粉
(3)交流与思考:写出一种防止菜刀生锈的作法:
。
b
Zn比Fe活泼,先氧化Zn
Fe比Sn活泼,先氧化Fe
因为镁在空气中能形成一层致密坚固的MgO薄膜,隔绝水分和氧气,起到防锈作用。
c
洗净擦干
①实验时需将镁片和铁片进行打磨,其目的是:
。
②写出铁与稀盐酸反应的化学方程式:
。
(4)收集证据:
要比较不同金属的种类对反应快慢的影响,应选择的实验编号是 。
除去金属表面的氧化物
Fe+2HCl=FeCl2+H2↑
②③
由于镁与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢
收集相同体积的气体需要的时间
浓度
(2)某同学分析实验1、3后得出了如下结论:不同金属的活动性是不同的。其他同学认为这个结论不可靠,你认为他们的理由是 。
(3)在实验1中,有同学用细针去刺破液态铝外的薄膜。观察到里面的液体铝依然没有流出来。实验后,同学们查阅资料获知该薄膜是氧化铝,其熔点明显高于酒精灯火焰的温度,由此推断,刺破薄膜后液态铝会迅速和 反应,重新形成致密的氧化膜,所以液态铝不会流出来。
只用镁、铝做实验,选择的金属样品种类太少
氧气
水和氧气
有氧气,无水
有水,无氧气
有氧气和水
1/5
试管内液面上升
铝易被氧气氧化生成致密
的氧化铝保护膜
M>Al>Cu
M>Al
Al>M>Cu
(4)交流与表达:同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是 。
铝表面有一层氧化膜
M表面出现一层红色物质
2Al+3CuSO4=Al2(SO4)3+3Cu
Al>M
M>Cu
Al>Cu
丙
(6)解释与结论:通过以上实验,同学们得出了三种金属的活动性顺序。 (7)评价与反思:实验结束后,同学们对实验过程进行了如下反思:
①影响金属与酸反应快慢的因素,除了相互反应的金属和酸的性质外,还有 (任写一种)。
②探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据 (任写一种)进行判断。
反应物接触面积(或反应温度)
与氧气反应的剧烈程度
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
(4)实验结论:上述实验中均未观察到_____色固体生成,由此判断猜想一错误。 实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
红
生成的氢氧化钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀
钠块的大小、硫酸铜溶液的浓度
方案二,隔绝空气加热,能避免钠在空气中被氧化
①为完成该实验,需要补充的一种仪器是 。
②曲线B对应的物质是 。
③请写出铁与稀盐酸反应的化学方程式:
。
④由此实验得到的结论是:
。
托盘天平(或者电子天平)
铁粉
Fe+2HCl=FeCl2+H2↑
金属的颗粒越小(或者金属的表面积越小),与酸反应的速率越快
(2)金属与不同溶质质量分数的盐酸反应的速率不同。
取质量相等的锌片,分别放入6%、25%的足量稀盐酸中。生成氢气的质量为m,反应时间为t,则25
%的盐酸与锌片反应的关系曲线如图乙所示。
①请在该图上补画出6%的盐酸与锌片反应的关系曲线。
②由此实验得到的结论是 。
盐酸的浓度越大,化学反应的速率越快(或者反应物的浓度越大,化学反应的速率越快)
(3)温度对金属与盐酸的反应速率也有影响。
取两个烧杯,分别加入等质量的 (填“同种”或“不同种”)金属,再分别加入足量的溶质质量分数 (填“相同”或“不相同”)的稀盐酸。生成氢气的质量(m)与反应时间(t)的关系如图丙所示,其中曲线C的温度比曲线D的温度高,由此实验得到的结论是 。
同种
相同
温度越高,化学反应的速率越大
有气泡产生,溶液由无色逐渐变为浅绿色
Fe+CuSO4=FeSO4+Cu
Fe>H
Ag<H<Fe
Fe>Cu
C
CuSO4
稀硫酸
蓝
CuO+H2SO4=CuSO4+H2O
氧气和水
取两支试管分别放入等体积的蒸馏水、加入食盐的蒸馏水,并分别放入洁净无锈的铁钉,浸入一半,静置一段时间
放入食盐水的铁钉先生锈,且生锈多
工业生产中用稀盐酸除去铁质器械表面的铁锈,请写出除锈的化学方程式 。
6HCl+Fe2O3=2FeCl3+3H2O
红
氧气浓度
温度
①分析以上实验,二氧化碳会促进铁的生锈,请结合以上实验和你学过的知识大胆分析其原因,你的分析是:
②除此之外,你还能从以上实验中得到的信息有(答一点即可):
由上述实验现象可知:除去二氧化碳的潮湿空气比潮湿的空气生锈少,而铁生锈需要氧气和水,实验1、2均具备,从而说明二氧化碳会促进铁生锈。
酸能更快促进铁生锈(合理均可)
除去水中溶解的氧气
铜生锈需要二氧化碳
氧气、水和二氧化碳
没有二氧化碳
有二氧化碳
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
