第2节 金属的化学性质(涉及金属的计算)(课件 21张PPT)
文档属性
| 名称 | 第2节 金属的化学性质(涉及金属的计算)(课件 21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1010.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2019-11-03 00:00:00 | ||
图片预览




文档简介
(共21张PPT)
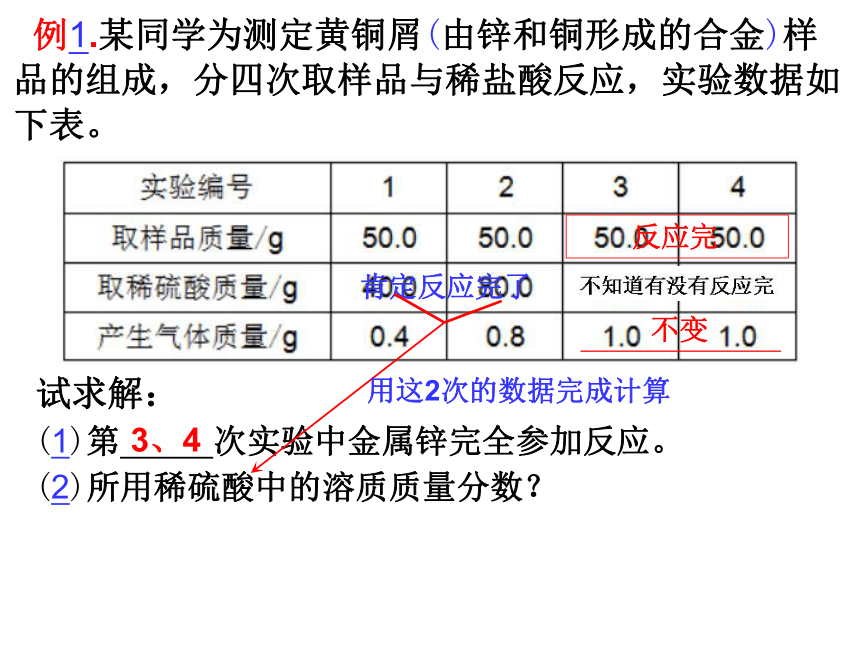
例1.某同学为测定黄铜屑(由锌和铜形成的合金)样品的组成,分四次取样品与稀盐酸反应,实验数据如下表。
试求解:
(1)第 次实验中金属锌完全参加反应。
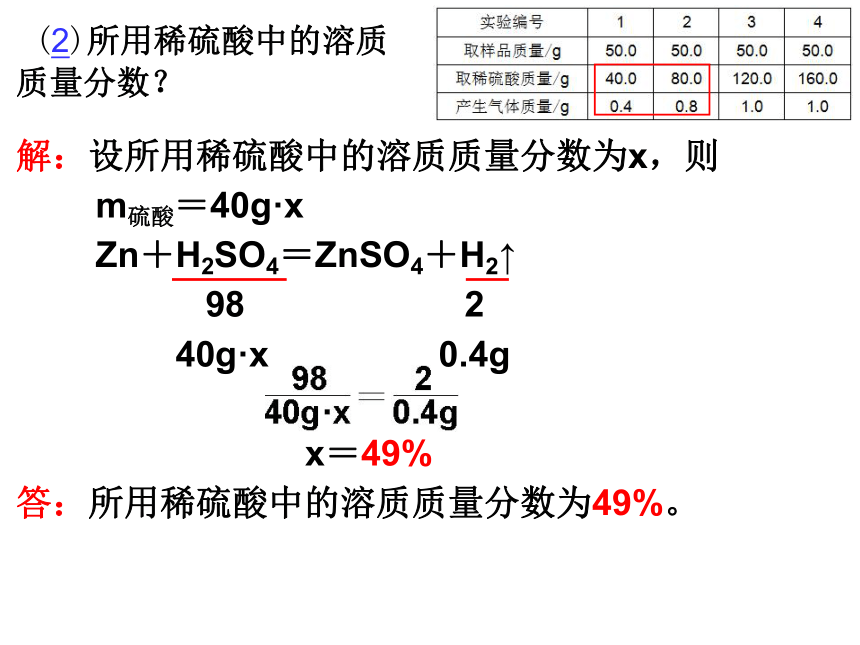
(2)所用稀硫酸中的溶质质量分数?
不变
反应完
3、4
肯定反应完了
用这2次的数据完成计算
解:设所用稀硫酸中的溶质质量分数为x,则
m硫酸=40g·x
Zn+H2SO4=ZnSO4+H2↑
98 2
40g·x 0.4g
x=49%
答:所用稀硫酸中的溶质质量分数为49%。
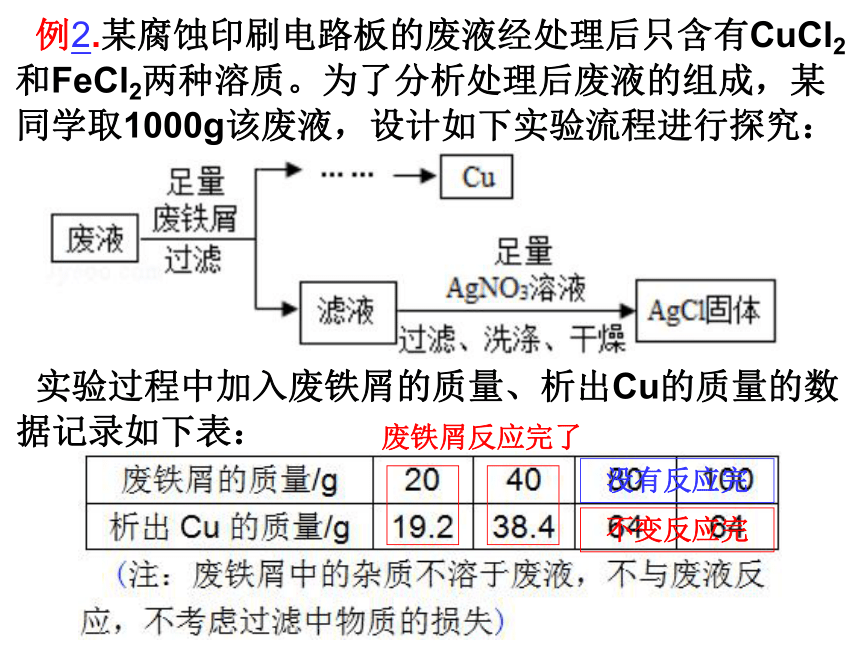
例2.某腐蚀印刷电路板的废液经处理后只含有CuCl2和FeCl2两种溶质。为了分析处理后废液的组成,某同学取1000g该废液,设计如下实验流程进行探究:
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
不变反应完
没有反应完
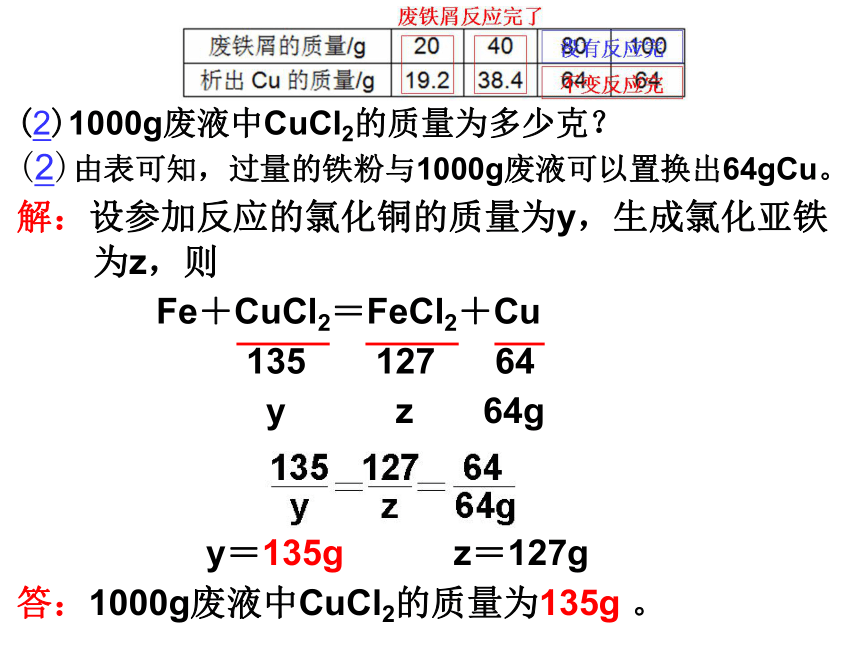
废铁屑反应完了
(1)废铁屑中单质Fe的质量分数为多少?
(1)解:设废铁屑中单质Fe的质量分数为x,则
m铁=20g·x
Fe+CuCl2=FeCl2+Cu
56 64
20g·x 19.2g
x=84%
答:铁屑中单质Fe的质量分数为84% 。
(2)1000g废液中CuCl2的质量为多少克?
(2)由表可知,过量的铁粉与1000g废液可以置换出64gCu。
解:设参加反应的氯化铜的质量为y,生成氯化亚铁 为z,则
Fe+CuCl2=FeCl2+Cu
135 127 64
y z 64g
y=135g z=127g
答:1000g废液中CuCl2的质量为135g 。
(3)若在实验流程中分别加入足量废铁屑、足量AgNO3溶液,最终得到861gAgCl固体,则1000g废液中FeCl2的质量分数是多少?
(3)解:设滤液中FeCl2的质量为m,则
FeCl2+2AgNO3=Fe(NO3)2+2AgCl↓
127 287
m 861g
m=381g
1000废液中FeCl2的质量分数为:
答:1000废液中FeCl2的质量分数为25.4%。
例3.某工厂废液中含有CuSO4(其它成分不含铜元素),现按以下流程回收金属铜。
(1)回收过程中,加入适量稀硫酸可除去过量铁屑,该反应的化学方程式为Fe+H2SO4=FeSO4+H2↑,这个反应所属的基本反应类型是? 。?
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是:
? 。?
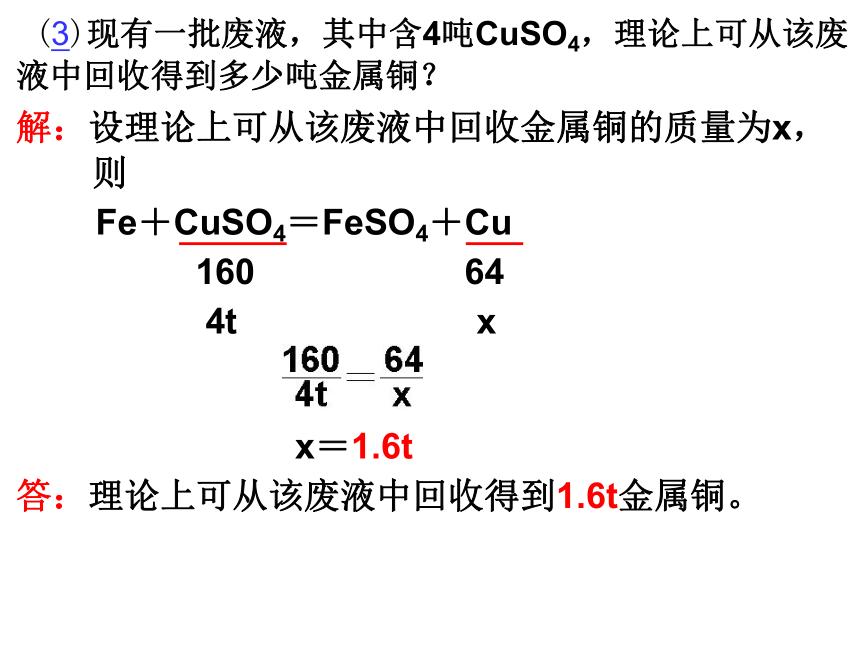
(3)现有一批废液,其中含4吨CuSO4,理论上可从该废液中回收得到多少吨金属铜? ?
置换反应
加热时,铜要与氧气反应,生成氧化铜,导致回收到的铜不纯
(3)现有一批废液,其中含4吨CuSO4,理论上可从该废液中回收得到多少吨金属铜? ?
解:设理论上可从该废液中回收金属铜的质量为x, 则
Fe+CuSO4=FeSO4+Cu
160 64
4t x
x=1.6t
答:理论上可从该废液中回收得到1.6t金属铜。
例4.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2
;CuCl2+Fe=FeCl2+Cu。加入铁粉的质量与反应后的溶液中剩余固体的质量的关系如图所示。回答下列问题:
(1)剩余固体的质量>6.4g时,剩余固体的成分是:
(填化学式);向此剩余固体中加入盐酸,发生反应的化学方程式为 。
Cu和Fe
Fe+2HCl=FeCl2+H2↑
(2)解:设FeCl3的质量为x,生成氯化亚铁的质量为 y,则
2FeCl3+Fe=3FeCl2
325 56 381
x 5.6g y
x=32.5g y=38.1g
答:FeCl3的质量为32.5g 。
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数。
?
(3)解:设铁与氯化铜反应生成氯化亚铁的质量为z,则
CuCl2+Fe=FeCl2+Cu
56 127
5.6g z
z=12.7g
反应后所得溶液中FeCl2的质量分数为:
答:略
m铁=11.2g-5.6g=5.6g
m氯化亚铁=5吨×25.4%=1.27吨
1.27
解:设最多可以得到氯化氢气体的质量为x,则
4FeCl2+O2+4H2O 2Fe2O3+8HCl
508 292?
1.27t x?
x=0.73t
答:最多可以得到0.73t氯化氢气体。
练2.学校科学兴趣小组的同学欲测定某含杂质的锌粒中锌的质量分数。小亮称取10g该锌粒,加入足量的稀硫酸中(杂质不溶于水,也不与酸反应),测得一定时间内生成氢气的质量如下表:
请计算:
(1)m的值为 。
(2)此锌粒中锌的质量分数。
(3)上述实验过程中,生成H2的质量与消耗硫酸的质量的关系如图所示,求稀硫酸的溶质质量分数。
(4)当恰好完全反应时,求生成的溶液的质量。
0.2
(2)(3)解:设此锌粒中锌的质量分数为x,稀硫酸的溶质 质量分数为y。则
m锌=10g·x m硫酸=50g·y
Zn+H2SO4=ZnSO4+H2↑
65? 98???? 2
10g·x 50g·y 0.2g
x=65% y=19.6%
答:此锌粒中锌的质量分数为65%,稀硫酸的溶质质量分数为19.6% 。
(4) 解:m液=10g×65%+50g-0.2g=56.3g 答:略
练3.某同学取木炭粉与氧化铜的混合物高温加热一段时间后的剩余固体置于烧杯中,向烧杯中加入稀硫酸,发现烧杯中剩余固体的质量与加入稀硫酸的质量的关系如图所示。回答下列问题:
(1)木炭粉与氧化铜反应一段时间后剩余固体中除含Cu外,一定含有的物质是 ,该物质在剩余固体中的质量分数是 。
(2)求所加稀硫酸的溶质质量分数。
有减少,说明有物质与稀硫酸反应,只能是“CuO”
CuO
m氧化铜=5g-3.4g=1.6g
32%
(1)m氧化铜=5g-3.4g=1.6g
(2)求所加稀硫酸的溶质质量分数。
解:设所加稀硫酸的溶质质量分
数为x,则
m硫酸=10g·x
CuO+H2SO4=CuSO4+H2O
80 98
1.6g 10g·x
x=19.6%
答:所加稀硫酸的溶质质量分数为19.6%。
练4.小李要测定某Cu-Zn合金中铜的质量分数,做了如下实验。
(1)用量筒量取 mL98%浓硫酸(密度为1.84g/mL)配成100g19.6%的稀硫酸。
解:根据“m浓×A浓%=m稀×A稀%”可得出:
1.84g/mL×V浓×98%=100g×19.6%
V浓≈10.9mL
10.9
Zn+H2SO4=ZnSO4+H2↑
质量守恒定律
m氢气=0.2g
已知:10g合金样品 100g19.6%的稀硫酸
m氢气=0.2g
①求该合金样品中铜的质量分数。
②反应后所得溶液中硫酸锌的质量分数。(精确到0.1%)
解:设参加反应的锌的质量为x,生成的硫酸锌的质量为y,则
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
x=6.5g y=16.1g
答:略
例1.某同学为测定黄铜屑(由锌和铜形成的合金)样品的组成,分四次取样品与稀盐酸反应,实验数据如下表。
试求解:
(1)第 次实验中金属锌完全参加反应。
(2)所用稀硫酸中的溶质质量分数?
不变
反应完
3、4
肯定反应完了
用这2次的数据完成计算
解:设所用稀硫酸中的溶质质量分数为x,则
m硫酸=40g·x
Zn+H2SO4=ZnSO4+H2↑
98 2
40g·x 0.4g
x=49%
答:所用稀硫酸中的溶质质量分数为49%。
例2.某腐蚀印刷电路板的废液经处理后只含有CuCl2和FeCl2两种溶质。为了分析处理后废液的组成,某同学取1000g该废液,设计如下实验流程进行探究:
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
不变反应完
没有反应完
废铁屑反应完了
(1)废铁屑中单质Fe的质量分数为多少?
(1)解:设废铁屑中单质Fe的质量分数为x,则
m铁=20g·x
Fe+CuCl2=FeCl2+Cu
56 64
20g·x 19.2g
x=84%
答:铁屑中单质Fe的质量分数为84% 。
(2)1000g废液中CuCl2的质量为多少克?
(2)由表可知,过量的铁粉与1000g废液可以置换出64gCu。
解:设参加反应的氯化铜的质量为y,生成氯化亚铁 为z,则
Fe+CuCl2=FeCl2+Cu
135 127 64
y z 64g
y=135g z=127g
答:1000g废液中CuCl2的质量为135g 。
(3)若在实验流程中分别加入足量废铁屑、足量AgNO3溶液,最终得到861gAgCl固体,则1000g废液中FeCl2的质量分数是多少?
(3)解:设滤液中FeCl2的质量为m,则
FeCl2+2AgNO3=Fe(NO3)2+2AgCl↓
127 287
m 861g
m=381g
1000废液中FeCl2的质量分数为:
答:1000废液中FeCl2的质量分数为25.4%。
例3.某工厂废液中含有CuSO4(其它成分不含铜元素),现按以下流程回收金属铜。
(1)回收过程中,加入适量稀硫酸可除去过量铁屑,该反应的化学方程式为Fe+H2SO4=FeSO4+H2↑,这个反应所属的基本反应类型是? 。?
(2)洗涤后的滤渣不能用加热的方法干燥,其原因是:
? 。?
(3)现有一批废液,其中含4吨CuSO4,理论上可从该废液中回收得到多少吨金属铜? ?
置换反应
加热时,铜要与氧气反应,生成氧化铜,导致回收到的铜不纯
(3)现有一批废液,其中含4吨CuSO4,理论上可从该废液中回收得到多少吨金属铜? ?
解:设理论上可从该废液中回收金属铜的质量为x, 则
Fe+CuSO4=FeSO4+Cu
160 64
4t x
x=1.6t
答:理论上可从该废液中回收得到1.6t金属铜。
例4.现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe=3FeCl2
;CuCl2+Fe=FeCl2+Cu。加入铁粉的质量与反应后的溶液中剩余固体的质量的关系如图所示。回答下列问题:
(1)剩余固体的质量>6.4g时,剩余固体的成分是:
(填化学式);向此剩余固体中加入盐酸,发生反应的化学方程式为 。
Cu和Fe
Fe+2HCl=FeCl2+H2↑
(2)解:设FeCl3的质量为x,生成氯化亚铁的质量为 y,则
2FeCl3+Fe=3FeCl2
325 56 381
x 5.6g y
x=32.5g y=38.1g
答:FeCl3的质量为32.5g 。
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数。
?
(3)解:设铁与氯化铜反应生成氯化亚铁的质量为z,则
CuCl2+Fe=FeCl2+Cu
56 127
5.6g z
z=12.7g
反应后所得溶液中FeCl2的质量分数为:
答:略
m铁=11.2g-5.6g=5.6g
m氯化亚铁=5吨×25.4%=1.27吨
1.27
解:设最多可以得到氯化氢气体的质量为x,则
4FeCl2+O2+4H2O 2Fe2O3+8HCl
508 292?
1.27t x?
x=0.73t
答:最多可以得到0.73t氯化氢气体。
练2.学校科学兴趣小组的同学欲测定某含杂质的锌粒中锌的质量分数。小亮称取10g该锌粒,加入足量的稀硫酸中(杂质不溶于水,也不与酸反应),测得一定时间内生成氢气的质量如下表:
请计算:
(1)m的值为 。
(2)此锌粒中锌的质量分数。
(3)上述实验过程中,生成H2的质量与消耗硫酸的质量的关系如图所示,求稀硫酸的溶质质量分数。
(4)当恰好完全反应时,求生成的溶液的质量。
0.2
(2)(3)解:设此锌粒中锌的质量分数为x,稀硫酸的溶质 质量分数为y。则
m锌=10g·x m硫酸=50g·y
Zn+H2SO4=ZnSO4+H2↑
65? 98???? 2
10g·x 50g·y 0.2g
x=65% y=19.6%
答:此锌粒中锌的质量分数为65%,稀硫酸的溶质质量分数为19.6% 。
(4) 解:m液=10g×65%+50g-0.2g=56.3g 答:略
练3.某同学取木炭粉与氧化铜的混合物高温加热一段时间后的剩余固体置于烧杯中,向烧杯中加入稀硫酸,发现烧杯中剩余固体的质量与加入稀硫酸的质量的关系如图所示。回答下列问题:
(1)木炭粉与氧化铜反应一段时间后剩余固体中除含Cu外,一定含有的物质是 ,该物质在剩余固体中的质量分数是 。
(2)求所加稀硫酸的溶质质量分数。
有减少,说明有物质与稀硫酸反应,只能是“CuO”
CuO
m氧化铜=5g-3.4g=1.6g
32%
(1)m氧化铜=5g-3.4g=1.6g
(2)求所加稀硫酸的溶质质量分数。
解:设所加稀硫酸的溶质质量分
数为x,则
m硫酸=10g·x
CuO+H2SO4=CuSO4+H2O
80 98
1.6g 10g·x
x=19.6%
答:所加稀硫酸的溶质质量分数为19.6%。
练4.小李要测定某Cu-Zn合金中铜的质量分数,做了如下实验。
(1)用量筒量取 mL98%浓硫酸(密度为1.84g/mL)配成100g19.6%的稀硫酸。
解:根据“m浓×A浓%=m稀×A稀%”可得出:
1.84g/mL×V浓×98%=100g×19.6%
V浓≈10.9mL
10.9
Zn+H2SO4=ZnSO4+H2↑
质量守恒定律
m氢气=0.2g
已知:10g合金样品 100g19.6%的稀硫酸
m氢气=0.2g
①求该合金样品中铜的质量分数。
②反应后所得溶液中硫酸锌的质量分数。(精确到0.1%)
解:设参加反应的锌的质量为x,生成的硫酸锌的质量为y,则
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
x=6.5g y=16.1g
答:略
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
