高一化学鲁科版必修二课件1:2.1.1化学键及其类型课件(共15张)
文档属性
| 名称 | 高一化学鲁科版必修二课件1:2.1.1化学键及其类型课件(共15张) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-11-05 07:14:15 | ||
图片预览




文档简介
(共16张PPT)
第2章 化学键 化学反应与能量
第1节 化学键与化学反应
第1课时 化学键及其类型
第1节 化学键与化学反应
【本节知识框架】
物质变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
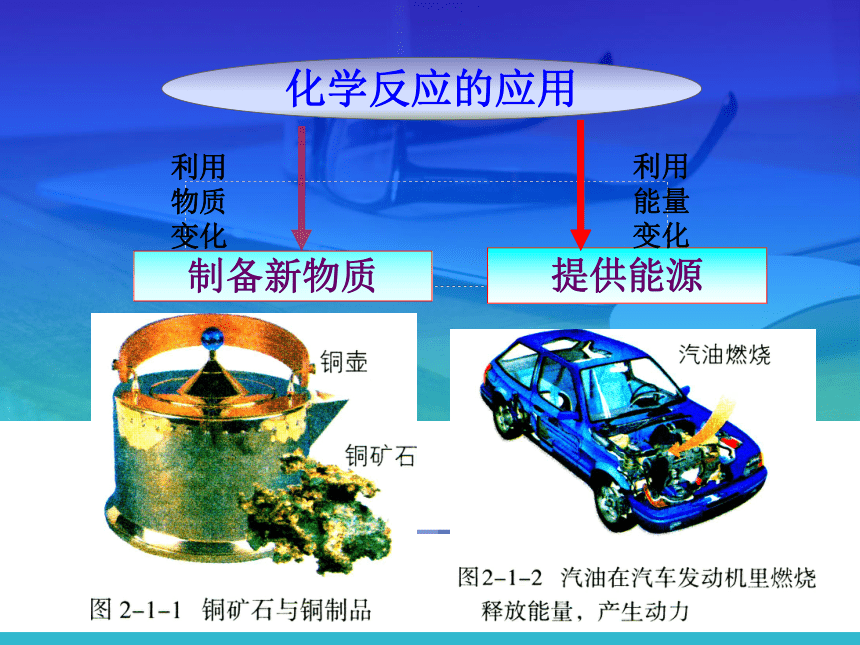
化学反应的应用
制备新物质
利用
物质
变化
提供能源
利用
能量
变化
1.化学键与物质变化
化学反应的实质是:
原子的重新组合。
想一想?
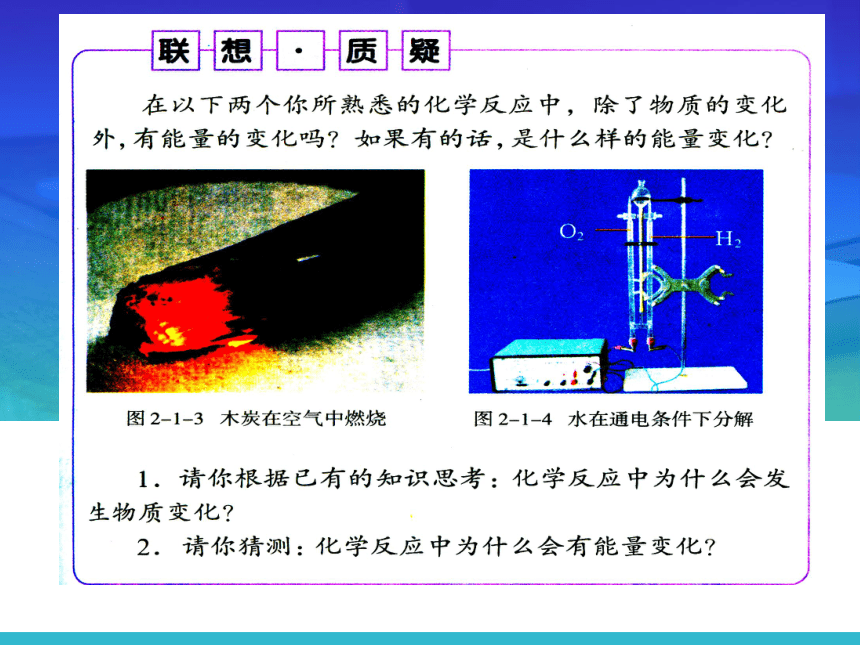
1.化学反应中为什么会发生物质变化?化学反应中的最小微粒是什么?
2.
以电解水为例,说说水电解时为什么要消耗能量?水分子是如何分解生成氢气与氧气的?
3.为什么碳与氧气反应需要先加热?
4.
初中化学中曾经讨论过的化学反应的实质是什么?
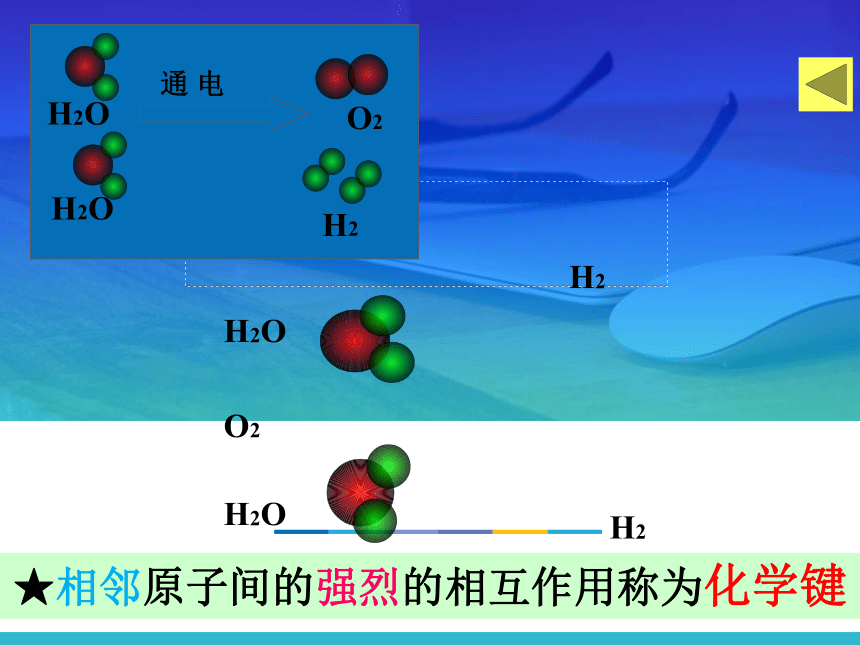
2H2O===2H2
+
O2
通电
H2O
H2O
H2
H2
O2
H2O
H2O
H2
O2
通
电
★相邻原子间的强烈的相互作用称为化学键
氢氢键、氧氧键
氢氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
从化学健的角度看,化学反应是旧化学键的断裂和新化学键的形成。
分析氯化氢的形成过程
★原子之间通过共用电子对所形成的化学键,叫做共价键。
通过共用电子对
H2+Cl2===2HCl
点燃
2
2
2
★共价键形成条件:
一般是非金属元素原子间的相互作用。
非金属元素可以是同种,也可以是不同种;如:H2、Cl2、HCl、CO2
等分子中均含有共价键。
2.化学键的类型
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
电子对不偏移
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极
电子对偏向Cl
Cl
··
··
H
··
··
H
H
··
知识拓展
氯化钠的形成过程
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失
e-
得
e-
静电作用
Na+
Cl-
★阴、阳离子通过静电作用而形成的化学键叫做离子键。
成键原因:
微粒由不稳定结构通过得失电子后变成稳定结构。
4.哪些元素的原子之间可能形成离子键(成键条件)
?
1.离子键的形成原因是什么?
3.离子键的成键本质是什么
2.形成离子键的微粒是什么?
答:
是因为参与化学反应的成键原子的结构不稳定,易得、失电子形成阴、阳离子。
答:是阴、阳离子。
答:阴、阳离子的静电作用(静电引力和斥力)。
答:活泼金属元素与活泼非金属元素之间容易形成。
第ⅠA族、
第ⅡA族的金属
卤素(VⅡA)及O、S等
如Na2
S、MgCl2
、
KI、
CaO等
用电子式表示物质的形成过程
H×
+
·
Cl
:
‥
‥
H
×
·
Cl
:
‥
‥
Na×
+
·
Cl
:
‥
‥
Na+
×
·
Cl
:
‥
‥
-
共
价
键
离
子
键
成键微粒
原
子
阴、阳离子
微
粒
间的作用
成键元素范围
成键原因
原子间通过共用电子对相互作用
阴、阳离子间
静电作用
同种或不同种的非金属元素
活泼金属(ⅠA、ⅡA)元素与
活泼非金属(ⅥA、ⅦA)元素
微粒由不稳定结构通过得失电子后变成稳定结构。
微粒由不稳定结构通过共用电子对相互作用后变成稳定结构。
物质
形成化学键的微粒
化学键的类型
水
甲烷
氨气
氯化钠
氯化镁
氧化钙
二氧化碳
共价键
共价键
共价键
离子键
离子键
共价键
离子键
H、O
C、H
N、H
Ca2+
、O2-
Na+
、
Cl-
C
、O
Mg2+
、
Cl-
判断下列物质中含有的化学键类型
H2
O2
Cl2
CO2
HCl
NH3
H2SO4
C2H5OH
NaCl
MgBr2
K2S
CaO
NaOH
Na2SO4
NH4Cl
单质
化
合
物
共价键
离子键
离子键、共价键
离
子
化
合
物
共价化合物
第2章 化学键 化学反应与能量
第1节 化学键与化学反应
第1课时 化学键及其类型
第1节 化学键与化学反应
【本节知识框架】
物质变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
化学键
化学键的含义
化学键的类型
认识物质的构成
认识化学反应
化学键与物质构成
能量变化的实质
化学反应的应用
制备新物质
利用
物质
变化
提供能源
利用
能量
变化
1.化学键与物质变化
化学反应的实质是:
原子的重新组合。
想一想?
1.化学反应中为什么会发生物质变化?化学反应中的最小微粒是什么?
2.
以电解水为例,说说水电解时为什么要消耗能量?水分子是如何分解生成氢气与氧气的?
3.为什么碳与氧气反应需要先加热?
4.
初中化学中曾经讨论过的化学反应的实质是什么?
2H2O===2H2
+
O2
通电
H2O
H2O
H2
H2
O2
H2O
H2O
H2
O2
通
电
★相邻原子间的强烈的相互作用称为化学键
氢氢键、氧氧键
氢氧键
氢氢键、氯氯键
氢氯键
氮氮键、氢氢键
氮氢键
从化学健的角度看,化学反应是旧化学键的断裂和新化学键的形成。
分析氯化氢的形成过程
★原子之间通过共用电子对所形成的化学键,叫做共价键。
通过共用电子对
H2+Cl2===2HCl
点燃
2
2
2
★共价键形成条件:
一般是非金属元素原子间的相互作用。
非金属元素可以是同种,也可以是不同种;如:H2、Cl2、HCl、CO2
等分子中均含有共价键。
2.化学键的类型
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
电子对不偏移
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极
电子对偏向Cl
Cl
··
··
H
··
··
H
H
··
知识拓展
氯化钠的形成过程
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失
e-
得
e-
静电作用
Na+
Cl-
★阴、阳离子通过静电作用而形成的化学键叫做离子键。
成键原因:
微粒由不稳定结构通过得失电子后变成稳定结构。
4.哪些元素的原子之间可能形成离子键(成键条件)
?
1.离子键的形成原因是什么?
3.离子键的成键本质是什么
2.形成离子键的微粒是什么?
答:
是因为参与化学反应的成键原子的结构不稳定,易得、失电子形成阴、阳离子。
答:是阴、阳离子。
答:阴、阳离子的静电作用(静电引力和斥力)。
答:活泼金属元素与活泼非金属元素之间容易形成。
第ⅠA族、
第ⅡA族的金属
卤素(VⅡA)及O、S等
如Na2
S、MgCl2
、
KI、
CaO等
用电子式表示物质的形成过程
H×
+
·
Cl
:
‥
‥
H
×
·
Cl
:
‥
‥
Na×
+
·
Cl
:
‥
‥
Na+
×
·
Cl
:
‥
‥
-
共
价
键
离
子
键
成键微粒
原
子
阴、阳离子
微
粒
间的作用
成键元素范围
成键原因
原子间通过共用电子对相互作用
阴、阳离子间
静电作用
同种或不同种的非金属元素
活泼金属(ⅠA、ⅡA)元素与
活泼非金属(ⅥA、ⅦA)元素
微粒由不稳定结构通过得失电子后变成稳定结构。
微粒由不稳定结构通过共用电子对相互作用后变成稳定结构。
物质
形成化学键的微粒
化学键的类型
水
甲烷
氨气
氯化钠
氯化镁
氧化钙
二氧化碳
共价键
共价键
共价键
离子键
离子键
共价键
离子键
H、O
C、H
N、H
Ca2+
、O2-
Na+
、
Cl-
C
、O
Mg2+
、
Cl-
判断下列物质中含有的化学键类型
H2
O2
Cl2
CO2
HCl
NH3
H2SO4
C2H5OH
NaCl
MgBr2
K2S
CaO
NaOH
Na2SO4
NH4Cl
单质
化
合
物
共价键
离子键
离子键、共价键
离
子
化
合
物
共价化合物
