人教版化学必修二第三节 二.化学反应的限度30ppt
文档属性
| 名称 | 人教版化学必修二第三节 二.化学反应的限度30ppt |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-11-12 17:05:05 | ||
图片预览







文档简介
(共30张PPT)
工业炼铁的方程式为
高炉炼铁的主要反应为:
2C(焦炭)+O2(空气)
2CO
Fe2O3+3CO
2Fe
+3CO
现有1000mol
Fe2O3和3000molCO反应,反应足够时间后可以产生多少molFe?
答:但是实际上只产生了1500mol,为什么?
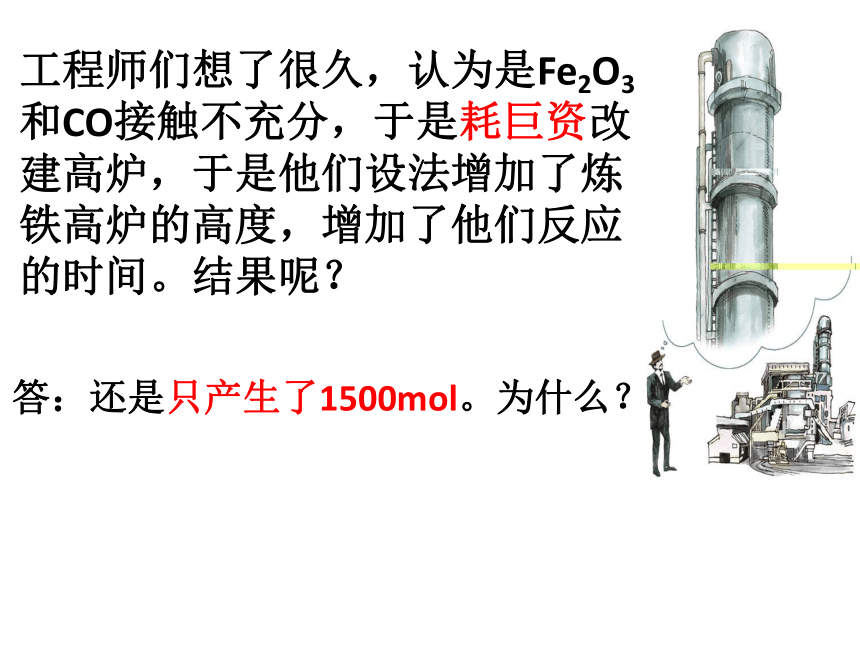
工程师们想了很久,认为是Fe2O3和CO接触不充分,于是耗巨资改建高炉,于是他们设法增加了炼铁高炉的高度,增加了他们反应的时间。结果呢?
答:还是只产生了1500mol。为什么?
二.化学反应的限度
经过科学家们长期的研究发现,化学反应除了有速率问题,还有限度问题,即反应进行的程度问题。有的反应反应物可以完全反应转化成生成物,有的反应物只反应了一部分。今天我们就来研究一下化学反应的限度。
所有化学反应都有速率问题,但化学反应限度不是所有化学反应都有,只有可逆反应才有限度问题。
思考:
什么是可逆反应?
一、可逆反应
(1)定义:在同一反应条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的反应。
思考:你还知道哪些可逆反应?
大多数的化学反应具有可逆性
Cl2
+
H2O
HClO
+
HCl
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
2SO2
+
18O2
2SO3
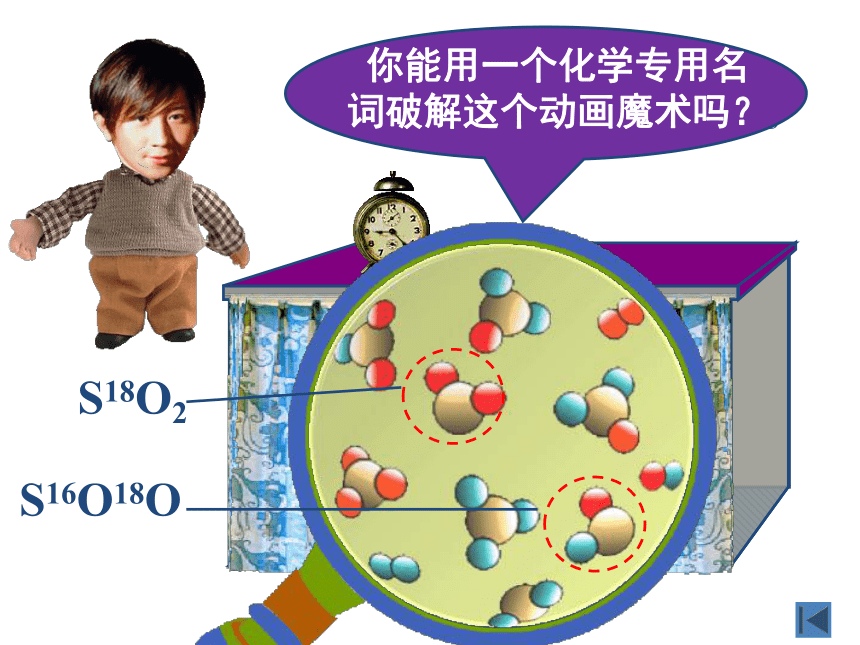
看我的化学新魔术!
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词破解这个动画魔术吗?
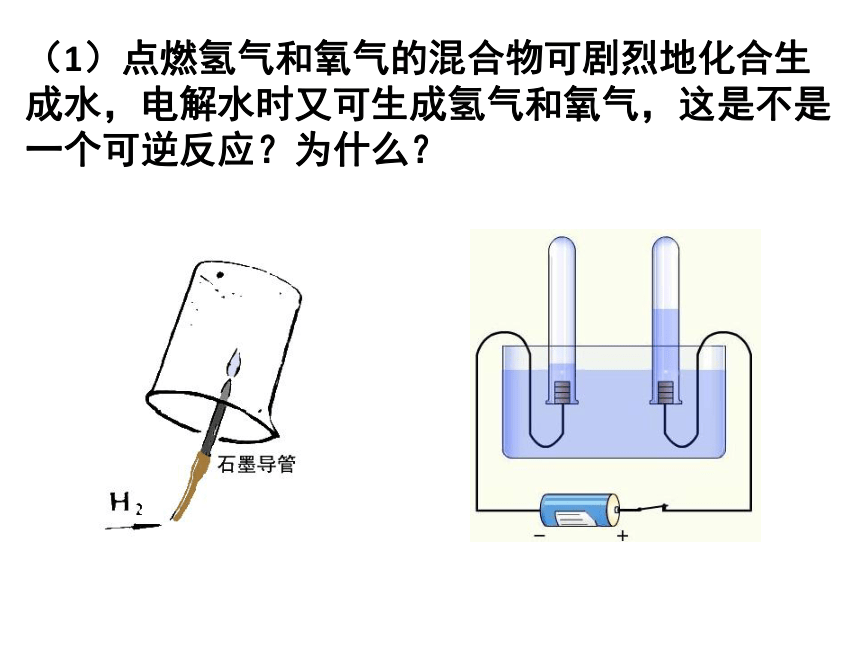
(1)点燃氢气和氧气的混合物可剧烈地化合生成水,电解水时又可生成氢气和氧气,这是不是一个可逆反应?为什么?
(2)氯化铵加热分解成氨气和氯化氢气体,氨气和氯化氢气体遇冷变成氯化铵。是不是可逆反应?
可逆反应的特点:
①正反应和逆反应发生的条件相同
②反应物、生成物共同存在
③可逆反应有一定的限度
④多数反应为可逆反应
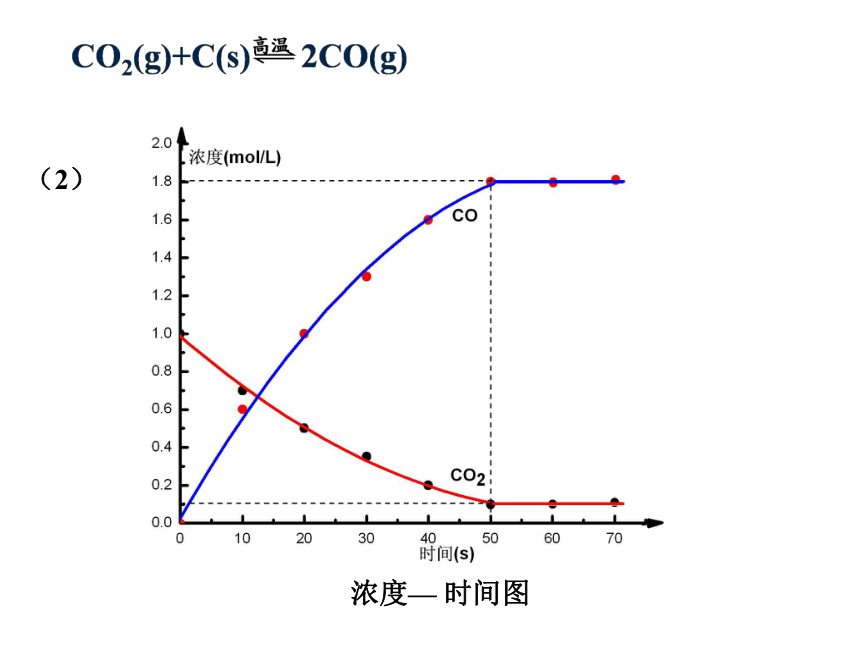
时间(s)
0
10
20
30
40
50
60
70
CO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
C
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
CO
0
0.6
1
1.3
1.6
1.8
1.8
1.8
物质的量(mol)
物质
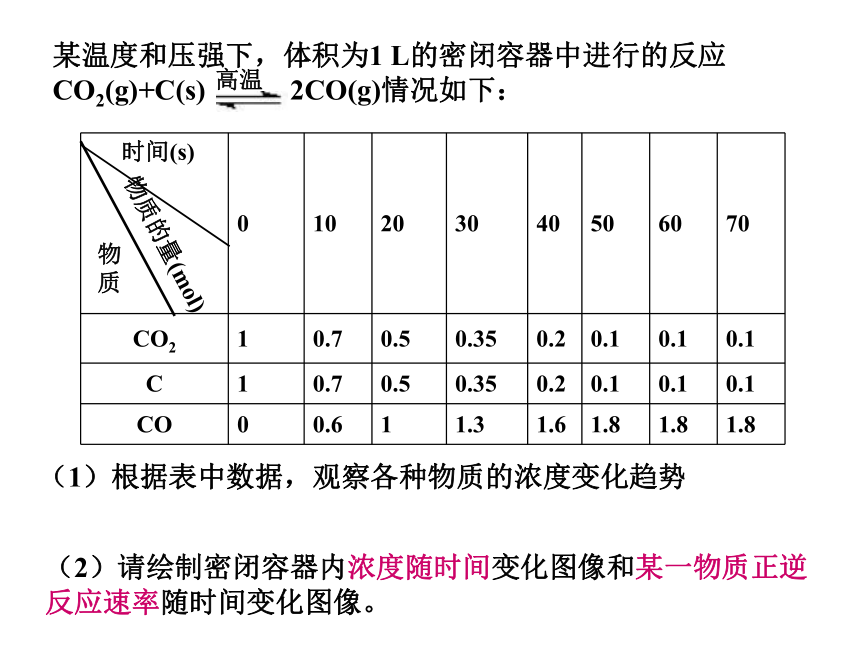
某温度和压强下,体积为1
L的密闭容器中进行的反应CO2(g)+C(s)
2CO(g)情况如下:
高温
(1)根据表中数据,观察各种物质的浓度变化趋势
(2)请绘制密闭容器内浓度随时间变化图像和某一物质正逆反应速率随时间变化图像。
(2)
浓度—
时间图
(2)
浓度—
时间图
起点:
反应起始)
反应物浓度最大,正反应速率
;
生成物浓度为0,逆反应速率
。
趋势:(反应过程)
反应物浓度
,正反应速率
;
生成物浓度
,逆反应速率
。
转折点(交点):
一段时间后,正逆反应速率
。
时间(t)
反应速率
0
v(正)
v(逆)
t1
v(正)=
v(逆)
化学平衡状态
化学平衡建立的过程
二、化学平衡状态
一定条件下可逆反应里,当正反应速率和逆反应速率相等,反应混合物中各组分浓度保持不变的状态称化学平衡状态。
前提(适用范围):可逆反应
实质:v(正)=
v
(逆)
≠0
外在标志:反应混合物中各组分
的浓度保持不变
化学平衡状态
(三)化学平衡特征
“逆”
-----
研究的对象为可逆反应。
“等”
-----
平衡时,正反应和逆反应的速率相等。
(对同
一物质而言,消耗速率和生成
速率相等)
“动”-----
化学平衡是动态平衡,化学反应仍在进行,并未停止。
“定”
-----
平衡时,反应混合物中各组成成分的百分含量保
持一定(即不再发生改变)。
“变”-----
化学平衡是一定条件下的平衡,当反应条件改变时,
反应速率和各组分百分含量会发生改变而使平衡被
破坏。但一段时间后会达到新的平衡。
时间(s)
0
10
20
30
40
50
60
70
CO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
C
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
CO
0
0.6
1
1.3
1.6
1.8
1.8
1.8
物质的量(mol)
物质
某温度和压强下,体积为1
L的密闭容器中进行的反应CO2(g)+C(s)
2CO(g)
情况如下:
高温
此反应进行到什么时候达到了这个反应的限度?
此时,该反应是否停止了?
此时,为何CO2和CO浓度都不再改变
此时反应并未停止,只是表观上各成分保持稳定
化学反应的限度:
化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度,即是该反应进行的限度。
如何理解正反应速率等于逆反应速率?
N2
+
3H2
2NH3
讨论:化学平衡状态的判断标准
1、本质:
v
正
=
v
逆
2、现象:浓度保持不变
1、
v
A耗
=
v
A生
v
B耗
=
v
B生
v
C
生
=
v
C
耗
v
D生
=
v
D耗
2、
v
A耗
﹕
v
B生
=
m﹕n
…
…
本质
m
A(g)
+
n
B(g)
p
C(g)
+
q
D(g)
注意:1、方向
2、量
讨论:化学平衡状态的判断标准
1、本质:
v
正
=
v
逆
2、现象:浓度保持不变
①
A、B、C、D
的浓度不再改变。
②
A、B、C、D
的分子数(或
n)不再改变。
③
A、B、C、D
的百分含量不再改变。
④
A、B、C、D
的转化率或生成率不再改变。
⑤
体系温度不再改变。
⑥
若某物质有色,体系的颜色不再改变。
现表征特
1.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g)
2NH3(g),能说明反应已达到平衡状态的是(
)
A、V(正)=V(逆)
B、消耗1molN2的同时,生成1molN2
C、消耗1molN2的同时,生成2molNH3
D、消耗1molN2的同时,消耗2molNH3
E、消耗3molH2的同时,生成2molNH3
F、N2的浓度保持不变
G.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
×
√
√
√
√
×
×
1.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g)
2NH3(g),能说明反应已达到平衡状态的是(
)
J.断开1molN
—N键的同时断开6molN—H键
I.断开3molH—H键的同时生成6molN—H键
H.断开3molH—H键的同时生成3molH—H键
K.3V正(N2)=V正(H2)
×
×
×
√
√
√
L.3V正(N2)=V逆(H2)
M.2V正(H2)=3V逆(NH3)
练习1、
在一定温度下,能说明反应A(g)
+3B(g)
2C(g)
已达到平衡的是
(
)
A、B
练习2、下列哪些说法可以说明反应
已达到平衡的是(
)
N2
+
3H2
2NH3
A.
一个N≡N键断裂的同时,有三个H—H键形成
B.
一个N≡N键断裂的同时,有六个N—H键形成
C.
三个H—H键形成的同时,有六个N—H键形成
D.
六个N—H键形成的同时,有三个H—H键断裂
A、C
3、下列各图中M时刻不处于化学平衡状态的是(
)
0
v
t
v逆
v正
M
0
v
t
M
v正
v逆
0
v
t
v正
v逆
M
0
n
t
M
A
B
C
D
B
(四)有关化学平衡的计算
基本思路:列出起始量、转化量、平衡量,再根据题意求解。
练习1:2
L密闭容器中2
mol
N2和3
mol
H2在一定条件下合成氨气,平衡时容器内压强与反应前压强之比为4:5,试计算
(1)N2的转化率;(2)平衡时NH3的浓度
25%
0.5
mol/L
五、反应条件的控制
1、促进有利的化学反应、抑制有害的化学反应
2、控制化学反应条件的基本措施
(1)通过改变反应物的温度、浓度、固体表面积以及催化剂的使用等,改变化学反应速率。
(2)通过改变可逆反应体系的温度、溶液浓度、气体压强(浓度)等,改变可逆反应进行的限度。
阅读教材P52
练习2:1
mol
A和n
mol
B在一定条件下发生如下的反应
A(g)+nB(g)
mC(g),一段时间后测得A的转化率为
50%,同温同压下反应前气体密度是反应后气体密度的0.75倍,则n和m可能是(
)
A、n=3
m=3
B、n=2
m=3
C、n=1
m=1
D、n=3
m=2
CD
2SO2
+
18O2
2SO3
看我的化学新魔术!
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词破解这个动画魔术吗?
对
m+n
≠
p+q
的反应(即反应前后气体分子数改变),
还可从以下几个方面判断:
1、体系的分子总数(或气体总物质的量)不再改变。
2、体系的平均分子量不再改变。
3、若为恒容体系,体系的压强不再改变。
4、若为恒压体系,体系的密度不再改变。
注意:以上几条对m+n
=
p+q的反应不成立。
m
A(g)
+
n
B(g)
p
C(g)
+
q
D(g)
由现象判断平衡状态可归纳为如下:
若可逆反应未达到平衡时,量随反应进行而变,则可用此量不变判断达到平衡状态,反之,量随反应进行不变,则不能用此量不变来判断反应达到平衡状态。
工业炼铁的方程式为
高炉炼铁的主要反应为:
2C(焦炭)+O2(空气)
2CO
Fe2O3+3CO
2Fe
+3CO
现有1000mol
Fe2O3和3000molCO反应,反应足够时间后可以产生多少molFe?
答:但是实际上只产生了1500mol,为什么?
工程师们想了很久,认为是Fe2O3和CO接触不充分,于是耗巨资改建高炉,于是他们设法增加了炼铁高炉的高度,增加了他们反应的时间。结果呢?
答:还是只产生了1500mol。为什么?
二.化学反应的限度
经过科学家们长期的研究发现,化学反应除了有速率问题,还有限度问题,即反应进行的程度问题。有的反应反应物可以完全反应转化成生成物,有的反应物只反应了一部分。今天我们就来研究一下化学反应的限度。
所有化学反应都有速率问题,但化学反应限度不是所有化学反应都有,只有可逆反应才有限度问题。
思考:
什么是可逆反应?
一、可逆反应
(1)定义:在同一反应条件下,既可以向正反应方向进行,同时又可以向逆反应方向进行的反应。
思考:你还知道哪些可逆反应?
大多数的化学反应具有可逆性
Cl2
+
H2O
HClO
+
HCl
2SO2+O2
2SO3
催化剂
高温
SO2
+H2O
H2SO3
NH3
+H2O
NH3
·H2O
2SO2
+
18O2
2SO3
看我的化学新魔术!
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词破解这个动画魔术吗?
(1)点燃氢气和氧气的混合物可剧烈地化合生成水,电解水时又可生成氢气和氧气,这是不是一个可逆反应?为什么?
(2)氯化铵加热分解成氨气和氯化氢气体,氨气和氯化氢气体遇冷变成氯化铵。是不是可逆反应?
可逆反应的特点:
①正反应和逆反应发生的条件相同
②反应物、生成物共同存在
③可逆反应有一定的限度
④多数反应为可逆反应
时间(s)
0
10
20
30
40
50
60
70
CO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
C
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
CO
0
0.6
1
1.3
1.6
1.8
1.8
1.8
物质的量(mol)
物质
某温度和压强下,体积为1
L的密闭容器中进行的反应CO2(g)+C(s)
2CO(g)情况如下:
高温
(1)根据表中数据,观察各种物质的浓度变化趋势
(2)请绘制密闭容器内浓度随时间变化图像和某一物质正逆反应速率随时间变化图像。
(2)
浓度—
时间图
(2)
浓度—
时间图
起点:
反应起始)
反应物浓度最大,正反应速率
;
生成物浓度为0,逆反应速率
。
趋势:(反应过程)
反应物浓度
,正反应速率
;
生成物浓度
,逆反应速率
。
转折点(交点):
一段时间后,正逆反应速率
。
时间(t)
反应速率
0
v(正)
v(逆)
t1
v(正)=
v(逆)
化学平衡状态
化学平衡建立的过程
二、化学平衡状态
一定条件下可逆反应里,当正反应速率和逆反应速率相等,反应混合物中各组分浓度保持不变的状态称化学平衡状态。
前提(适用范围):可逆反应
实质:v(正)=
v
(逆)
≠0
外在标志:反应混合物中各组分
的浓度保持不变
化学平衡状态
(三)化学平衡特征
“逆”
-----
研究的对象为可逆反应。
“等”
-----
平衡时,正反应和逆反应的速率相等。
(对同
一物质而言,消耗速率和生成
速率相等)
“动”-----
化学平衡是动态平衡,化学反应仍在进行,并未停止。
“定”
-----
平衡时,反应混合物中各组成成分的百分含量保
持一定(即不再发生改变)。
“变”-----
化学平衡是一定条件下的平衡,当反应条件改变时,
反应速率和各组分百分含量会发生改变而使平衡被
破坏。但一段时间后会达到新的平衡。
时间(s)
0
10
20
30
40
50
60
70
CO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
C
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
CO
0
0.6
1
1.3
1.6
1.8
1.8
1.8
物质的量(mol)
物质
某温度和压强下,体积为1
L的密闭容器中进行的反应CO2(g)+C(s)
2CO(g)
情况如下:
高温
此反应进行到什么时候达到了这个反应的限度?
此时,该反应是否停止了?
此时,为何CO2和CO浓度都不再改变
此时反应并未停止,只是表观上各成分保持稳定
化学反应的限度:
化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度,即是该反应进行的限度。
如何理解正反应速率等于逆反应速率?
N2
+
3H2
2NH3
讨论:化学平衡状态的判断标准
1、本质:
v
正
=
v
逆
2、现象:浓度保持不变
1、
v
A耗
=
v
A生
v
B耗
=
v
B生
v
C
生
=
v
C
耗
v
D生
=
v
D耗
2、
v
A耗
﹕
v
B生
=
m﹕n
…
…
本质
m
A(g)
+
n
B(g)
p
C(g)
+
q
D(g)
注意:1、方向
2、量
讨论:化学平衡状态的判断标准
1、本质:
v
正
=
v
逆
2、现象:浓度保持不变
①
A、B、C、D
的浓度不再改变。
②
A、B、C、D
的分子数(或
n)不再改变。
③
A、B、C、D
的百分含量不再改变。
④
A、B、C、D
的转化率或生成率不再改变。
⑤
体系温度不再改变。
⑥
若某物质有色,体系的颜色不再改变。
现表征特
1.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g)
2NH3(g),能说明反应已达到平衡状态的是(
)
A、V(正)=V(逆)
B、消耗1molN2的同时,生成1molN2
C、消耗1molN2的同时,生成2molNH3
D、消耗1molN2的同时,消耗2molNH3
E、消耗3molH2的同时,生成2molNH3
F、N2的浓度保持不变
G.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
×
√
√
√
√
×
×
1.对于一定条件下的可逆反应,容器的体积保持不变
N2(g)+3H2(g)
2NH3(g),能说明反应已达到平衡状态的是(
)
J.断开1molN
—N键的同时断开6molN—H键
I.断开3molH—H键的同时生成6molN—H键
H.断开3molH—H键的同时生成3molH—H键
K.3V正(N2)=V正(H2)
×
×
×
√
√
√
L.3V正(N2)=V逆(H2)
M.2V正(H2)=3V逆(NH3)
练习1、
在一定温度下,能说明反应A(g)
+3B(g)
2C(g)
已达到平衡的是
(
)
A、B
练习2、下列哪些说法可以说明反应
已达到平衡的是(
)
N2
+
3H2
2NH3
A.
一个N≡N键断裂的同时,有三个H—H键形成
B.
一个N≡N键断裂的同时,有六个N—H键形成
C.
三个H—H键形成的同时,有六个N—H键形成
D.
六个N—H键形成的同时,有三个H—H键断裂
A、C
3、下列各图中M时刻不处于化学平衡状态的是(
)
0
v
t
v逆
v正
M
0
v
t
M
v正
v逆
0
v
t
v正
v逆
M
0
n
t
M
A
B
C
D
B
(四)有关化学平衡的计算
基本思路:列出起始量、转化量、平衡量,再根据题意求解。
练习1:2
L密闭容器中2
mol
N2和3
mol
H2在一定条件下合成氨气,平衡时容器内压强与反应前压强之比为4:5,试计算
(1)N2的转化率;(2)平衡时NH3的浓度
25%
0.5
mol/L
五、反应条件的控制
1、促进有利的化学反应、抑制有害的化学反应
2、控制化学反应条件的基本措施
(1)通过改变反应物的温度、浓度、固体表面积以及催化剂的使用等,改变化学反应速率。
(2)通过改变可逆反应体系的温度、溶液浓度、气体压强(浓度)等,改变可逆反应进行的限度。
阅读教材P52
练习2:1
mol
A和n
mol
B在一定条件下发生如下的反应
A(g)+nB(g)
mC(g),一段时间后测得A的转化率为
50%,同温同压下反应前气体密度是反应后气体密度的0.75倍,则n和m可能是(
)
A、n=3
m=3
B、n=2
m=3
C、n=1
m=1
D、n=3
m=2
CD
2SO2
+
18O2
2SO3
看我的化学新魔术!
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词破解这个动画魔术吗?
对
m+n
≠
p+q
的反应(即反应前后气体分子数改变),
还可从以下几个方面判断:
1、体系的分子总数(或气体总物质的量)不再改变。
2、体系的平均分子量不再改变。
3、若为恒容体系,体系的压强不再改变。
4、若为恒压体系,体系的密度不再改变。
注意:以上几条对m+n
=
p+q的反应不成立。
m
A(g)
+
n
B(g)
p
C(g)
+
q
D(g)
由现象判断平衡状态可归纳为如下:
若可逆反应未达到平衡时,量随反应进行而变,则可用此量不变判断达到平衡状态,反之,量随反应进行不变,则不能用此量不变来判断反应达到平衡状态。
