鲁科版化学 必修一 第二章复习课 元素与物质世界(共24张ppt)
文档属性
| 名称 | 鲁科版化学 必修一 第二章复习课 元素与物质世界(共24张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 481.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-11-13 00:00:00 | ||
图片预览







文档简介
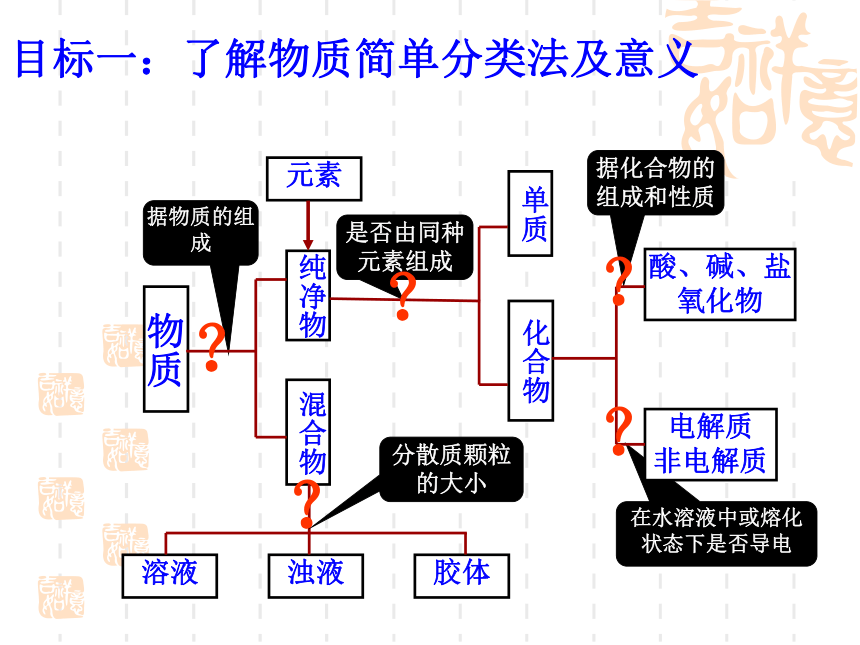
课件24张PPT。普通高中课程标准实验教科书化学1(必修)第二章元素与物质世界复习课复习目标1.了解物质简单分类法的意义。
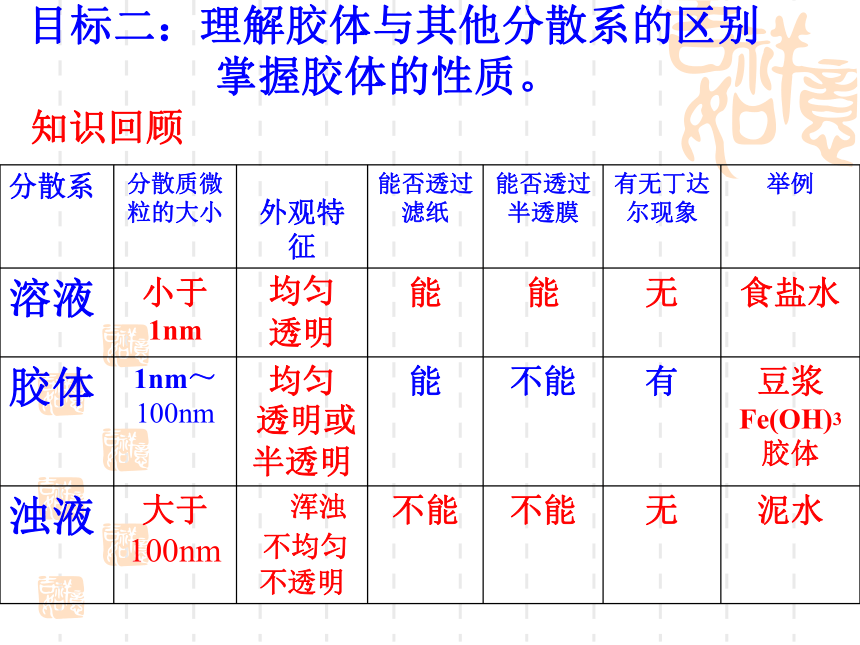
2.理解胶体与其他分散系的区别,掌握胶体的性质。
3.了解电解质、非电解质的概念,掌握酸、碱、盐电离方程式的书写。
4.掌握常见的离子方程式的书写及离子反应发生的条件、离子共存和离子检验的问题。
5.理解氧化还原反应、氧化剂、还原剂的概念,能判断电子转移的方向和数目。
6.掌握铁及其化合物的氧化性和还原性及不同价态铁的相互转化,并能用分类的观点对其进行分类。
7.用分类的观点建立本章的知识网络。据化合物的组成和性质在水溶液中或熔化状态下是否导电目标一:了解物质简单分类法及意义据物质的组成是否由同种元素组成分散质颗粒的大小????? 目标二:理解胶体与其他分散系的区别 掌握胶体的性质。知识回顾胶体的性质 1.丁达尔效应(应用:鉴别溶液和胶体)
2.聚沉(聚沉的条件:加热、搅拌、加电解质、加胶粒带反电荷的胶体)
3.渗析(应用:分离和提纯胶体)
4.电泳(了解:高压电除尘)下列关于胶体的叙述不正确的是 ( )
A. 胶体区别于其它分散系的本质特点是丁达尔现象。
B. 鉴别溶液和胶体可以用丁达尔现象。
C. 胶体不能透过滤纸,故可以用滤纸分离提纯胶体。
D. 向氢氧化铁胶体中逐渐加入稀硫酸可以观察到先沉淀后溶解的现象。AC【思路归纳】本题主要考查胶体的性质,D选项中注意加入电解质首先考虑聚沉,再考虑电解质和溶液能否反应。【思考】将三氯化铁溶液逐滴加入沸水中制备氢氧化铁胶体注意的问题不能搅拌、不能加热时间过长、三氯化铁不能过量。目标三:了解电解质、非电解质的概念,掌握酸、碱、盐电离方程式的书写。 知识回顾:1.电解质和非电解质的定义。
2.电解质和非电解质包含的物质类型。
3.电解质的电离。
4.电离方程式的书写。下列有关叙述正确的是( )
A:三氧化硫、盐酸、硫酸、硫酸钡、氨水是电解质。
B:铜、氨水、氯化钠溶液能导电故它们是电解质。
C:酸碱盐是电解质,其它物质是非电解质。
D:硫酸铝的电离方程式为:
Al2(SO4)3=2Al3++3SO42-
【思路归纳】判断电解质和非电解质的思路D(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
(2)能导电的物质不一定是电解质。如能导电的物质有:电解质溶液、熔融的碱和盐、金属单质和石墨。
(3)电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。目标四:掌握常见的离子方程式的书写及离子反应发生的条件、离子共存和离子检验的问题。离子反应(1)定义:有离子参加的一类反应。
(2)发生条件(复分解类型):生成难溶物、
生成难电离物、生成挥发性物质。
(3)表示方法——离子方程式 定义:用实际参加反应的离子的符号来表示离子反应的式子。 写:写出化学方程式 拆:把易溶且易电离的物质拆写成离子形式
删:删掉不参加反应的离子 查:检查方程式两边原子个数和电荷数是否相等 揭示了化学反应的实质 表示一类的反应 知识回顾离子能否共存的判断和离子检验1.离子能否共存判断时,先看能否发生复分解反应,即生成沉淀、气体、水等,再看能否发生氧化还原反应。
注意要弄清题干的要求:“共存”还是“不共存”,“可能”还是“肯定”,是否有“碱性溶液”“酸性溶液”“无色溶液”等附加条件。
2.离子检验:掌握氯离子、硫酸根离子的检验方法,注意答题步骤。问题导思
试写出下列反应的离子方程式:
三氯化铁溶液和氢氧化钡溶液反应
思:1.该离子方程式有什么意义?
2.你是如何改写成离子方程式的?
3.从哪些方面判断离子方程式是否正确?Fe3++3OH-= Fe(OH)3可溶性的铁盐与可溶性的强碱反应生成氢氧化铁沉淀常见易溶于水、易电离的物质:三大强酸(H2SO4、HCl、HNO3),三大强碱〔NaOH、KOH、Ba(OH)2、〕,可溶性盐,这些物质拆成离子形式,其他物质一律保留化学式。对于微溶物如Ca(OH)2 ,如果是澄清溶液,则拆成离子的形式;如果是悬浊液,则保留其化学式。原理、改写、守恒三个方面 下列离子方程式正确的是( )
A. 碳酸钙与盐酸反应:
CaCO3 +2H+=Ca2+ +H2O +CO2 ↑
B. 铁与盐酸反应:
2Fe +6H+ =2Fe3++ 3H2 ↑
C. 澄清石灰水与稀盐酸反应:
Ca(OH)2 + 2H+=Ca2+ +2H2O
D. Cl2 通入FeCl2 溶液
Cl2 +Fe2+ = 2Cl-+ Fe3+A原理错误Ca(OH)2改写错误电荷不守恒2.下列离子方程式中正确的是( )
A. 小苏打溶液与稀硫酸混合
CO32- + 2H + =CO2 ↑ +H2O
B. 大理石溶液与醋酸
CaCO3 + 2H+ =Ca2+ +CO2 ↑ +H2O
C. 硫酸亚铁溶液与过氧化氢溶液混合
Fe2+ +2H2O2 +4H+ = Fe3+ + 4H2O
D. 氨水与醋酸溶液反应
NH3·H2O + CH3COOH = CH3COO-+
NH4+ +H2O DHCO3-不改写CH3COOH不改写电子不守恒3.能在水溶液中大量共存的一组离子是 ( )。
A.H+、I-、Cl-、K+
B.Ag+、Fe3+、Cl-、SO42-
C.K+、SO42-、Ba2+、NO3-
D.NH4+、OH-、Cl-、HCO3-A目标五:理解氧化还原反应、氧化剂、还原剂的概念,能判断电子转移的方向和数目知识回顾
氧化还原反应
(1)特征:元素的化合价发生变化
(2)实质:电子转移
(3)概念和关系
还原剂→失e- →化合价升高 → 发生氧化反应 → 被氧化→生成氧化产物
氧化剂→ 得e- → 化合价降低 →发生还原反应 →被还原→生成还原产物
(4)电子转移的表示方法(了解)
问题导思 已知铜在常温下能被HNO3 溶解。反应方程式为:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ +4H2O
1. 上述反应能否改成离子方程式?若能请改写:
2.上述反应中,氧化剂是, 氧化产物是。
HNO3 没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的 。
3.该反应每生成1molNO气体,转移电子的物质的量为
4.根据反应可知氧化性顺序是
思路归纳:1.如何判断氧化剂、还原剂?
2.如何判断氧化性还原性的强弱?你还知道哪些方法?
根据化合价的变化3Cu + 8H++2NO3- = 3Cu2++ 2NO↑+4H2OHNO3Cu(NO3)23/43molHNO3 ? Cu(NO3)2
(1)根据氧化还原反应方程式在同一氧化还原反应中,
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
(2)根据元素的化合价来判断:
一般地,元素的化合价处于最高价态,具有氧化性;
元素的化合价处于最低价态,具有还原性;
元素的化合价处于中间价态,既有氧化性又有还原性。
(3)根据金属活动顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
从左到右,单质的还原性逐渐减弱,对应的阳离子的氧化性逐渐增强。
1.下列有关氧化还原反应的叙述正确的是( )
A. 肯定有一种元素被氧化,另一种元素被还原
B. 在反应中不一定所有元素的化合价都发生变化
C. 置换反应一定属于氧化还原反应
D. 化合反应和复分解反应不可能有氧化还原反应BC2. 已知(1)2FeCl3+2KI===2FeCl2+2KCl+I2;(2)2FeCl2+Cl2===2FeCl3,据此可判断各物质的氧化性由强到弱的顺序是( )
A.FeCl3>Cl2>I2 B.Cl2>FeCl3>I2
C.I2>Cl2>FeCl3 D.Cl2>I2>FeCl3B解题思路:根据反应中氧化剂的氧化性大于氧化产物目标六:掌握铁及其化合物的氧化性和还原性及不同价态铁的相互转化。知识回顾1.铁及其化合物的分类 按照组成和性质(单质、氧化物、碱、盐等)分类按照化合价分类2.铁及其化合物的氧化性还原性1.Fe的还原性:与Cl2、O2 、H+、Cu2+、Fe3+ 等反
应,表现了铁较活泼的化学性质。
2.Fe3+的氧化性:
Fe3+具有较强的氧化性,可以将Fe Cu Zn KI等氧化,而本身被还原为Fe2+。
3.Fe2+的氧化性和还原性:
①氧化性:Fe2+可以被Zn还原。
②还原性:Fe2+可以被Cl2 O2 KMnO4 HNO3等氧化。【小结】 “铁三角”H+ Cu2+ Fe3+ Zn H2 CO Zn H2 CO Cl2 HNO3Fe Cu Zn I- SO2 Cl2 HNO3 H2O2 KMnO4(1)下列叙述正确的是( )
A. 含最高价元素的化合物,一定具有强的氧化性
B. 阳离子只有氧化性,阴离子只有还原性
C. 失电子多的还原剂,还原性就强
D. 在化学反应中,某元素由化合态变为游
离态,此元素可能被氧化,也可能被还原
(2)除去FeCl2溶液中的少量FeCl3 ,可加入
____________;除去FeCl3溶液中的少量
FeCl2 ,可通入___________,除去FeCl2溶
液中的少量CuCl2,可加入__________。D铁粉氯气铁粉H+、Cu2+、Fe3+Fe2+目标七:用分类的观点建立本章的思维导图。
2.理解胶体与其他分散系的区别,掌握胶体的性质。
3.了解电解质、非电解质的概念,掌握酸、碱、盐电离方程式的书写。
4.掌握常见的离子方程式的书写及离子反应发生的条件、离子共存和离子检验的问题。
5.理解氧化还原反应、氧化剂、还原剂的概念,能判断电子转移的方向和数目。
6.掌握铁及其化合物的氧化性和还原性及不同价态铁的相互转化,并能用分类的观点对其进行分类。
7.用分类的观点建立本章的知识网络。据化合物的组成和性质在水溶液中或熔化状态下是否导电目标一:了解物质简单分类法及意义据物质的组成是否由同种元素组成分散质颗粒的大小????? 目标二:理解胶体与其他分散系的区别 掌握胶体的性质。知识回顾胶体的性质 1.丁达尔效应(应用:鉴别溶液和胶体)
2.聚沉(聚沉的条件:加热、搅拌、加电解质、加胶粒带反电荷的胶体)
3.渗析(应用:分离和提纯胶体)
4.电泳(了解:高压电除尘)下列关于胶体的叙述不正确的是 ( )
A. 胶体区别于其它分散系的本质特点是丁达尔现象。
B. 鉴别溶液和胶体可以用丁达尔现象。
C. 胶体不能透过滤纸,故可以用滤纸分离提纯胶体。
D. 向氢氧化铁胶体中逐渐加入稀硫酸可以观察到先沉淀后溶解的现象。AC【思路归纳】本题主要考查胶体的性质,D选项中注意加入电解质首先考虑聚沉,再考虑电解质和溶液能否反应。【思考】将三氯化铁溶液逐滴加入沸水中制备氢氧化铁胶体注意的问题不能搅拌、不能加热时间过长、三氯化铁不能过量。目标三:了解电解质、非电解质的概念,掌握酸、碱、盐电离方程式的书写。 知识回顾:1.电解质和非电解质的定义。
2.电解质和非电解质包含的物质类型。
3.电解质的电离。
4.电离方程式的书写。下列有关叙述正确的是( )
A:三氧化硫、盐酸、硫酸、硫酸钡、氨水是电解质。
B:铜、氨水、氯化钠溶液能导电故它们是电解质。
C:酸碱盐是电解质,其它物质是非电解质。
D:硫酸铝的电离方程式为:
Al2(SO4)3=2Al3++3SO42-
【思路归纳】判断电解质和非电解质的思路D(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
(2)能导电的物质不一定是电解质。如能导电的物质有:电解质溶液、熔融的碱和盐、金属单质和石墨。
(3)电解质需在水溶液里或熔融状态下才能导电。固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。目标四:掌握常见的离子方程式的书写及离子反应发生的条件、离子共存和离子检验的问题。离子反应(1)定义:有离子参加的一类反应。
(2)发生条件(复分解类型):生成难溶物、
生成难电离物、生成挥发性物质。
(3)表示方法——离子方程式 定义:用实际参加反应的离子的符号来表示离子反应的式子。 写:写出化学方程式 拆:把易溶且易电离的物质拆写成离子形式
删:删掉不参加反应的离子 查:检查方程式两边原子个数和电荷数是否相等 揭示了化学反应的实质 表示一类的反应 知识回顾离子能否共存的判断和离子检验1.离子能否共存判断时,先看能否发生复分解反应,即生成沉淀、气体、水等,再看能否发生氧化还原反应。
注意要弄清题干的要求:“共存”还是“不共存”,“可能”还是“肯定”,是否有“碱性溶液”“酸性溶液”“无色溶液”等附加条件。
2.离子检验:掌握氯离子、硫酸根离子的检验方法,注意答题步骤。问题导思
试写出下列反应的离子方程式:
三氯化铁溶液和氢氧化钡溶液反应
思:1.该离子方程式有什么意义?
2.你是如何改写成离子方程式的?
3.从哪些方面判断离子方程式是否正确?Fe3++3OH-= Fe(OH)3可溶性的铁盐与可溶性的强碱反应生成氢氧化铁沉淀常见易溶于水、易电离的物质:三大强酸(H2SO4、HCl、HNO3),三大强碱〔NaOH、KOH、Ba(OH)2、〕,可溶性盐,这些物质拆成离子形式,其他物质一律保留化学式。对于微溶物如Ca(OH)2 ,如果是澄清溶液,则拆成离子的形式;如果是悬浊液,则保留其化学式。原理、改写、守恒三个方面 下列离子方程式正确的是( )
A. 碳酸钙与盐酸反应:
CaCO3 +2H+=Ca2+ +H2O +CO2 ↑
B. 铁与盐酸反应:
2Fe +6H+ =2Fe3++ 3H2 ↑
C. 澄清石灰水与稀盐酸反应:
Ca(OH)2 + 2H+=Ca2+ +2H2O
D. Cl2 通入FeCl2 溶液
Cl2 +Fe2+ = 2Cl-+ Fe3+A原理错误Ca(OH)2改写错误电荷不守恒2.下列离子方程式中正确的是( )
A. 小苏打溶液与稀硫酸混合
CO32- + 2H + =CO2 ↑ +H2O
B. 大理石溶液与醋酸
CaCO3 + 2H+ =Ca2+ +CO2 ↑ +H2O
C. 硫酸亚铁溶液与过氧化氢溶液混合
Fe2+ +2H2O2 +4H+ = Fe3+ + 4H2O
D. 氨水与醋酸溶液反应
NH3·H2O + CH3COOH = CH3COO-+
NH4+ +H2O DHCO3-不改写CH3COOH不改写电子不守恒3.能在水溶液中大量共存的一组离子是 ( )。
A.H+、I-、Cl-、K+
B.Ag+、Fe3+、Cl-、SO42-
C.K+、SO42-、Ba2+、NO3-
D.NH4+、OH-、Cl-、HCO3-A目标五:理解氧化还原反应、氧化剂、还原剂的概念,能判断电子转移的方向和数目知识回顾
氧化还原反应
(1)特征:元素的化合价发生变化
(2)实质:电子转移
(3)概念和关系
还原剂→失e- →化合价升高 → 发生氧化反应 → 被氧化→生成氧化产物
氧化剂→ 得e- → 化合价降低 →发生还原反应 →被还原→生成还原产物
(4)电子转移的表示方法(了解)
问题导思 已知铜在常温下能被HNO3 溶解。反应方程式为:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ +4H2O
1. 上述反应能否改成离子方程式?若能请改写:
2.上述反应中,氧化剂是, 氧化产物是。
HNO3 没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的 。
3.该反应每生成1molNO气体,转移电子的物质的量为
4.根据反应可知氧化性顺序是
思路归纳:1.如何判断氧化剂、还原剂?
2.如何判断氧化性还原性的强弱?你还知道哪些方法?
根据化合价的变化3Cu + 8H++2NO3- = 3Cu2++ 2NO↑+4H2OHNO3Cu(NO3)23/43molHNO3 ? Cu(NO3)2
(1)根据氧化还原反应方程式在同一氧化还原反应中,
氧化性:氧化剂>氧化产物 还原性:还原剂>还原产物
(2)根据元素的化合价来判断:
一般地,元素的化合价处于最高价态,具有氧化性;
元素的化合价处于最低价态,具有还原性;
元素的化合价处于中间价态,既有氧化性又有还原性。
(3)根据金属活动顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
从左到右,单质的还原性逐渐减弱,对应的阳离子的氧化性逐渐增强。
1.下列有关氧化还原反应的叙述正确的是( )
A. 肯定有一种元素被氧化,另一种元素被还原
B. 在反应中不一定所有元素的化合价都发生变化
C. 置换反应一定属于氧化还原反应
D. 化合反应和复分解反应不可能有氧化还原反应BC2. 已知(1)2FeCl3+2KI===2FeCl2+2KCl+I2;(2)2FeCl2+Cl2===2FeCl3,据此可判断各物质的氧化性由强到弱的顺序是( )
A.FeCl3>Cl2>I2 B.Cl2>FeCl3>I2
C.I2>Cl2>FeCl3 D.Cl2>I2>FeCl3B解题思路:根据反应中氧化剂的氧化性大于氧化产物目标六:掌握铁及其化合物的氧化性和还原性及不同价态铁的相互转化。知识回顾1.铁及其化合物的分类 按照组成和性质(单质、氧化物、碱、盐等)分类按照化合价分类2.铁及其化合物的氧化性还原性1.Fe的还原性:与Cl2、O2 、H+、Cu2+、Fe3+ 等反
应,表现了铁较活泼的化学性质。
2.Fe3+的氧化性:
Fe3+具有较强的氧化性,可以将Fe Cu Zn KI等氧化,而本身被还原为Fe2+。
3.Fe2+的氧化性和还原性:
①氧化性:Fe2+可以被Zn还原。
②还原性:Fe2+可以被Cl2 O2 KMnO4 HNO3等氧化。【小结】 “铁三角”H+ Cu2+ Fe3+ Zn H2 CO Zn H2 CO Cl2 HNO3Fe Cu Zn I- SO2 Cl2 HNO3 H2O2 KMnO4(1)下列叙述正确的是( )
A. 含最高价元素的化合物,一定具有强的氧化性
B. 阳离子只有氧化性,阴离子只有还原性
C. 失电子多的还原剂,还原性就强
D. 在化学反应中,某元素由化合态变为游
离态,此元素可能被氧化,也可能被还原
(2)除去FeCl2溶液中的少量FeCl3 ,可加入
____________;除去FeCl3溶液中的少量
FeCl2 ,可通入___________,除去FeCl2溶
液中的少量CuCl2,可加入__________。D铁粉氯气铁粉H+、Cu2+、Fe3+Fe2+目标七:用分类的观点建立本章的思维导图。
