2019-2020学年广东省广州市九年级(上)第八周周测化学试卷(解析版)
文档属性
| 名称 | 2019-2020学年广东省广州市九年级(上)第八周周测化学试卷(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 162.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-11-23 00:00:00 | ||
图片预览




文档简介
2019-2020学年广东省广州市九年级(上)第八周周测化学试卷
一、选择题(本题包括14个小题,每小题只有一个选项符合题意,每小题1分,共14分)
1.(1分)下列变化中属于化学变化的是( )
A.苹果腐烂 B.粗盐潮解 C.干冰升华 D.蔗糖溶解
2.(1分)下列实验操作中,正确的是( )
A.滴加液体 B.过滤
C.稀释浓硫酸 D.称量固体
3.(1分)学习化学可以帮助你变得聪明,防止走人生活和学习的某些误区.你认为下列说法不正确的是( )
A.水银不是银,而是金属汞
B.铅笔芯中不含铅,主要是石墨和粘土
C.黄铜不是铜,而是铜合金
D.苛性钠不是钠,而是一种常见的盐
4.(1分)分子、原子、离子等都是构成物质的微粒。下列物质由离子构成的是( )
A.氯化钠 B.黄金 C.金刚石 D.冰
5.(1分)下列事实的结论或解释中不正确的是( )
A.缉毒犬能根据其气味发现毒品﹣﹣说明分子在不断运动
B.物质的热胀冷缩现象﹣﹣说明分子的大小随温度升降而改变
C.酸碱中和反应都能生成水﹣﹣实质是H+与OH﹣结合生成了H2O
D.铝制品有抗腐蚀性能﹣﹣实质是表面生成了致密氧化膜起保护作用
6.(1分)2016年底,“蒜你狠”又一次卷土重来.大蒜具有很强的杀菌能力,因为蒜头里含有中的一种有效成分“硫化二丙烯”(C3H5SC3H5),具有一定的杀菌食疗价值.下列有关以硫化二丙烯的说法不正确的是( )
A.硫化二丙烯的相对分子质量为114
B.使用大蒜消炎杀菌宜用生蒜
C.硫化二丙烯分子中碳、氢、硫元素质量比为36:5:16
D.硫化二丙烯由6个碳原子、10个氢原子和1个硫原子构成
7.(1分)﹣定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表:关于此反应,下列认识不正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 1 30 17 2
反应后质量/g M 31 0 18
A.该反应是分解反应
B.甲肯定是催化剂
C.表中M是1
D.该反应符合质量守恒定律
8.(1分)分类法是化学学习和研究的重要方法之一,下列分类正确的是( )
A.有机物:CH4、H2CO3、CH3COOH
B.盐:苏打、小苏打、硫酸铝
C.混合物:空气、石油、冰水共存物
D.合成材料:塑料、涤纶、合金
9.(1分)下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
A.锌和稀盐酸
B.氧化铁固体和盐酸
C.稀硫酸和烧碱溶液
D.碳酸钾溶液和硝酸钠溶液
10.(1分)在pH=l的无色溶液中能大量共存的离子组是( )
A.NH4+、Zn2+、Cl﹣、SO42﹣ B.K+、Ba2+,OH﹣、NO3﹣
C.Mg2+、Cu2+、Cl﹣、SO42﹣ D.Na+、Cl﹣、Ba2+、SO42﹣
11.(1分)下列化肥属于复合肥的是( )
A.KNO3 B.CO(NH2)2 C.K2SO4 D.Ca3(PO4)2
12.(1分)除去下列物质中含有的少量杂质,所选用的试剂不正确的是( )
序号 混合物 除杂试剂
A 一氧化碳中混有少量二氧化碳 足量的澄清石灰水
B 碳粉中混有少量氧化铜粉末 足量的稀盐酸
C 碳酸钙中混有少量氯化钠 足量的水
D 稀盐酸中混有少量稀硫酸 足量的硝酸钡溶液
A.A B.B C.C D.D
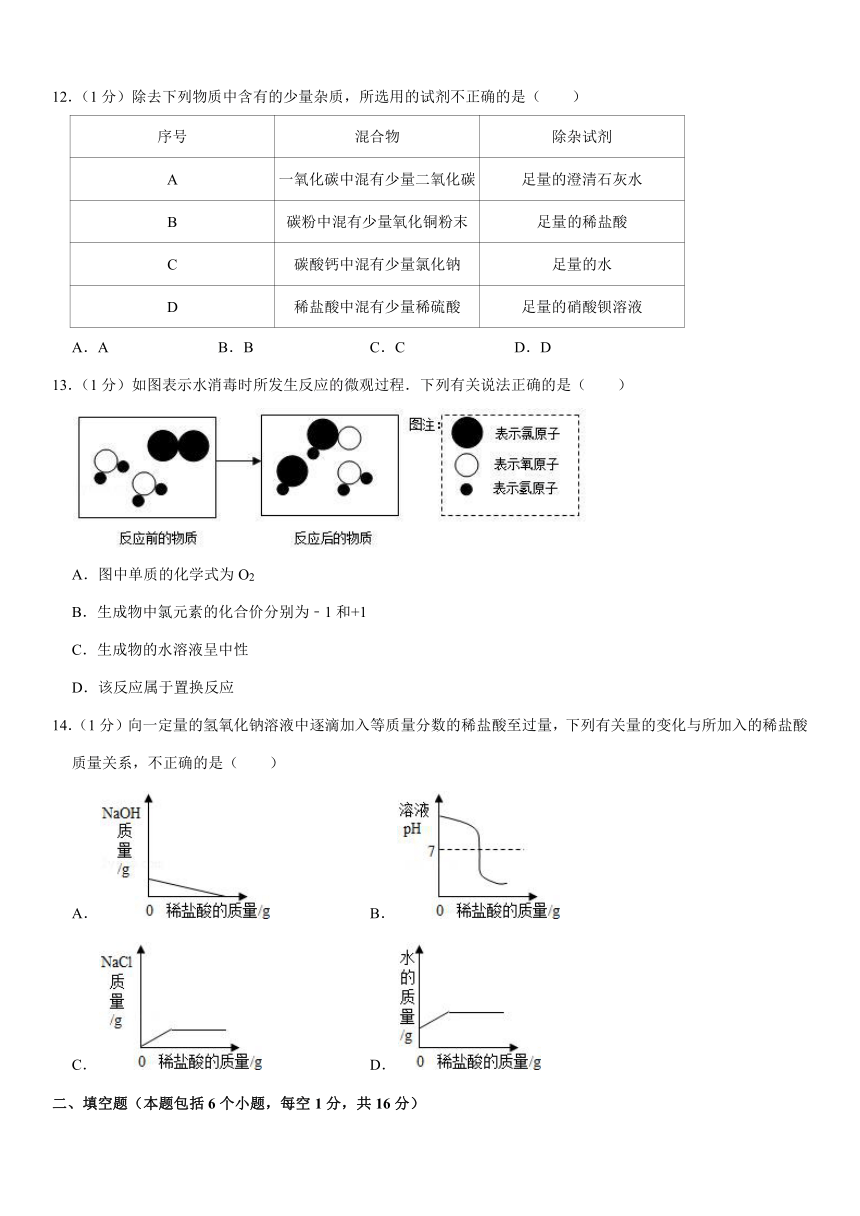
13.(1分)如图表示水消毒时所发生反应的微观过程.下列有关说法正确的是( )
A.图中单质的化学式为O2
B.生成物中氯元素的化合价分别为﹣1和+1
C.生成物的水溶液呈中性
D.该反应属于置换反应
14.(1分)向一定量的氢氧化钠溶液中逐滴加入等质量分数的稀盐酸至过量,下列有关量的变化与所加入的稀盐酸质量关系,不正确的是( )
A. B.
C. D.
二、填空题(本题包括6个小题,每空1分,共16分)
15.(2分)用化学用语填空:
(1)空气中含量最多的物质是 :
(2)在地壳中含量最多的前两位元素形成的化合物是 。
16.(2分)“神舟”十号飞船于2013年6月11日成功发射,航天员在太空的第一餐是五谷饼干,苹果罐头,五香鳕鱼,雪菜等.这些食物为航天员提供的主要营养素有 、 (任写两种)
17.(3分)周末中午,小明父母不在家,小明在家自己煮方便面.
(1)方便面中使用的食盐是加碘盐,人体中缺碘可能患有的疾病是 ;
(2)若小明用天然气煮方便面,请问天然气主要成份燃烧的化学方程式是 ,方便面煮熟后关闭燃气阀门,此操作运用的灭火原理是 .
18.(3分)学习化学使我们的生活更加美好.
(1)PM2.5是指大气中直径小于或等于2.5微米的颗粒物.雾霾天气尽量避免外出,外出时使用PM2.5口罩,该口罩中使用了活性炭,这是利用了活性炭的 作用;
(2)酸雨是指pH小于5.6的降水,煤燃烧时排放出 (写出一种主要物质的化学式)等污染物,这些气体或气体在空气中发生反应后的生成物溶于水,会形成酸雨;
(3)“低碳”是一种生活理念,也是一种生活态度.杭州G20峰会用车以腾势为代表的新能源汽车与“西湖蓝”一起成为国内外嘉宾的美好回忆.绿色新能源汽车有效的实现了低碳原理,其中“低碳”指的是 .
19.(3分)A、B、C三种固体物质的溶解度曲线如图所示,请回答下列问题.
(1)10℃时,A物质的溶解度是 ;
(2)30℃时,分别将相同质量的A、B两种物质的饱和溶液冷却到10℃,析出晶体较少的物质是 (填A或B);
(3)把C的饱和溶液从10℃升温到30℃,其溶液的溶质质量分数 (填“变大”“变小”或“不变”).
20.(3分)如图所示是A、B、C、D四种物质之间的相互转化关系,四种物质中均含有相同的金属元素.C是难溶于水的蓝色物质,受热时能形成两种氧化物.
(1)C转化为D时产生的现象是 .
(2)D转化为A的化学方程式为 .
(3)B转化为C的基本反应类型是 .
三、简答题(本题包括4个小题,共10分)
21.(3分)如图是实验室常用的制取气体的装置
(1)采用A装置制取气体时,反应物的状态和反应条件需满足什么要求?
(2)B装置可以制取多种气体,请写出制取其中一种气体的化学方程式。
(3)可采用C装置(气体由d口进入)收集的一种气体,并用简单的方法验证该气体。
22.(3分)请用化学方程式表示下列反应原理
(1)生石灰用作食品包装袋内的干燥剂
(2)用电解水的方法制取氢气
(3)加热高锰酸钾制取氧气 .
23.(2分)在硝酸银、硝酸铜的混合溶液中加入一定量的锌粉,反应停止后过滤,滤液仍为蓝色。滤液中一定含有的溶质是 (填化学式),滤渣中一定含有的物质是 (填化学式)。
24.(2分)有些化学反应有明显的现象,而有些化学反应必须借助一定的装置来判断反应是否发生.在探究CO2和NaOH是否发生化学变化时,某校化学探究小组的同学设计了以下四种实验装置.
回答下列问题:
(1)从上述四种装置中请你选择你感兴趣的一个装置描述实验现象.我选择的装置及现象是
(2)上述四种实验设计所依据的共同原理是 .
四、综合应用题(共10分)
25.(10分)我们日常生活中离不开食盐,食盐的主要成分是氯化钠.
(1)元素周期表中钠元素的信息如图1所示,对图中信息理解正确的是
A.钠属于非金属元素 B.钠原子的实际质量为22.99g
C.钠原子的中子数为 11 D.钠元素的原子结构示意图为
(2)海水晒制得到的粗盐中常含有难溶性的泥沙和可溶性的MgCl2、CaCl2等杂质,除去粗盐中泥沙等难溶性杂质的步骤为:溶解、过滤和蒸发.三步操作中均用到的一种玻璃仪器是 蒸发操作中该仪器的作用是 ,除去可溶性的MgCl2、CaCl2等杂质,可依次加入过量的NaOH和Na2CO3溶液,然后过滤,滤液中的溶质为 ,请写出除去杂质MgCl2的化学方程式 .
(3)用提纯后的食盐配制一瓶图2溶液需氯化钠 g,若用量筒量取水时俯视度数(其他操作正确)则所配溶液的质量分数 .(填“偏大”、“偏小”或“不变”)
(4)某同学想测定配制的氯化钠溶液的溶质质量分数.取100g氯化钠溶液,加入足量的硝酸银溶液,生成14.35g沉淀.试计算配制的氯化钠溶液中溶质质量分数.
2019-2020学年广东省广州市九年级(上)第八周周测化学试卷
参考答案与试题解析
一、选择题(本题包括14个小题,每小题只有一个选项符合题意,每小题1分,共14分)
1.【解答】解:A、苹果腐烂的过程中有对人体有害新物质生成,属于化学变化。
B、粗盐潮解是因为粗盐中含有杂质氯化镁,氯化钙,这些杂质易吸收水分发生潮解,没有新物质生成,属于物理变化。
C、干冰升华的过程中只是状态发生改变,没有新物质生成,属于物理变化。
D、蔗糖溶解的过程中没有新物质生成,属于物理变化。
故选:A。
2.【解答】解:A、胶头滴管要垂悬在试管上方,不能伸入试管内,故A操作错误;
B、过滤时,用玻璃棒引流液体,漏斗下端紧靠烧杯内壁,故B操作错误;
C、稀释浓硫酸时不能将水倒入浓硫酸中要将浓硫酸倒入水中,防止水浮在浓硫酸的水面上沸腾溅出,故C操作错误;
D、使用托盘天平称量药品时,具有强腐蚀性的药品需要在烧杯中称量,其它药品也不能直接放在托盘上称量,应该在两个托盘上分别垫上两张大小相同的纸片,故D操作正确。
故选:D。
3.【解答】解:A、水银不是银,而是金属汞,常温常压下呈液态,有毒。说法正确;
B、铅笔芯中不含铅,主要是石墨和粘土。说法正确;
C、黄铜不是铜,而是铜合金。说法正确;
D、苛性钠不是钠,是氢氧化钠(NaOH)是一种碱。说法错误。
故选:D。
4.【解答】解:A、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故选项正确。
B、黄金属于金属单质,是由金原子直接构成的,故选项错误。
C、金刚石属于固态非金属单质,是由碳原子直接构成的,故选项错误。
D、冰是固态的水,水是由非金属元素组成的化合物,是由水分子构成的,故选项错误。
故选:A。
5.【解答】解:A、缉毒犬能根据气味发现毒品,是因为毒品中含有的分子是在不断运动的,向四周扩散,使缉毒犬闻到毒品气味,故选项解释正确。
B、物质的热胀冷缩现象,说明分子的间隔随温度升降而改变,不是大小,故选项解释错误。
C、酸碱中和反应都能生成水实质是H+与OH﹣结合生成了H2O,故选项解释正确。
D、铝制品有抗腐蚀性能,实质是表面生成了致密氧化膜,阻止里面的铝进一步被氧化,故选项解释正确。
故选:B。
6.【解答】解:A.硫化二丙烯(C3H5SC3H5)的相对分子质量为12×6+32+1×10=114,故正确;
B.大蒜具有很强的杀菌能力,所以使用大蒜消炎杀菌宜用生蒜,故正确;
C.硫化二丙烯中碳、氢、硫元素质量比为(12×6):(1×10):32=36:5:16,故正确;
D.硫化二丙烯是由分子构成的,而不是由原子直接构成的,故错误。
故选:D。
7.【解答】解:由表中数据分析可知,反应前后乙的质量增加了31g﹣30g=1g,故是生成物,生成的质量为1g;同理可以确定丙是反应物,参加反应的质量为17g﹣0g=17g;丁是生成物,生成的质量为18g﹣2g=16g;由质量守恒定律,甲的质量应不变,故M的数值为18g﹣5g=1g。
A、该反应的反应物为丙,生成物是乙和丁,符合“一变多”的形式,属于分解反应,故选项说法正确。
B、甲的质量应不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
C、甲的质量应不变,故M的数值为18g﹣5g=1g,故选项说法正确。
D、任何化学反应均遵守质量守恒定律,该反应符合质量守恒定律,故选项说法正确。
故选:B。
8.【解答】解:A、H2CO3属于无机物,错误;
B、苏打、小苏打、硫酸铝都属于盐类物质,正确;
C、冰水共存物是纯净物,错误;
D、合金是金属材料,错误;
故选:B。
9.【解答】解:A、锌和稀盐酸反应生成氯化锌,故溶液质量增大,故选项错误;
B、氧化铁固体和盐酸反应,有水和氯化铁溶液生成,所得溶液的质量比反应前溶液的总质量增加;故选项错误。
C、稀硫酸和烧碱溶液反应生成硫酸钠和水,反应后没有气体或沉淀生成,混合后溶液的总质量不变,故选项正确。
D、碳酸钾溶液和硝酸钠溶液混合,交换成分没有沉淀、气体或水生成,不能发生复分解反应,故选项错误。
故选:C。
10.【解答】解:pH为1的水溶液显酸性,水溶液中含有大量的H+。
A、四种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,且不存在有色离子,故选项正确。
B、H+、OH﹣在溶液中能结合生成水,不能在酸性溶液中大量共存,故选项错误。
C、四种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,但Cu2+的水溶液显蓝色,故选项错误。
D、SO42﹣、Ba2+在溶液中能结合生成不溶于酸的硫酸钡沉淀,不能在酸性溶液中大量共存,故选项错误。
故选:A。
11.【解答】解:A、KNO3中含有氮元素和钾元素,属于复合肥,故A正确。
B、CO(NH2)2中含有氮元素,属于氮肥,故B错。
C、K2SO4中含有钾元素,属于钾肥,故C错;
D、Ca3(PO4)2中含有磷元素,属于磷肥,故D错。
故选:A。
12.【解答】解:A、CO2能与澄清石灰水反应生成碳酸钙沉淀和水,CO不与澄清石灰水反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确。
B、CuO能与稀盐酸反应生成氯化铜和水,碳粉不与稀盐酸反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确。
C、氯化钠易溶于水,碳酸钙难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的试剂正确。
D、稀硫酸能与足量的硝酸钡溶液反应生成硫酸钡沉淀和硝酸,能除去杂质但引入了新的杂质硝酸,不符合除杂原则,故选项所采取的试剂错误。
故选:D。
13.【解答】解:由水消毒时所发生反应的微观过程可知,各物质反应的微粒个数关系是:
由上图可知,反应的化学方程式为:Cl2+H2O=HCl+HClO。
A、由图示可知,单质的化学式为Cl2,故A错误;
B、在氯化氢中氯元素的化合价是﹣1,在HClO中氯元素的化合价是+1,故B正确;
C、生成物中的两种物质都是酸性物质,溶液呈酸性,故C错误;
D、置换反应的特点是单质与化合物生成单质与化合物,该反应的生成物不符合该特点,不是置换反应,故D错误。
故选:B。
14.【解答】解:A、氢氧化钠和稀盐酸反应生成氯化钠和水,随着反应的发生氢氧化钠的质量逐渐减少,直至为零,故图象正确;
B、氢氧化钠溶液显碱性,pH大于7,盐酸显酸性,pH小于7,向NaOH溶液中逐滴加入稀盐酸时,溶液的pH逐渐减小,当盐酸过量时,溶液的pH小于7,故图象正确;
C、氢氧化钠溶液和盐酸反应生成氯化钠和水,随着反应的发生氯化钠的质量从零开始不断增加,直至反应结束,故图象正确;
D、氢氧化钠溶液和稀盐酸中有水,因此图象的起点不是零;氢氧化钠溶液和盐酸反应生成氯化钠和水,稀盐酸中也含有水,因此随着反应的发生,水的质量不断增加,反应完后由于稀盐酸中也含有水,水的质量应还是增加,故图象错误;
故选:D。
二、填空题(本题包括6个小题,每空1分,共16分)
15.【解答】解:(1)空气中含量最多的物质是氮气,故填:N2;
(2)地壳中含量居前两位的元素所形成化合物是二氧化硅,其化学式为SiO2,故填:SiO2;
16.【解答】解:五谷饼干中富含糖类、苹果罐头中含有维生素、五香鲽鱼中富含无机盐、蛋白质与油脂、雪菜中富含维生素.
故答案为:蛋白质;糖类(答案合理即可).
17.【解答】解:(1)碘是合成甲状腺激素的原料,人体中缺碘可能患有的疾病是甲状腺肿大;
故填:甲状腺肿大;
(2)天然气的主要成分是甲烷,甲烷燃烧生成水和二氧化碳,甲烷燃烧的化学方程式为:CH4+2O22H2O+CO2. 关闭阀门时,相当于移走了可燃物,从而实现灭火.
故填:CH4+2O22H2O+CO2;隔离可燃物.
18.【解答】解:(1)PM2.5是指大气中直径小于或等于2.5微米的颗粒物.雾霾天气尽量避免外出,外出时使用PM2.5口罩,该口罩中使用了活性炭,这是利用了活性炭的吸附作用;
(2)酸雨是指pH小于5.6的降水,煤燃烧时排放出二氧化氮、二氧化硫等污染物,这些气体或气体在空气中发生反应后的生成物溶于水,会形成酸雨;
(3)“低碳”是一种生活理念,也是一种生活态度.杭州G20峰会用车以腾势为代表的新能源汽车与“西湖蓝”一起成为国内外嘉宾的美好回忆.绿色新能源汽车有效的实现了低碳原理,其中“低碳”指的是减少空气中的二氧化碳含量.
故答案为:吸附;NO2、SO2;减少空气中的二氧化碳含量
19.【解答】解:(1)据图可以看出,在10℃时,A物质的溶解度是30g,故填:30g;
(2)30℃时,分别将相同质量的A、B两种物质的饱和溶液冷却到10℃,B的溶解度随温度的升高变化不大,故析出晶体较少的物质是B,故填:B;
(3)把C的饱和溶液从10℃升温到30℃,溶解度增大,会析出晶体,故其溶液的溶质质量分数会变小,故填:变小.
20.【解答】解:(1)氢氧化铜在加热时生成氧化铜和水,现象是:固体由蓝色变为黑色,容器壁上有水珠产生;故答案为:固体由蓝色变为黑色,容器壁上有水珠产生;
(2)氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,故答案为:CO+CuOCu+CO2;
(3)硝酸铜和氢氧化钠反应生成氢氧化铜和硝酸钠,属于复分解反应;故答案为:复分解反应;
三、简答题(本题包括4个小题,共10分)
21.【解答】解:(1)采用A装置制取气体时,反应物的状态是固态,反应条件是需要加热;故答案为:反应物的状态是固态,反应条件是需要加热;
(2)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;或验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;故答案为:2H2O22H2O+O2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑;(合理即可)
(3)可采用C装置(气体由d口进入)收集的一种气体,用简单的方法验证该气体的方法是:如果收集的是氧气,把一根带火星的木条放在c导管口,木条复燃,证明是氧气;故答案为:如果收集的是氧气,把一根带火星的木条放在c导管口,木条复燃,证明是氧气;(合理即可)
22.【解答】解:(1)氧化钙与水反应生成氢氧化钙;故填:CaO+H2O=Ca(OH)2;
(2)电解水制取氢气:反应物为水,反应条件为电解,生成物为氢气和氧气;故填:2H2O2H2↑+O2↑;
(3)高锰酸钾在加热的条件下分解为锰酸钾、二氧化锰和氧气;故填:2KMnO4K2MnO4+MnO2+O2↑.
23.【解答】解:向硝酸银和硝酸铜的混合溶液中,加入一定量的锌粉,则锌能与硝酸银反应生成硝酸锌和银,能与硝酸铜反应生成硝酸锌和铜,反应停止后过滤,滤液仍为蓝色,说明滤液中含有硝酸铜,所以滤液中一定含有的溶质是 Cu(NO3)2 和 Zn(NO3)2,滤渣中一定含有的物质是Ag
故答案是:Cu(NO3)2 和 Zn(NO3)2,Ag。
24.【解答】解:(1)A、二氧化碳被消耗,与外界有气压差,所以溶液进入试管内;
B、二氧化碳与氢氧化钠反应,锥形瓶内的压强减小,所以烧杯内的水会倒吸;
C、二氧化碳被消耗,锥形瓶内的压强减小,大气压把小气球会吹大;
D、二氧化碳与氢氧化钠反应,烧瓶内的压强减小,外界压强大于内部压强,水会被大气压压入烧瓶,形成喷泉.
(2)综合上述四种实验设计所依据的共同原理是:容器内外形成的气压差.
故答案可以为:(1)A、溶液进入试管内;
(2)因二氧化碳被吸收,盛有二氧化碳的容器内的压强减小,与外界大气压形成压强差.
四、综合应用题(共10分)
25.【解答】解:(1)A、钠元素是金属元素而非金属元素,错误;
B、钠原子的相对原子质量为22.99,而非实际质量为22.99g.错误;
C、根据现有数据无法求算中子数.错误;
D、钠元素的原子结构示意图为,正确.
(2)海水晒制得到的粗盐中常含有难溶性的泥沙和可溶性的MgCl2、CaCl2等杂质,除去粗盐中泥沙等难溶性杂质的步骤为:溶解、过滤和蒸发.三步操作中均用到的一种玻璃仪器是 玻璃棒蒸发操作中该仪器的作用是 搅拌,使受热均匀,除去可溶性的MgCl2、CaCl2等杂质,可依次加入过量的NaOH和Na2CO3溶液,然后过滤,滤液中的溶质为 氯化钠、氢氧化钠、碳酸钠,请写出除去杂质MgCl2是氯化镁能与氢氧化钠反应,NaOH与杂质反应的化学方程式式:MgCl2+2NaOH=Mg (3)用提纯后的食盐配制一定质量分数食盐水,提纯后的食盐配制一瓶图2溶液,500mL即500cm3,质量为500cm3×1g/cm3=500g,需要的氯化钠的质量为500g×0.9%=4.5g.用量筒量取水时俯视读数,读数大于实际数,实际量取的水偏少.则所配制溶液的溶质质量分数偏大.
(4)设生成14.35g沉淀,所需氯化钠质量为x
NaCl+AgNO3═AgCl↓+NaNO3,
58.5 143.5
x 14.35g
=
解得:x=5.85g,
氯化钠溶液的溶质质量分数=×100%=5.85%
故答案为:
(1)D;(2)玻璃棒;搅拌,使受热均匀; 氯化钠、氢氧化钠、碳酸钠; MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(3)4.5;偏大.
(4)氯化钠溶液的溶质质量分数5.85%
一、选择题(本题包括14个小题,每小题只有一个选项符合题意,每小题1分,共14分)
1.(1分)下列变化中属于化学变化的是( )
A.苹果腐烂 B.粗盐潮解 C.干冰升华 D.蔗糖溶解
2.(1分)下列实验操作中,正确的是( )
A.滴加液体 B.过滤
C.稀释浓硫酸 D.称量固体
3.(1分)学习化学可以帮助你变得聪明,防止走人生活和学习的某些误区.你认为下列说法不正确的是( )
A.水银不是银,而是金属汞
B.铅笔芯中不含铅,主要是石墨和粘土
C.黄铜不是铜,而是铜合金
D.苛性钠不是钠,而是一种常见的盐
4.(1分)分子、原子、离子等都是构成物质的微粒。下列物质由离子构成的是( )
A.氯化钠 B.黄金 C.金刚石 D.冰
5.(1分)下列事实的结论或解释中不正确的是( )
A.缉毒犬能根据其气味发现毒品﹣﹣说明分子在不断运动
B.物质的热胀冷缩现象﹣﹣说明分子的大小随温度升降而改变
C.酸碱中和反应都能生成水﹣﹣实质是H+与OH﹣结合生成了H2O
D.铝制品有抗腐蚀性能﹣﹣实质是表面生成了致密氧化膜起保护作用
6.(1分)2016年底,“蒜你狠”又一次卷土重来.大蒜具有很强的杀菌能力,因为蒜头里含有中的一种有效成分“硫化二丙烯”(C3H5SC3H5),具有一定的杀菌食疗价值.下列有关以硫化二丙烯的说法不正确的是( )
A.硫化二丙烯的相对分子质量为114
B.使用大蒜消炎杀菌宜用生蒜
C.硫化二丙烯分子中碳、氢、硫元素质量比为36:5:16
D.硫化二丙烯由6个碳原子、10个氢原子和1个硫原子构成
7.(1分)﹣定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表:关于此反应,下列认识不正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 1 30 17 2
反应后质量/g M 31 0 18
A.该反应是分解反应
B.甲肯定是催化剂
C.表中M是1
D.该反应符合质量守恒定律
8.(1分)分类法是化学学习和研究的重要方法之一,下列分类正确的是( )
A.有机物:CH4、H2CO3、CH3COOH
B.盐:苏打、小苏打、硫酸铝
C.混合物:空气、石油、冰水共存物
D.合成材料:塑料、涤纶、合金
9.(1分)下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
A.锌和稀盐酸
B.氧化铁固体和盐酸
C.稀硫酸和烧碱溶液
D.碳酸钾溶液和硝酸钠溶液
10.(1分)在pH=l的无色溶液中能大量共存的离子组是( )
A.NH4+、Zn2+、Cl﹣、SO42﹣ B.K+、Ba2+,OH﹣、NO3﹣
C.Mg2+、Cu2+、Cl﹣、SO42﹣ D.Na+、Cl﹣、Ba2+、SO42﹣
11.(1分)下列化肥属于复合肥的是( )
A.KNO3 B.CO(NH2)2 C.K2SO4 D.Ca3(PO4)2
12.(1分)除去下列物质中含有的少量杂质,所选用的试剂不正确的是( )
序号 混合物 除杂试剂
A 一氧化碳中混有少量二氧化碳 足量的澄清石灰水
B 碳粉中混有少量氧化铜粉末 足量的稀盐酸
C 碳酸钙中混有少量氯化钠 足量的水
D 稀盐酸中混有少量稀硫酸 足量的硝酸钡溶液
A.A B.B C.C D.D
13.(1分)如图表示水消毒时所发生反应的微观过程.下列有关说法正确的是( )
A.图中单质的化学式为O2
B.生成物中氯元素的化合价分别为﹣1和+1
C.生成物的水溶液呈中性
D.该反应属于置换反应
14.(1分)向一定量的氢氧化钠溶液中逐滴加入等质量分数的稀盐酸至过量,下列有关量的变化与所加入的稀盐酸质量关系,不正确的是( )
A. B.
C. D.
二、填空题(本题包括6个小题,每空1分,共16分)
15.(2分)用化学用语填空:
(1)空气中含量最多的物质是 :
(2)在地壳中含量最多的前两位元素形成的化合物是 。
16.(2分)“神舟”十号飞船于2013年6月11日成功发射,航天员在太空的第一餐是五谷饼干,苹果罐头,五香鳕鱼,雪菜等.这些食物为航天员提供的主要营养素有 、 (任写两种)
17.(3分)周末中午,小明父母不在家,小明在家自己煮方便面.
(1)方便面中使用的食盐是加碘盐,人体中缺碘可能患有的疾病是 ;
(2)若小明用天然气煮方便面,请问天然气主要成份燃烧的化学方程式是 ,方便面煮熟后关闭燃气阀门,此操作运用的灭火原理是 .
18.(3分)学习化学使我们的生活更加美好.
(1)PM2.5是指大气中直径小于或等于2.5微米的颗粒物.雾霾天气尽量避免外出,外出时使用PM2.5口罩,该口罩中使用了活性炭,这是利用了活性炭的 作用;
(2)酸雨是指pH小于5.6的降水,煤燃烧时排放出 (写出一种主要物质的化学式)等污染物,这些气体或气体在空气中发生反应后的生成物溶于水,会形成酸雨;
(3)“低碳”是一种生活理念,也是一种生活态度.杭州G20峰会用车以腾势为代表的新能源汽车与“西湖蓝”一起成为国内外嘉宾的美好回忆.绿色新能源汽车有效的实现了低碳原理,其中“低碳”指的是 .
19.(3分)A、B、C三种固体物质的溶解度曲线如图所示,请回答下列问题.
(1)10℃时,A物质的溶解度是 ;
(2)30℃时,分别将相同质量的A、B两种物质的饱和溶液冷却到10℃,析出晶体较少的物质是 (填A或B);
(3)把C的饱和溶液从10℃升温到30℃,其溶液的溶质质量分数 (填“变大”“变小”或“不变”).
20.(3分)如图所示是A、B、C、D四种物质之间的相互转化关系,四种物质中均含有相同的金属元素.C是难溶于水的蓝色物质,受热时能形成两种氧化物.
(1)C转化为D时产生的现象是 .
(2)D转化为A的化学方程式为 .
(3)B转化为C的基本反应类型是 .
三、简答题(本题包括4个小题,共10分)
21.(3分)如图是实验室常用的制取气体的装置
(1)采用A装置制取气体时,反应物的状态和反应条件需满足什么要求?
(2)B装置可以制取多种气体,请写出制取其中一种气体的化学方程式。
(3)可采用C装置(气体由d口进入)收集的一种气体,并用简单的方法验证该气体。
22.(3分)请用化学方程式表示下列反应原理
(1)生石灰用作食品包装袋内的干燥剂
(2)用电解水的方法制取氢气
(3)加热高锰酸钾制取氧气 .
23.(2分)在硝酸银、硝酸铜的混合溶液中加入一定量的锌粉,反应停止后过滤,滤液仍为蓝色。滤液中一定含有的溶质是 (填化学式),滤渣中一定含有的物质是 (填化学式)。
24.(2分)有些化学反应有明显的现象,而有些化学反应必须借助一定的装置来判断反应是否发生.在探究CO2和NaOH是否发生化学变化时,某校化学探究小组的同学设计了以下四种实验装置.
回答下列问题:
(1)从上述四种装置中请你选择你感兴趣的一个装置描述实验现象.我选择的装置及现象是
(2)上述四种实验设计所依据的共同原理是 .
四、综合应用题(共10分)
25.(10分)我们日常生活中离不开食盐,食盐的主要成分是氯化钠.
(1)元素周期表中钠元素的信息如图1所示,对图中信息理解正确的是
A.钠属于非金属元素 B.钠原子的实际质量为22.99g
C.钠原子的中子数为 11 D.钠元素的原子结构示意图为
(2)海水晒制得到的粗盐中常含有难溶性的泥沙和可溶性的MgCl2、CaCl2等杂质,除去粗盐中泥沙等难溶性杂质的步骤为:溶解、过滤和蒸发.三步操作中均用到的一种玻璃仪器是 蒸发操作中该仪器的作用是 ,除去可溶性的MgCl2、CaCl2等杂质,可依次加入过量的NaOH和Na2CO3溶液,然后过滤,滤液中的溶质为 ,请写出除去杂质MgCl2的化学方程式 .
(3)用提纯后的食盐配制一瓶图2溶液需氯化钠 g,若用量筒量取水时俯视度数(其他操作正确)则所配溶液的质量分数 .(填“偏大”、“偏小”或“不变”)
(4)某同学想测定配制的氯化钠溶液的溶质质量分数.取100g氯化钠溶液,加入足量的硝酸银溶液,生成14.35g沉淀.试计算配制的氯化钠溶液中溶质质量分数.
2019-2020学年广东省广州市九年级(上)第八周周测化学试卷
参考答案与试题解析
一、选择题(本题包括14个小题,每小题只有一个选项符合题意,每小题1分,共14分)
1.【解答】解:A、苹果腐烂的过程中有对人体有害新物质生成,属于化学变化。
B、粗盐潮解是因为粗盐中含有杂质氯化镁,氯化钙,这些杂质易吸收水分发生潮解,没有新物质生成,属于物理变化。
C、干冰升华的过程中只是状态发生改变,没有新物质生成,属于物理变化。
D、蔗糖溶解的过程中没有新物质生成,属于物理变化。
故选:A。
2.【解答】解:A、胶头滴管要垂悬在试管上方,不能伸入试管内,故A操作错误;
B、过滤时,用玻璃棒引流液体,漏斗下端紧靠烧杯内壁,故B操作错误;
C、稀释浓硫酸时不能将水倒入浓硫酸中要将浓硫酸倒入水中,防止水浮在浓硫酸的水面上沸腾溅出,故C操作错误;
D、使用托盘天平称量药品时,具有强腐蚀性的药品需要在烧杯中称量,其它药品也不能直接放在托盘上称量,应该在两个托盘上分别垫上两张大小相同的纸片,故D操作正确。
故选:D。
3.【解答】解:A、水银不是银,而是金属汞,常温常压下呈液态,有毒。说法正确;
B、铅笔芯中不含铅,主要是石墨和粘土。说法正确;
C、黄铜不是铜,而是铜合金。说法正确;
D、苛性钠不是钠,是氢氧化钠(NaOH)是一种碱。说法错误。
故选:D。
4.【解答】解:A、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故选项正确。
B、黄金属于金属单质,是由金原子直接构成的,故选项错误。
C、金刚石属于固态非金属单质,是由碳原子直接构成的,故选项错误。
D、冰是固态的水,水是由非金属元素组成的化合物,是由水分子构成的,故选项错误。
故选:A。
5.【解答】解:A、缉毒犬能根据气味发现毒品,是因为毒品中含有的分子是在不断运动的,向四周扩散,使缉毒犬闻到毒品气味,故选项解释正确。
B、物质的热胀冷缩现象,说明分子的间隔随温度升降而改变,不是大小,故选项解释错误。
C、酸碱中和反应都能生成水实质是H+与OH﹣结合生成了H2O,故选项解释正确。
D、铝制品有抗腐蚀性能,实质是表面生成了致密氧化膜,阻止里面的铝进一步被氧化,故选项解释正确。
故选:B。
6.【解答】解:A.硫化二丙烯(C3H5SC3H5)的相对分子质量为12×6+32+1×10=114,故正确;
B.大蒜具有很强的杀菌能力,所以使用大蒜消炎杀菌宜用生蒜,故正确;
C.硫化二丙烯中碳、氢、硫元素质量比为(12×6):(1×10):32=36:5:16,故正确;
D.硫化二丙烯是由分子构成的,而不是由原子直接构成的,故错误。
故选:D。
7.【解答】解:由表中数据分析可知,反应前后乙的质量增加了31g﹣30g=1g,故是生成物,生成的质量为1g;同理可以确定丙是反应物,参加反应的质量为17g﹣0g=17g;丁是生成物,生成的质量为18g﹣2g=16g;由质量守恒定律,甲的质量应不变,故M的数值为18g﹣5g=1g。
A、该反应的反应物为丙,生成物是乙和丁,符合“一变多”的形式,属于分解反应,故选项说法正确。
B、甲的质量应不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
C、甲的质量应不变,故M的数值为18g﹣5g=1g,故选项说法正确。
D、任何化学反应均遵守质量守恒定律,该反应符合质量守恒定律,故选项说法正确。
故选:B。
8.【解答】解:A、H2CO3属于无机物,错误;
B、苏打、小苏打、硫酸铝都属于盐类物质,正确;
C、冰水共存物是纯净物,错误;
D、合金是金属材料,错误;
故选:B。
9.【解答】解:A、锌和稀盐酸反应生成氯化锌,故溶液质量增大,故选项错误;
B、氧化铁固体和盐酸反应,有水和氯化铁溶液生成,所得溶液的质量比反应前溶液的总质量增加;故选项错误。
C、稀硫酸和烧碱溶液反应生成硫酸钠和水,反应后没有气体或沉淀生成,混合后溶液的总质量不变,故选项正确。
D、碳酸钾溶液和硝酸钠溶液混合,交换成分没有沉淀、气体或水生成,不能发生复分解反应,故选项错误。
故选:C。
10.【解答】解:pH为1的水溶液显酸性,水溶液中含有大量的H+。
A、四种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,且不存在有色离子,故选项正确。
B、H+、OH﹣在溶液中能结合生成水,不能在酸性溶液中大量共存,故选项错误。
C、四种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,但Cu2+的水溶液显蓝色,故选项错误。
D、SO42﹣、Ba2+在溶液中能结合生成不溶于酸的硫酸钡沉淀,不能在酸性溶液中大量共存,故选项错误。
故选:A。
11.【解答】解:A、KNO3中含有氮元素和钾元素,属于复合肥,故A正确。
B、CO(NH2)2中含有氮元素,属于氮肥,故B错。
C、K2SO4中含有钾元素,属于钾肥,故C错;
D、Ca3(PO4)2中含有磷元素,属于磷肥,故D错。
故选:A。
12.【解答】解:A、CO2能与澄清石灰水反应生成碳酸钙沉淀和水,CO不与澄清石灰水反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确。
B、CuO能与稀盐酸反应生成氯化铜和水,碳粉不与稀盐酸反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确。
C、氯化钠易溶于水,碳酸钙难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的试剂正确。
D、稀硫酸能与足量的硝酸钡溶液反应生成硫酸钡沉淀和硝酸,能除去杂质但引入了新的杂质硝酸,不符合除杂原则,故选项所采取的试剂错误。
故选:D。
13.【解答】解:由水消毒时所发生反应的微观过程可知,各物质反应的微粒个数关系是:
由上图可知,反应的化学方程式为:Cl2+H2O=HCl+HClO。
A、由图示可知,单质的化学式为Cl2,故A错误;
B、在氯化氢中氯元素的化合价是﹣1,在HClO中氯元素的化合价是+1,故B正确;
C、生成物中的两种物质都是酸性物质,溶液呈酸性,故C错误;
D、置换反应的特点是单质与化合物生成单质与化合物,该反应的生成物不符合该特点,不是置换反应,故D错误。
故选:B。
14.【解答】解:A、氢氧化钠和稀盐酸反应生成氯化钠和水,随着反应的发生氢氧化钠的质量逐渐减少,直至为零,故图象正确;
B、氢氧化钠溶液显碱性,pH大于7,盐酸显酸性,pH小于7,向NaOH溶液中逐滴加入稀盐酸时,溶液的pH逐渐减小,当盐酸过量时,溶液的pH小于7,故图象正确;
C、氢氧化钠溶液和盐酸反应生成氯化钠和水,随着反应的发生氯化钠的质量从零开始不断增加,直至反应结束,故图象正确;
D、氢氧化钠溶液和稀盐酸中有水,因此图象的起点不是零;氢氧化钠溶液和盐酸反应生成氯化钠和水,稀盐酸中也含有水,因此随着反应的发生,水的质量不断增加,反应完后由于稀盐酸中也含有水,水的质量应还是增加,故图象错误;
故选:D。
二、填空题(本题包括6个小题,每空1分,共16分)
15.【解答】解:(1)空气中含量最多的物质是氮气,故填:N2;
(2)地壳中含量居前两位的元素所形成化合物是二氧化硅,其化学式为SiO2,故填:SiO2;
16.【解答】解:五谷饼干中富含糖类、苹果罐头中含有维生素、五香鲽鱼中富含无机盐、蛋白质与油脂、雪菜中富含维生素.
故答案为:蛋白质;糖类(答案合理即可).
17.【解答】解:(1)碘是合成甲状腺激素的原料,人体中缺碘可能患有的疾病是甲状腺肿大;
故填:甲状腺肿大;
(2)天然气的主要成分是甲烷,甲烷燃烧生成水和二氧化碳,甲烷燃烧的化学方程式为:CH4+2O22H2O+CO2. 关闭阀门时,相当于移走了可燃物,从而实现灭火.
故填:CH4+2O22H2O+CO2;隔离可燃物.
18.【解答】解:(1)PM2.5是指大气中直径小于或等于2.5微米的颗粒物.雾霾天气尽量避免外出,外出时使用PM2.5口罩,该口罩中使用了活性炭,这是利用了活性炭的吸附作用;
(2)酸雨是指pH小于5.6的降水,煤燃烧时排放出二氧化氮、二氧化硫等污染物,这些气体或气体在空气中发生反应后的生成物溶于水,会形成酸雨;
(3)“低碳”是一种生活理念,也是一种生活态度.杭州G20峰会用车以腾势为代表的新能源汽车与“西湖蓝”一起成为国内外嘉宾的美好回忆.绿色新能源汽车有效的实现了低碳原理,其中“低碳”指的是减少空气中的二氧化碳含量.
故答案为:吸附;NO2、SO2;减少空气中的二氧化碳含量
19.【解答】解:(1)据图可以看出,在10℃时,A物质的溶解度是30g,故填:30g;
(2)30℃时,分别将相同质量的A、B两种物质的饱和溶液冷却到10℃,B的溶解度随温度的升高变化不大,故析出晶体较少的物质是B,故填:B;
(3)把C的饱和溶液从10℃升温到30℃,溶解度增大,会析出晶体,故其溶液的溶质质量分数会变小,故填:变小.
20.【解答】解:(1)氢氧化铜在加热时生成氧化铜和水,现象是:固体由蓝色变为黑色,容器壁上有水珠产生;故答案为:固体由蓝色变为黑色,容器壁上有水珠产生;
(2)氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,故答案为:CO+CuOCu+CO2;
(3)硝酸铜和氢氧化钠反应生成氢氧化铜和硝酸钠,属于复分解反应;故答案为:复分解反应;
三、简答题(本题包括4个小题,共10分)
21.【解答】解:(1)采用A装置制取气体时,反应物的状态是固态,反应条件是需要加热;故答案为:反应物的状态是固态,反应条件是需要加热;
(2)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;或验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;故答案为:2H2O22H2O+O2↑或CaCO3+2HCl=CaCl2+H2O+CO2↑;(合理即可)
(3)可采用C装置(气体由d口进入)收集的一种气体,用简单的方法验证该气体的方法是:如果收集的是氧气,把一根带火星的木条放在c导管口,木条复燃,证明是氧气;故答案为:如果收集的是氧气,把一根带火星的木条放在c导管口,木条复燃,证明是氧气;(合理即可)
22.【解答】解:(1)氧化钙与水反应生成氢氧化钙;故填:CaO+H2O=Ca(OH)2;
(2)电解水制取氢气:反应物为水,反应条件为电解,生成物为氢气和氧气;故填:2H2O2H2↑+O2↑;
(3)高锰酸钾在加热的条件下分解为锰酸钾、二氧化锰和氧气;故填:2KMnO4K2MnO4+MnO2+O2↑.
23.【解答】解:向硝酸银和硝酸铜的混合溶液中,加入一定量的锌粉,则锌能与硝酸银反应生成硝酸锌和银,能与硝酸铜反应生成硝酸锌和铜,反应停止后过滤,滤液仍为蓝色,说明滤液中含有硝酸铜,所以滤液中一定含有的溶质是 Cu(NO3)2 和 Zn(NO3)2,滤渣中一定含有的物质是Ag
故答案是:Cu(NO3)2 和 Zn(NO3)2,Ag。
24.【解答】解:(1)A、二氧化碳被消耗,与外界有气压差,所以溶液进入试管内;
B、二氧化碳与氢氧化钠反应,锥形瓶内的压强减小,所以烧杯内的水会倒吸;
C、二氧化碳被消耗,锥形瓶内的压强减小,大气压把小气球会吹大;
D、二氧化碳与氢氧化钠反应,烧瓶内的压强减小,外界压强大于内部压强,水会被大气压压入烧瓶,形成喷泉.
(2)综合上述四种实验设计所依据的共同原理是:容器内外形成的气压差.
故答案可以为:(1)A、溶液进入试管内;
(2)因二氧化碳被吸收,盛有二氧化碳的容器内的压强减小,与外界大气压形成压强差.
四、综合应用题(共10分)
25.【解答】解:(1)A、钠元素是金属元素而非金属元素,错误;
B、钠原子的相对原子质量为22.99,而非实际质量为22.99g.错误;
C、根据现有数据无法求算中子数.错误;
D、钠元素的原子结构示意图为,正确.
(2)海水晒制得到的粗盐中常含有难溶性的泥沙和可溶性的MgCl2、CaCl2等杂质,除去粗盐中泥沙等难溶性杂质的步骤为:溶解、过滤和蒸发.三步操作中均用到的一种玻璃仪器是 玻璃棒蒸发操作中该仪器的作用是 搅拌,使受热均匀,除去可溶性的MgCl2、CaCl2等杂质,可依次加入过量的NaOH和Na2CO3溶液,然后过滤,滤液中的溶质为 氯化钠、氢氧化钠、碳酸钠,请写出除去杂质MgCl2是氯化镁能与氢氧化钠反应,NaOH与杂质反应的化学方程式式:MgCl2+2NaOH=Mg (3)用提纯后的食盐配制一定质量分数食盐水,提纯后的食盐配制一瓶图2溶液,500mL即500cm3,质量为500cm3×1g/cm3=500g,需要的氯化钠的质量为500g×0.9%=4.5g.用量筒量取水时俯视读数,读数大于实际数,实际量取的水偏少.则所配制溶液的溶质质量分数偏大.
(4)设生成14.35g沉淀,所需氯化钠质量为x
NaCl+AgNO3═AgCl↓+NaNO3,
58.5 143.5
x 14.35g
=
解得:x=5.85g,
氯化钠溶液的溶质质量分数=×100%=5.85%
故答案为:
(1)D;(2)玻璃棒;搅拌,使受热均匀; 氯化钠、氢氧化钠、碳酸钠; MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(3)4.5;偏大.
(4)氯化钠溶液的溶质质量分数5.85%
同课章节目录
