人教版九年级化学上册课件:第六单元 碳和碳的化合物复习(共29张PPT)
文档属性
| 名称 | 人教版九年级化学上册课件:第六单元 碳和碳的化合物复习(共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-11-26 09:42:05 | ||
图片预览



文档简介
课件29张PPT。第六单元复习
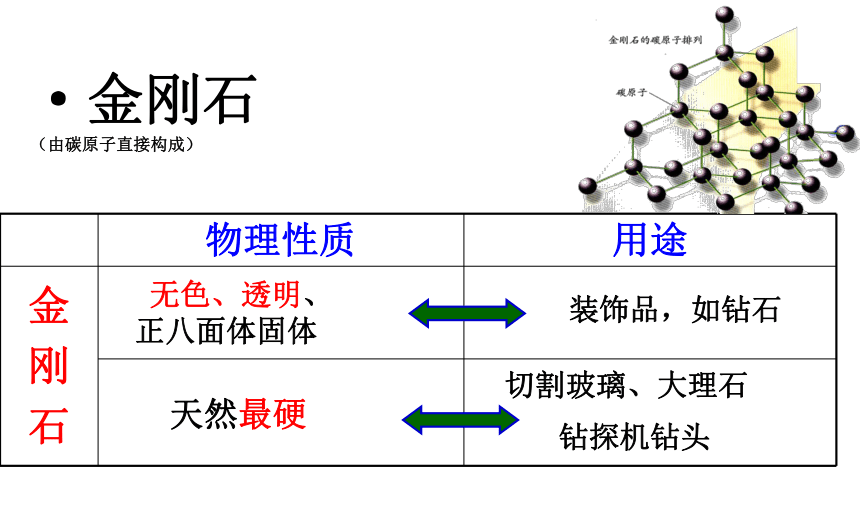
无色、透明、
正八面体固体 天然最硬装饰品,如钻石·金刚石
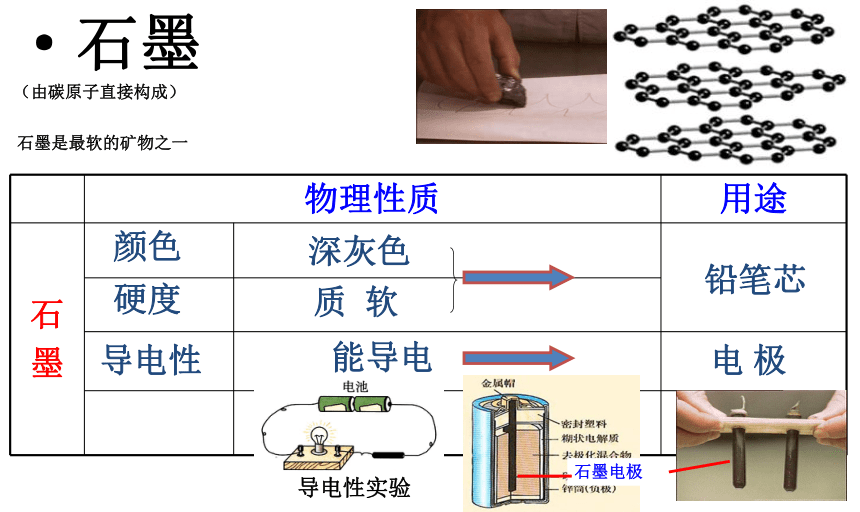
(由碳原子直接构成)铅笔芯电 极导电性实验石墨是最软的矿物之一·石墨
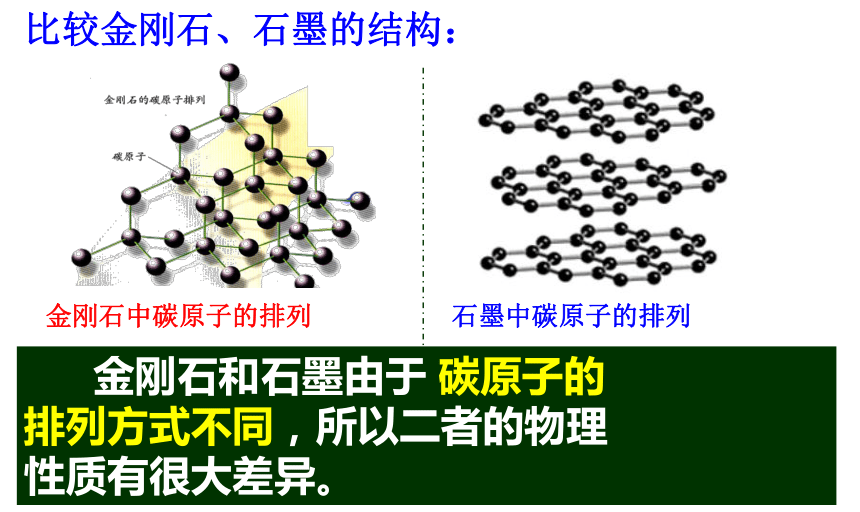
(由碳原子直接构成) 碳原子在空间构成立体的网状的连续的结构,所以其质地坚硬。金刚石中碳原子的排列比较金刚石、石墨的结构: 碳原子呈平面层状结构,层与层之间作用力小,很容易滑动,所以其质软,有滑腻感。石墨中碳原子的排列 金刚石和石墨由于 碳原子的
排列方式不同,所以二者的物理
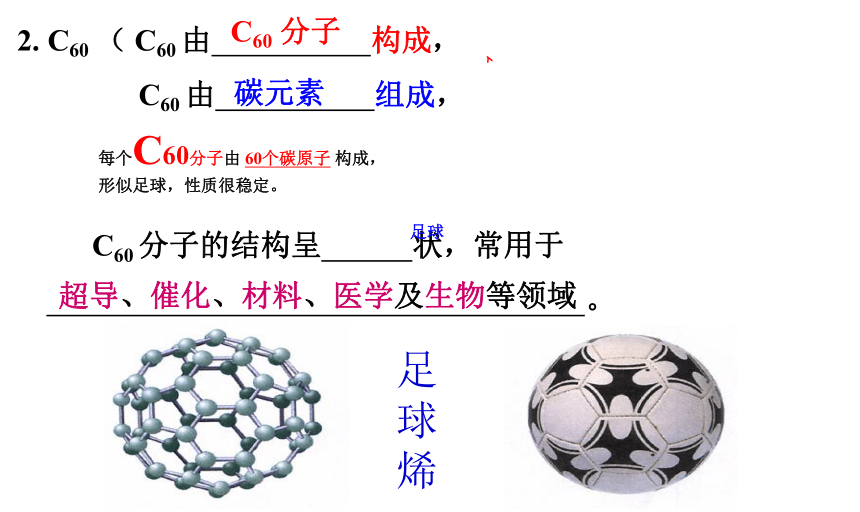
性质有很大差异。 研究表明,透明的金刚石,
深灰色的石墨和足球状的C60,
都是由碳元素组成的单质,但
它们的碳原子排列方式不同,
因此它们的物理性质存在着差异。 金刚石石墨C60 为什么碳的化学性质
在常温下比较稳定呢? 碳原子的最外层电子数为4,
不易得失电子,
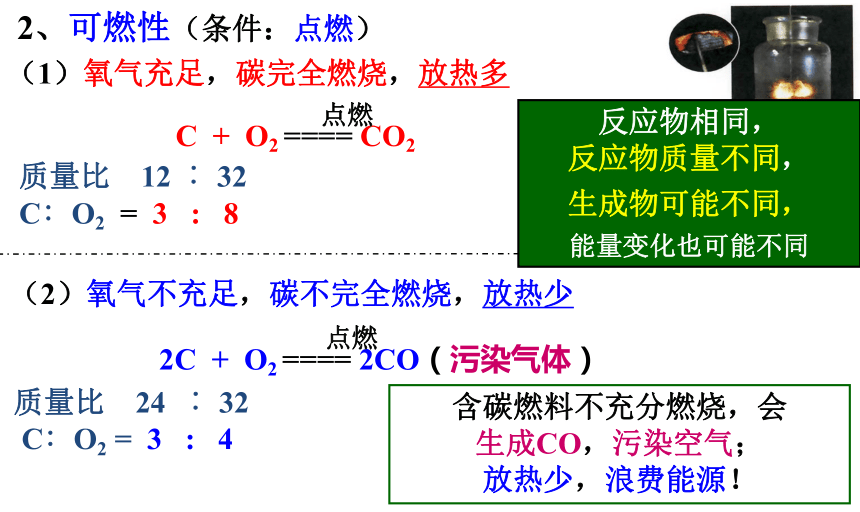
所以,常温下碳的化性比较稳定。二、碳的化学性质1、常温下,碳的化学性质稳定 古代字画为什么能保存 那么长的时间而不变色呢?教材P110~1112、可燃性(条件:点燃)C + O2 ==== CO2点燃(2)氧气不充足,碳不完全燃烧,放热少2C + O2 ==== 2CO(污染气体)点燃质量比 12 ︰ 32
C∶O2 = 3 : 8 质量比 24 ︰ 32
C∶O2 = 3 : 4(1)氧气充足,碳完全燃烧,放热多反应物相同,
反应物质量不同,
生成物可能不同,
能量变化也可能不同含碳燃料不充分燃烧,会
生成CO,污染空气;
放热少,浪费能源!定量分析mC∶mO2
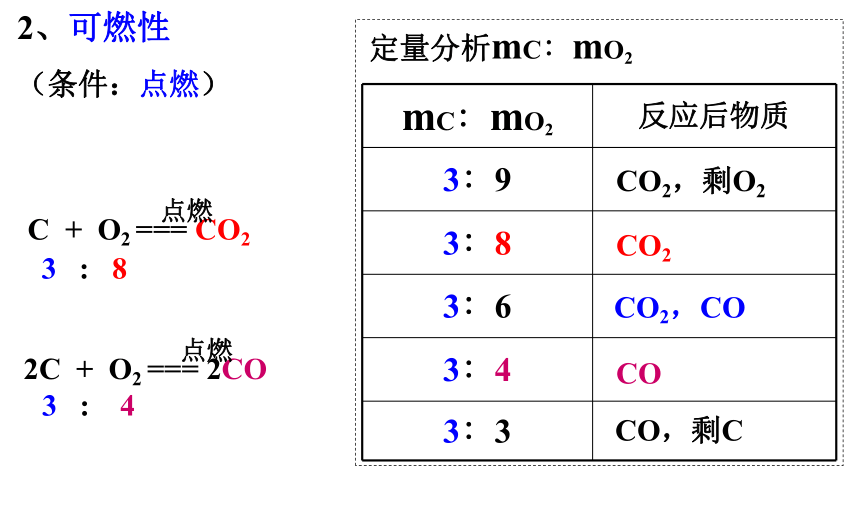
C + O2 === CO22C + O2 === 2CO3 : 8 3 : 4点燃点燃CO2,剩O2CO2COCO2,COCO,剩C2、可燃性
(条件:点燃)二、碳的化学性质教材P110 ~111 它们都是由碳元素组成的单质,它们化学性质都由碳原子的最外层电子数(4个)决定,因此它们的化学性质相似!
【如:常温都有稳定性;点燃都具有可燃性】 金刚石、石墨、C60中碳原子的排列方式不同,所以它们的物理性质不同。2、碳有可燃性(条件:点燃)发生装置由反应物状态和反应条件决定!3、碳有 还原 性(条件: )(1)实验装置(P111)—— 固体加热 不同之处:有网罩 作 用:集中火焰,提高温度。 二、碳的化学性质高温与加热KClO3和MnO2制O2的发生装置比较【木炭 和 氧化铜 高温反应】教材P110~111 注意:① 试管口略向下倾斜的原因是: ; ② 实验结束,先移出导管,
后熄灭酒精灯防止石灰水倒吸,炸裂试管。防止冷凝水倒流,炸裂试管二、碳的化学性质(1)实验装置(P111)—— 固体加热 教材P110~1113、碳有 还原 性(条件: )高温黑 黑 红 (2)实验现象① 黑色粉末变红,
② 生成气体使石灰水变浑浊。(3)化学方程式:二、碳的化学性质(1)实验装置(P111)—— 固体加热 教材P110~1113、碳有 还原 性(条件: )高温3、还原性---小二黑打架,出了一点血,
冒了一口气C + 2CuO === 2Cu + CO2↑高温现象1、黑色粉末(碳粉,氧化铜粉末)变成红色(铜粉)
2、有使澄清石灰水变浑浊的气体产生注意:1.酸是用稀盐酸而不能用浓盐酸
或硫酸!原因是:浓盐酸具有挥发性使制得的气体不纯,硫酸与碳酸钙反应后产生的硫酸钙微溶于水,会阻止硫酸与碳酸钙进一步发生反应,反应无法彻底进行。
2. 实验室 一般不用碳酸钠来制取CO2一、药品及反应原理
药品:石灰石(或大理石)和稀盐酸
原理:CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
回忆:实验室制取氧气的两套装置过氧化氢溶液与二氧化锰混合制取氧气加热高锰酸钾制取氧气这套装置能否用于实验室制取二氧化碳?这套装置呢?提示:回忆实验室制取二氧化碳的药品及反应原理小结二氧化碳实验室制法1)药品选择2)反应原理3)装置选择4)收集方法6)验满方法5)检验方法7)操作步骤及注意事项(石灰石和稀盐酸)(固液常温型)(向上排空气法)(澄清石灰水变浑浊)(燃着的木条放瓶口, 木条熄灭)二氧化碳的性质实验与探究一
根据【实验6-4】完成下列实验:
如图所示,将二氧化碳气体慢慢顺着
烧杯内壁倒入烧杯中,观察现象并分析。扩展:还有哪些事例能证明CO2的密度比空气大?下层的蜡烛先灭,上层的蜡烛后灭CO2不能燃烧,也不支持燃烧,
密度比空气大。实验与探究二
把收集满二氧化碳气体的质地较软的塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,振荡。
观察现象并分析。矿泉水瓶变形了CO2溶于水,瓶内气体减少,
压强变小,导致矿泉水瓶变形。思考:把第四张试纸小心烘烤后, 颜色有什么变化?
试纸变红色没有明显
变化没有明显
变化试纸变红色二氧化碳气体溶于水后生成了酸—碳酸
方程式:CO2+H2O=H2CO3
现象:红色又变为蓝色结论:碳酸不稳定H2CO3 = CO2 ↑ +H2O实验与探究四
把澄清石灰石倒少量到试管中,然后通入二氧化碳气体,注意观察现象。 澄清石灰水变浑浊反应生成了白色沉淀CaCO3
CO2+Ca(OH)2==CaCO3↓+H2O
1.点燃两支蜡烛(如图所示),沿烧杯内壁缓缓倾倒二氧化碳。
(1)在本实验中,我们可以看到的实验现
象是:__________________________________。
(2)说明了二氧化碳的性质有:??? ????、
。
2.如图所示,往一个收集满二氧化碳气体的质地
较软的塑料瓶中加入约1/2体积的水,立即旋紧瓶盖,
振荡。
现象是: 。
说明二氧化碳 。蜡烛由低到高依次熄灭不燃烧也不支持燃烧塑料瓶瘪了二氧化碳能溶于水密度大于空气 CO2CO色、态、味溶解性 密度 无色无气味
气 体 无色无气味
气 体 能溶于水 (1:1) 难溶于水 (1: 0.02) 比空气大(1.977克/升)物理性质气 体CO与CO2的物理性质的比较:发出淡蓝色火焰放出热量黑色固体红色固体COCuO澄清的石灰水一氧化碳还原氧化铁Fe2O3(红色粉末)CO尾气处理装置发生装置收集装置尾气处理装置CO2CO不能燃烧,也不支持燃烧难溶于水,也不与水反应 不能使石灰水变浑浊 没有毒性具有毒性(与血红蛋白结合)化学性质 原因:分子的构成不同
无色、透明、
正八面体固体 天然最硬装饰品,如钻石·金刚石
(由碳原子直接构成)铅笔芯电 极导电性实验石墨是最软的矿物之一·石墨
(由碳原子直接构成) 碳原子在空间构成立体的网状的连续的结构,所以其质地坚硬。金刚石中碳原子的排列比较金刚石、石墨的结构: 碳原子呈平面层状结构,层与层之间作用力小,很容易滑动,所以其质软,有滑腻感。石墨中碳原子的排列 金刚石和石墨由于 碳原子的
排列方式不同,所以二者的物理
性质有很大差异。 研究表明,透明的金刚石,
深灰色的石墨和足球状的C60,
都是由碳元素组成的单质,但
它们的碳原子排列方式不同,
因此它们的物理性质存在着差异。 金刚石石墨C60 为什么碳的化学性质
在常温下比较稳定呢? 碳原子的最外层电子数为4,
不易得失电子,
所以,常温下碳的化性比较稳定。二、碳的化学性质1、常温下,碳的化学性质稳定 古代字画为什么能保存 那么长的时间而不变色呢?教材P110~1112、可燃性(条件:点燃)C + O2 ==== CO2点燃(2)氧气不充足,碳不完全燃烧,放热少2C + O2 ==== 2CO(污染气体)点燃质量比 12 ︰ 32
C∶O2 = 3 : 8 质量比 24 ︰ 32
C∶O2 = 3 : 4(1)氧气充足,碳完全燃烧,放热多反应物相同,
反应物质量不同,
生成物可能不同,
能量变化也可能不同含碳燃料不充分燃烧,会
生成CO,污染空气;
放热少,浪费能源!定量分析mC∶mO2
C + O2 === CO22C + O2 === 2CO3 : 8 3 : 4点燃点燃CO2,剩O2CO2COCO2,COCO,剩C2、可燃性
(条件:点燃)二、碳的化学性质教材P110 ~111 它们都是由碳元素组成的单质,它们化学性质都由碳原子的最外层电子数(4个)决定,因此它们的化学性质相似!
【如:常温都有稳定性;点燃都具有可燃性】 金刚石、石墨、C60中碳原子的排列方式不同,所以它们的物理性质不同。2、碳有可燃性(条件:点燃)发生装置由反应物状态和反应条件决定!3、碳有 还原 性(条件: )(1)实验装置(P111)—— 固体加热 不同之处:有网罩 作 用:集中火焰,提高温度。 二、碳的化学性质高温与加热KClO3和MnO2制O2的发生装置比较【木炭 和 氧化铜 高温反应】教材P110~111 注意:① 试管口略向下倾斜的原因是: ; ② 实验结束,先移出导管,
后熄灭酒精灯防止石灰水倒吸,炸裂试管。防止冷凝水倒流,炸裂试管二、碳的化学性质(1)实验装置(P111)—— 固体加热 教材P110~1113、碳有 还原 性(条件: )高温黑 黑 红 (2)实验现象① 黑色粉末变红,
② 生成气体使石灰水变浑浊。(3)化学方程式:二、碳的化学性质(1)实验装置(P111)—— 固体加热 教材P110~1113、碳有 还原 性(条件: )高温3、还原性---小二黑打架,出了一点血,
冒了一口气C + 2CuO === 2Cu + CO2↑高温现象1、黑色粉末(碳粉,氧化铜粉末)变成红色(铜粉)
2、有使澄清石灰水变浑浊的气体产生注意:1.酸是用稀盐酸而不能用浓盐酸
或硫酸!原因是:浓盐酸具有挥发性使制得的气体不纯,硫酸与碳酸钙反应后产生的硫酸钙微溶于水,会阻止硫酸与碳酸钙进一步发生反应,反应无法彻底进行。
2. 实验室 一般不用碳酸钠来制取CO2一、药品及反应原理
药品:石灰石(或大理石)和稀盐酸
原理:CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
回忆:实验室制取氧气的两套装置过氧化氢溶液与二氧化锰混合制取氧气加热高锰酸钾制取氧气这套装置能否用于实验室制取二氧化碳?这套装置呢?提示:回忆实验室制取二氧化碳的药品及反应原理小结二氧化碳实验室制法1)药品选择2)反应原理3)装置选择4)收集方法6)验满方法5)检验方法7)操作步骤及注意事项(石灰石和稀盐酸)(固液常温型)(向上排空气法)(澄清石灰水变浑浊)(燃着的木条放瓶口, 木条熄灭)二氧化碳的性质实验与探究一
根据【实验6-4】完成下列实验:
如图所示,将二氧化碳气体慢慢顺着
烧杯内壁倒入烧杯中,观察现象并分析。扩展:还有哪些事例能证明CO2的密度比空气大?下层的蜡烛先灭,上层的蜡烛后灭CO2不能燃烧,也不支持燃烧,
密度比空气大。实验与探究二
把收集满二氧化碳气体的质地较软的塑料瓶中加入约1/3体积的水,立即旋紧瓶盖,振荡。
观察现象并分析。矿泉水瓶变形了CO2溶于水,瓶内气体减少,
压强变小,导致矿泉水瓶变形。思考:把第四张试纸小心烘烤后, 颜色有什么变化?
试纸变红色没有明显
变化没有明显
变化试纸变红色二氧化碳气体溶于水后生成了酸—碳酸
方程式:CO2+H2O=H2CO3
现象:红色又变为蓝色结论:碳酸不稳定H2CO3 = CO2 ↑ +H2O实验与探究四
把澄清石灰石倒少量到试管中,然后通入二氧化碳气体,注意观察现象。 澄清石灰水变浑浊反应生成了白色沉淀CaCO3
CO2+Ca(OH)2==CaCO3↓+H2O
1.点燃两支蜡烛(如图所示),沿烧杯内壁缓缓倾倒二氧化碳。
(1)在本实验中,我们可以看到的实验现
象是:__________________________________。
(2)说明了二氧化碳的性质有:??? ????、
。
2.如图所示,往一个收集满二氧化碳气体的质地
较软的塑料瓶中加入约1/2体积的水,立即旋紧瓶盖,
振荡。
现象是: 。
说明二氧化碳 。蜡烛由低到高依次熄灭不燃烧也不支持燃烧塑料瓶瘪了二氧化碳能溶于水密度大于空气 CO2CO色、态、味溶解性 密度 无色无气味
气 体 无色无气味
气 体 能溶于水 (1:1) 难溶于水 (1: 0.02) 比空气大(1.977克/升)物理性质气 体CO与CO2的物理性质的比较:发出淡蓝色火焰放出热量黑色固体红色固体COCuO澄清的石灰水一氧化碳还原氧化铁Fe2O3(红色粉末)CO尾气处理装置发生装置收集装置尾气处理装置CO2CO不能燃烧,也不支持燃烧难溶于水,也不与水反应 不能使石灰水变浑浊 没有毒性具有毒性(与血红蛋白结合)化学性质 原因:分子的构成不同
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
