第三单元 人类对原子结构的认识 课件
图片预览








文档简介
(共30张PPT)
苏教版 必修1 高一化学
在你眼中…?
在化学家眼中…?
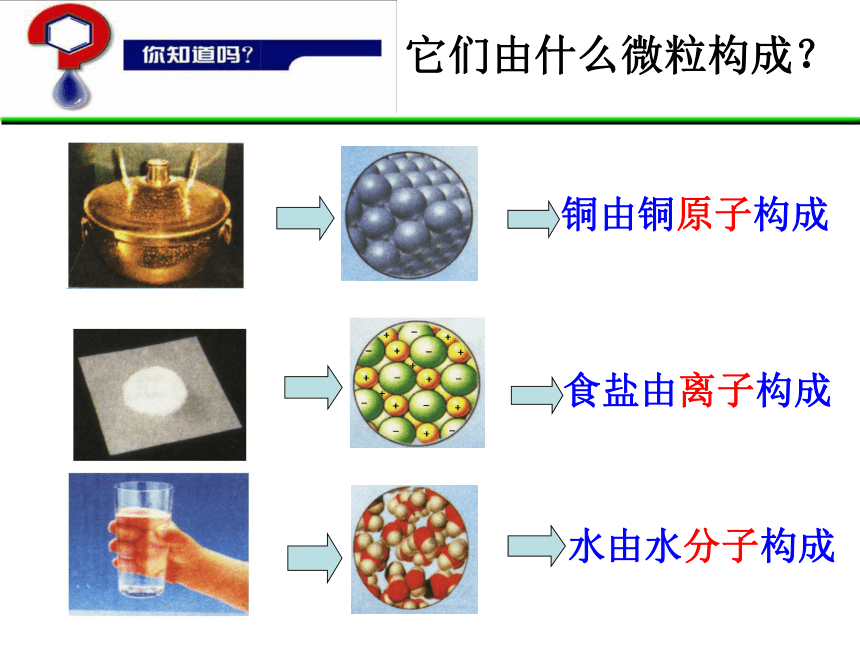
它们由什么微粒构成?
请大家结合初中学过的知识及教材P27-28的短文,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
* a.用简洁的语言表达各阶段对原子结构模型的认识特点;
* b.小组讨论:用现代的观点来探讨各个模型的论点是否正确。
2、请你谈谈从原子结构的演变得到什么启迪?
古希腊哲学家 德谟克利特
物质是由不可分割的微粒即“原子”构成的。
历史瞬间
1803年,英国科学家道尔顿提出近代原子学说,
他认为原子是化学变化中不可再分的实心球体。
历史回眸
汤姆生(1856~1940)
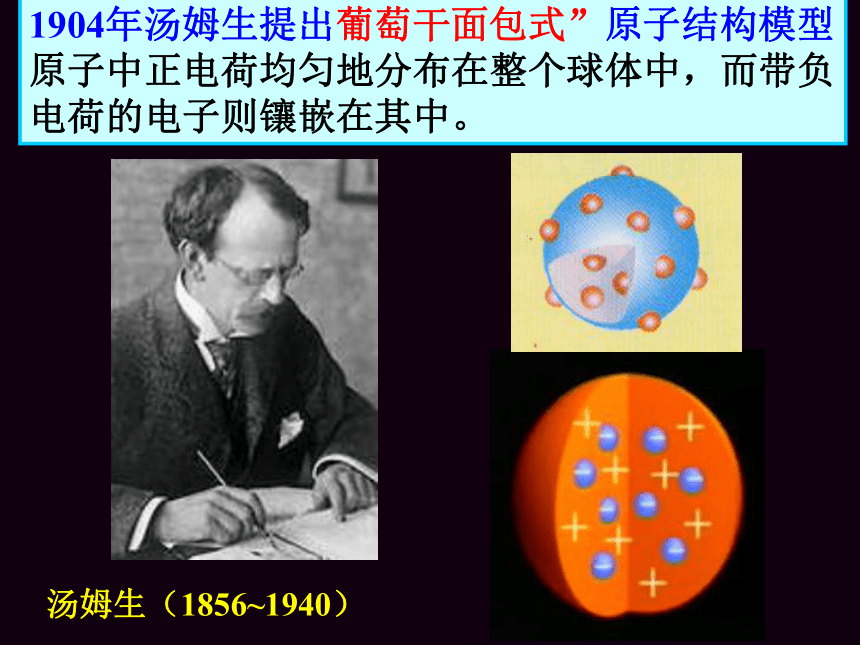
1904年汤姆生提出葡萄干面包式”原子结构模型原子中正电荷均匀地分布在整个球体中,而带负电荷的电子则镶嵌在其中。
卢瑟福(1871~1937)
1911年英国物理学家卢瑟福提出了带核的原子结构模型(行星模型)
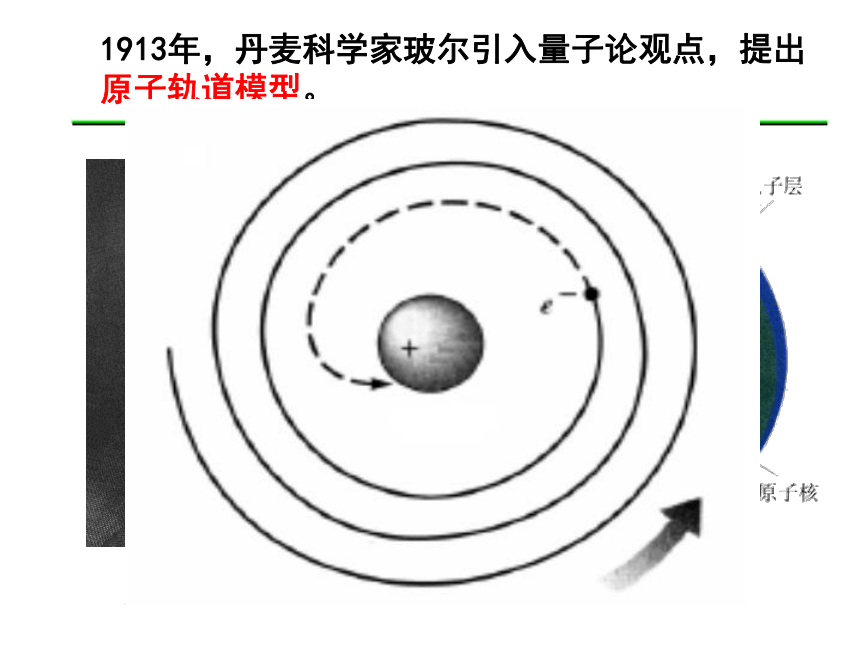
1913年,丹麦科学家玻尔引入量子论观点,提出
原子轨道模型。
1926年海森伯等提出了原子的量子力学模型。即用量子力学方法描述核外电子的运动—电子云模型
电子的波粒二象性
氢原子电子云模型
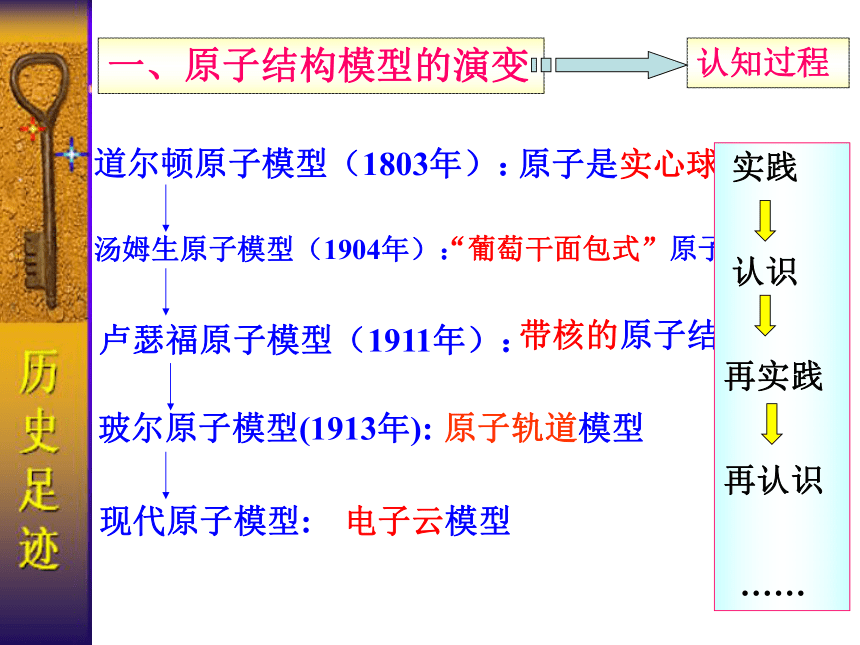
一、原子结构模型的演变
道尔顿原子模型(1803年):
原子是实心球
“葡萄干面包式”原子结构模型
带核的原子结构模型
原子轨道模型
认知过程
电子云模型
+2
He
Ar
二、原子核外电子排布
+10
Ne
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
18
第1层
第2层
第3层
2
8
8
1、原子结构示意图
该电子层上的电子数
1
2
2
1
2
2
2
2
2
2
2
2
3
4
5
6
7
8
2
2
2
2
2
2
2
2
2
2
8
8
8
8
8
8
8
8
8
8
8
8
8
7
6
5
4
3
2
1
2
1
稀有气体元素原子电子层排布
分析稀有气体的核外电子排布与其性质有什么联系?
元素
名称 元素
符号 各电子层的电子数
1 2 3 4 5 6 最外层电子数
氦 He 2 2
氖 Ne 2 8 8
氩 Ar 2 8 8 8
氪 Kr 2 8 18 8 8
氙 Xe 2 8 18 18 8 8
氡 Rn 2 8 18 32 18 8 8
1、对比稀有气体的结构,分析Mg2+、 O2 -核外电子排布特点?
氧化镁的形成
2. Mg、O为什么容易形成 Mg2+、 O2 -?在化学变化过程中改变的是什么微粒?
2、原子结构与元素性质的关系(结构决定化学性质)
原子既不容易失去电子又不容易得到电子,即原子最外层有8个电子(He为2)处于稳定。
(如He、Ne、Ar等)
原子容易失去电子或容易得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
(如,失去: Na、Mg、Al 得到: O、F、Cl)
(2)不稳定结构:
(1)稳定结构:
金属元素 非金属元素
最外层电子数:
易失 易得
<4 >4
得失电子趋势:
Na 、Mg、Al等活泼金属单质与O2、F2、Cl2等活泼非金属单质发生反应生成的化合物中,金属元素和非金属元素的化合价与其在反应中失去或得到电子的数目存在一定的关系。请同学共同探究下列问题。
1.金属单质Na 、Mg能分别与非金属单质O2、Cl2
反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
Na2O MgO NaCl MgCl2
+1
1
失e-
+2
2
失2e-
-2
6
得2e-
-1
7
得e-
2.根据Na 、Mg、O、Cl原子在反应过程中失去或者得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素化合价。
元素 化合价 原子最外层
电子数目 失去(或得到)
电子数目
Na
Mg
O
Cl
①最外层电子数﹤4 时,容易失去电子
(化合价=+失去的电子数目)
②最外层电子数>4 时,容易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
3、原子核外电子数与元素化合价的关系
二、原子核外电子的分层排布
1、原子结构示意图
2、原子结构与元素性质的关系(结构决定化学性质)
小结:
3、原子核外电子数与元素化合价的关系
道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
1、以下是一些科学家为探索原子结构所作出的重大贡献,请你以连线表示其对应关系。
①道尔顿 a、提出原子由原子核和电子构成
②汤姆生 b、发现原子中存在电子
③卢瑟福 c、提出原子核外电子在一系列稳
定的轨道上运动
④玻 尔 d、提出原子学说
2、用下面的结构示意图的字母填空:
(1)属于金属原子的是---------;
(2)属于非金属原子的是------;
(3)属于离子结构示意图的是-----;
(4)具有稳定结构的是-------。
A
B
C
C
3、 体现元素的化学性质。
A 质子数 B 中子数
C 电子数 D 最外层电子数
D
C
在1911年前后,物理学家卢瑟福把一束运动的α粒子
(质量数为4的带2个单位正电荷的质子粒),射向一片
极薄的金箔。他惊奇地发现,过去一直认为原子是“实
心球”,而由这种“实心球”紧密排列而成的金箔,竟能
让大多数α粒子畅通无阻地通过,就像金箔不在那儿似
的。但也有极少数的α粒子发生偏转,或被笔直地弹回。
根据以上实验现象能得出关于金箔中Au原子结构的一些
结论。
1.原子中存在原子核,它占原子中极小的体积;
2.原子核带正电荷;
3.原子的质量主要集中在原子核上
Back
苏教版 必修1 高一化学
在你眼中…?
在化学家眼中…?
它们由什么微粒构成?
请大家结合初中学过的知识及教材P27-28的短文,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
* a.用简洁的语言表达各阶段对原子结构模型的认识特点;
* b.小组讨论:用现代的观点来探讨各个模型的论点是否正确。
2、请你谈谈从原子结构的演变得到什么启迪?
古希腊哲学家 德谟克利特
物质是由不可分割的微粒即“原子”构成的。
历史瞬间
1803年,英国科学家道尔顿提出近代原子学说,
他认为原子是化学变化中不可再分的实心球体。
历史回眸
汤姆生(1856~1940)
1904年汤姆生提出葡萄干面包式”原子结构模型原子中正电荷均匀地分布在整个球体中,而带负电荷的电子则镶嵌在其中。
卢瑟福(1871~1937)
1911年英国物理学家卢瑟福提出了带核的原子结构模型(行星模型)
1913年,丹麦科学家玻尔引入量子论观点,提出
原子轨道模型。
1926年海森伯等提出了原子的量子力学模型。即用量子力学方法描述核外电子的运动—电子云模型
电子的波粒二象性
氢原子电子云模型
一、原子结构模型的演变
道尔顿原子模型(1803年):
原子是实心球
“葡萄干面包式”原子结构模型
带核的原子结构模型
原子轨道模型
认知过程
电子云模型
+2
He
Ar
二、原子核外电子排布
+10
Ne
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
18
第1层
第2层
第3层
2
8
8
1、原子结构示意图
该电子层上的电子数
1
2
2
1
2
2
2
2
2
2
2
2
3
4
5
6
7
8
2
2
2
2
2
2
2
2
2
2
8
8
8
8
8
8
8
8
8
8
8
8
8
7
6
5
4
3
2
1
2
1
稀有气体元素原子电子层排布
分析稀有气体的核外电子排布与其性质有什么联系?
元素
名称 元素
符号 各电子层的电子数
1 2 3 4 5 6 最外层电子数
氦 He 2 2
氖 Ne 2 8 8
氩 Ar 2 8 8 8
氪 Kr 2 8 18 8 8
氙 Xe 2 8 18 18 8 8
氡 Rn 2 8 18 32 18 8 8
1、对比稀有气体的结构,分析Mg2+、 O2 -核外电子排布特点?
氧化镁的形成
2. Mg、O为什么容易形成 Mg2+、 O2 -?在化学变化过程中改变的是什么微粒?
2、原子结构与元素性质的关系(结构决定化学性质)
原子既不容易失去电子又不容易得到电子,即原子最外层有8个电子(He为2)处于稳定。
(如He、Ne、Ar等)
原子容易失去电子或容易得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
(如,失去: Na、Mg、Al 得到: O、F、Cl)
(2)不稳定结构:
(1)稳定结构:
金属元素 非金属元素
最外层电子数:
易失 易得
<4 >4
得失电子趋势:
Na 、Mg、Al等活泼金属单质与O2、F2、Cl2等活泼非金属单质发生反应生成的化合物中,金属元素和非金属元素的化合价与其在反应中失去或得到电子的数目存在一定的关系。请同学共同探究下列问题。
1.金属单质Na 、Mg能分别与非金属单质O2、Cl2
反应生成氧化物和氯化物,请写出这些氧化物和氯化物的化学式。
Na2O MgO NaCl MgCl2
+1
1
失e-
+2
2
失2e-
-2
6
得2e-
-1
7
得e-
2.根据Na 、Mg、O、Cl原子在反应过程中失去或者得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素化合价。
元素 化合价 原子最外层
电子数目 失去(或得到)
电子数目
Na
Mg
O
Cl
①最外层电子数﹤4 时,容易失去电子
(化合价=+失去的电子数目)
②最外层电子数>4 时,容易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
3、原子核外电子数与元素化合价的关系
二、原子核外电子的分层排布
1、原子结构示意图
2、原子结构与元素性质的关系(结构决定化学性质)
小结:
3、原子核外电子数与元素化合价的关系
道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
1、以下是一些科学家为探索原子结构所作出的重大贡献,请你以连线表示其对应关系。
①道尔顿 a、提出原子由原子核和电子构成
②汤姆生 b、发现原子中存在电子
③卢瑟福 c、提出原子核外电子在一系列稳
定的轨道上运动
④玻 尔 d、提出原子学说
2、用下面的结构示意图的字母填空:
(1)属于金属原子的是---------;
(2)属于非金属原子的是------;
(3)属于离子结构示意图的是-----;
(4)具有稳定结构的是-------。
A
B
C
C
3、 体现元素的化学性质。
A 质子数 B 中子数
C 电子数 D 最外层电子数
D
C
在1911年前后,物理学家卢瑟福把一束运动的α粒子
(质量数为4的带2个单位正电荷的质子粒),射向一片
极薄的金箔。他惊奇地发现,过去一直认为原子是“实
心球”,而由这种“实心球”紧密排列而成的金箔,竟能
让大多数α粒子畅通无阻地通过,就像金箔不在那儿似
的。但也有极少数的α粒子发生偏转,或被笔直地弹回。
根据以上实验现象能得出关于金箔中Au原子结构的一些
结论。
1.原子中存在原子核,它占原子中极小的体积;
2.原子核带正电荷;
3.原子的质量主要集中在原子核上
Back
