人教版化学必修1第二章 化学物质及其变化第一节 物质的分类 (课件共52张ppt)
文档属性
| 名称 | 人教版化学必修1第二章 化学物质及其变化第一节 物质的分类 (课件共52张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-11-30 18:01:45 | ||
图片预览









文档简介
(共52张PPT)
第二章 化学物质及其变化
第一节 物质的分类
分散系及其分类
清晨,当鲜红的太阳从地平线升起时,你漫步在茂密的森林里,会看到缕缕霞光穿过树木的枝叶斑驳地铺洒在地面上;当你晚上走在城市的马路上,会看到汽车灯光产生的两条强烈的光柱(有雾的时候更明显);你还会看到当阳光透过墙上的小孔时,在较暗房间里会形成一道道光柱。这些美景的产生与胶体的重要性质——丁达尔效应密切相关。那么,什么是丁达尔效应?胶体还有哪些重要性质呢?
其实这是一类由特殊的物质群体产生的特殊现象。这类特殊的物质群体和大家熟悉的溶液都属于分散系,这就是这节我们要学习的主要内容。
分散系及其分类
1、分散系
(1)定义
分散系:把一种(或多种)物质分散在另一种(或多种)物质中所得到的混合物体系。
分散质:分散系中被分散的物质(少)。
分散剂:分散系中容纳分散质的物质(多)。
分散剂是:
氯化钠的水溶液
氯化钠
水
例:
氯化钠的水溶液
分散系是:
分散质是:
我们熟悉的溶液就是一种分散系,其中分散质称为溶质,分散剂称为溶剂。
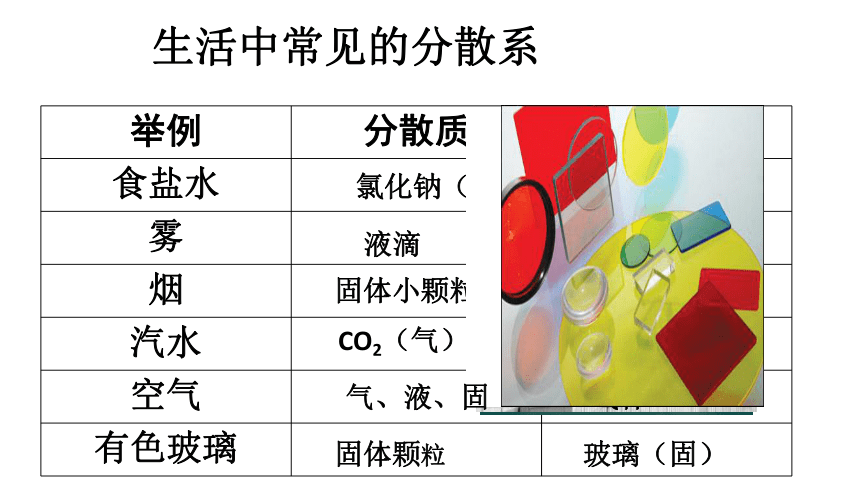
生活中常见的分散系
氯化钠(固)
水(液)
液滴
空气
固体小颗粒
空气
CO2(气)
水(液)
固体颗粒
玻璃(固)
气、液、固
气体
举例 分散质 分散剂
食盐水
雾
烟
汽水
空气
有色玻璃
(2)分散系的分类
①按分散剂和分散质的状态分
9类
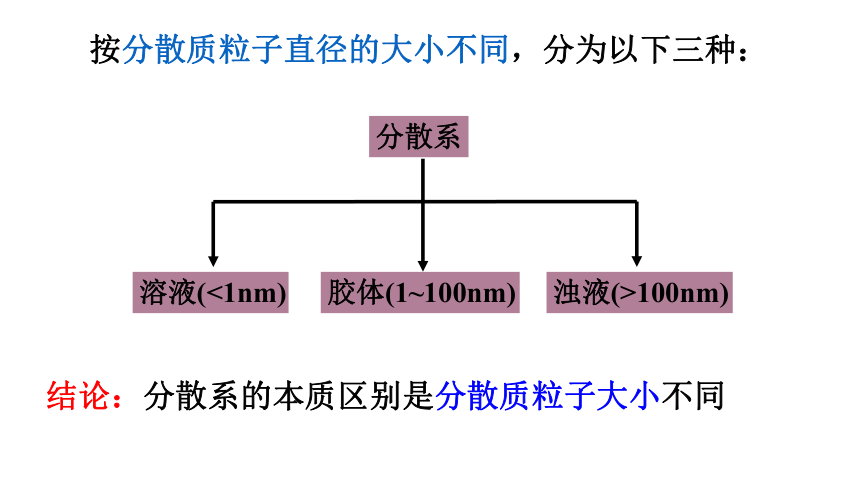
②按分散质粒子大小可分3类
胶体
<1nm
>100nm
1~100nm
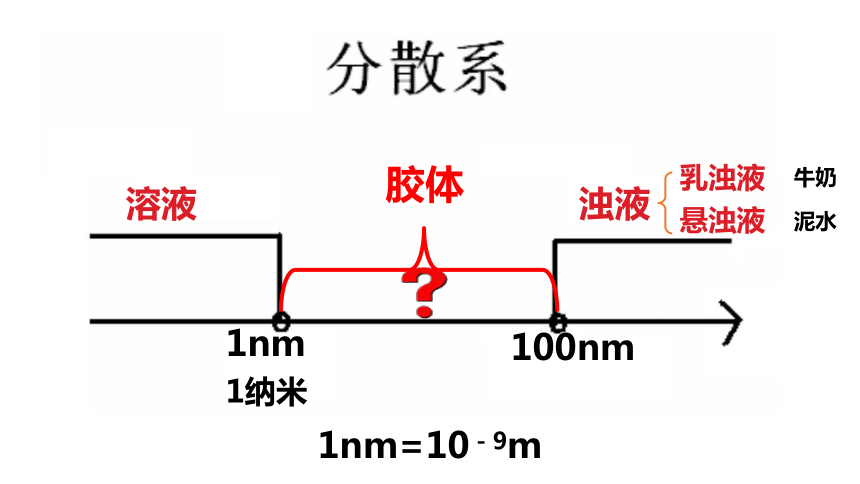
分散系 分散质粒子大小
按分散质粒子直径的大小不同,分为以下三种:
结论:分散系的本质区别是分散质粒子大小不同
溶液
浊液
1nm
100nm
乳浊液
悬浊液
1纳米
1nm=10-9m
胶体
牛奶
泥水
练习1、溶液、胶体和浊液这三种分散系的根本区别是 ( )
A.是否为大量分子或离子的 集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
B
分散质粒子的大小是胶体区别于溶液、浊液的本质特征。
2、胶体
(1)胶体定义
胶体:分散质微粒的直径在1-100nm的分散系
本质特征
注:胶体不是一类物质,而是几乎任何物质都可能形成的一种分散状态。如:NaCl溶于水形成溶液,如果分散在酒精中则可形成胶体。
(2)胶体的分类
常见的胶体——固溶胶
Cu2O——红色
CuO——蓝绿色
Co2O3——蓝色
Ni2O3——墨绿色
MnO2——紫色
常见的胶体——气溶胶
常见的胶体——液溶胶
(3)胶体的制备
原理:使分散质粒子大小在1nm---100nm之间。
a.机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小,如墨汁、碳素墨水;
(1)物理方法
b.溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水等;
【科学探究】制备Fe(OH)3胶体(P26)
取一烧杯,加入25 mL蒸馏水,加热至沸腾,然后向沸水中滴加5~6滴FeCl3饱和溶液。继续煮沸至溶液呈红褐色后,停止加热,即制得Fe(OH)3胶体。
注意事项:
a.不能用自来水,因为自来水中有电解质会使胶体发生聚沉,应用蒸馏水;
b.FeCl3不能过量,过量的FeCl3也能使胶体发生聚沉;
c.不能过度加热;不能用玻璃棒搅拌
d.书写制备胶体的化学方程式时,生成的Fe(OH)3不加沉淀符号(↓)。
思考:能否向NaOH溶液滴加FeCl3溶液 ?
不能,得到的是Fe(OH)3沉淀而不是胶体。
滤纸上无滤渣,滤液颜色不变
滤纸上有滤渣,滤液澄清
结论:胶体的分散质粒子能通过滤纸孔隙,浊液的分散质粒子不能通过
将胶体和泥水分别进行过滤,观察现象
(P26科学探究)
过滤后的现象
Fe(OH)3胶体
泥水
半透膜
实验示意图
半透膜
实验示意图
半透膜
实验示意图
半透膜
形成一条光亮的通路
胶体粒子能使光波发生散射
无光路现象产生
溶液中粒子太小,对光的散射极微弱
用激光笔照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
光束照射时的现象 原因分析
Fe(OH)3胶体
CuSO4溶液
①丁达尔效应——特性
定义:光束通过胶体时看到一条光亮“通路”的现象。
应用:区分溶液与胶体
原因:胶体中分散质微粒对可见光(波长为400~700nm)散射而形成的
区分胶体与溶液的一种常用物理方法
为什么浊液及溶液没有丁达尔效应?
光射到粒子上可以发生两种情况,一是当粒子直径大于入射光波长很多倍时,发生光的反射;二是当粒子直径小于入射光的波长时,发生光的散射.浊液分散质粒子直径太大,对于入射光只有反射而不散射;溶液里溶质粒子太小,对于入射光散射很微弱,观察不到丁达尔效应.
注意:
①丁达尔效应可用来鉴别胶体和溶液;
②液溶胶和气溶胶能发生丁达尔效应;
③丁达尔效应能说明胶粒的大小范围;
④丁达尔现象是胶粒对光的散射作用而形成的。
光线透过树叶间密林
电影放映时的丁达尔效应
生活中的丁达尔现象
思考:
如果空气中没有气溶胶,我们的环境将会是什么样?
光照下无丁达尔效应
空间变得一团漆黑
人类难以生存
→
→
阅读 教材P28 “科学视野”,了解
①为什么溶液最稳定?
②什么是介稳性,胶体为什么有介稳性?
③什么是电泳,其本质是什么?
④如何让胶体聚沉?
性质小结
在金属、陶瓷、聚合物等材料中加入固态胶体粒子,不仅可以改进材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,也可以改进材料的光学性质,有色玻璃就是由某些胶态金属氧化物分散于玻璃中制成的。
血液本身就是由血细胞在血浆中形成的胶体分散系,与血液有关的疾病的一些治疗、诊断方法就利用了胶体的性质,如血液透析、血清纸上电泳等。
阅读教材P28-29内容
(6)胶体的应用
土壤里许多物质如粘土、腐殖质等常以胶体形式存在,所以土壤里发生的一些化学过程也与胶体有关。
在日常生活里,也会经常接触并应用到胶体知识,如食品中的牛奶、豆浆、粥等都与胶体有关。
胶体的用途:
(1)盐卤点豆腐; (2)肥皂的制取和分离; (3)明矾净水; (4)FeCl3溶液用于伤口止血。 (5)水泥硬化; (6)冶金厂大量烟尘用高压电除去。 (7)土壤胶体中离子吸附和交换过程,保肥作用。
【思维导图】
胶体的性质及其应用
贴近生活的胶体化学
胶体化学研究的对象是分散体系,我们最熟悉的胶体分散体系是牛奶,它是油脂的小珠分散在水中组成的乳状液。跟牛奶一样的胶体分散体系是很多的,例如冰激淋、雪花膏、豆腐等。
我们生活的环境中也存在着许多胶体分散体系。就拿我们最讨厌的烟尘来说,它们就是固体分散在气体(空气)中形成的分散体系。工厂产生的烟尘是造成大气污染的主要祸首之一。根据胶体化学原理(即电荷可以使胶体质点(烟尘)沉积下来的原理),可以利用静电除尘。
雾是液体(小水珠)分散在气体(空气)中形成的胶体分散体系,也可以用电荷把它破坏。利用飞机撒播带电的沙粒,首先将空气中的湿气凝结成雾,然后再将雾凝结为细雨,这曾经启发了人工降雨的实施。
你见过不会流动的酒精吗?你只要到商店里去买“固体酒精”,这个疑问便有了答案。在野外工作的人(如地质队员)携带液体燃料(酒精、煤油)是很不方便的,于是,化学家发明了固体酒精,专供野外使用。
煤是当前主要的燃料之一,可是,从煤矿将煤运到使用的地点,不像石油那样可以用管道输送方便。胶休化学家总想,有朝一日煤也能用管道运输,这种设想是把煤研成细粉,把它们分散在矿物油里,加入稳定剂便成了一种胶体分散体系,就可用管道运输。你能想出好办法吗?
第 * 页
三类分散系的比较
分散系 溶液 胶体 浊液
悬浊液 乳浊液
分散质粒子大小 <1 nm 1 nm~100 nm >100 nm >100 nm
分散质粒子结构 分子、离子 少量分子的集合体或大分子 大量分子聚集成的固体小颗粒 大量分子聚集成的液体小液滴
特点 均一透明 多数均一透明,较稳定 不均一、不透明,久置沉淀 不均一、不透明,久置分层
稳定性 稳定 介稳性 不稳定 不稳定
能否透过滤纸 能 能 不能 不能
能否透过半透膜 能 不能(分离) 不能 不能
实例 食盐水、蔗糖溶液 Fe(OH)3胶体、淀粉溶液 泥水、石灰乳 牛奶、油漆
练习2、把稀H2SO4溶液逐滴加入到氢氧化铁胶体中。
现象?
原因?
先沉淀后溶解
氢氧化铁胶体遇稀硫酸(电解质)先聚沉,
后氢氧化铁沉淀又溶于稀硫酸。
练习3、根据中央电视台报道,近年来我国一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A.溶液 B.悬浊液
C.乳浊液 D.胶体
练习4、下列物质能发生丁达尔效应的是 ( )
A.蔗糖水 B.肥皂水
C.碘酒 D.碘化银固体
练习5、溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否为大量分子或离子的集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
B
B
D
第二章 化学物质及其变化
第一节 物质的分类
分散系及其分类
清晨,当鲜红的太阳从地平线升起时,你漫步在茂密的森林里,会看到缕缕霞光穿过树木的枝叶斑驳地铺洒在地面上;当你晚上走在城市的马路上,会看到汽车灯光产生的两条强烈的光柱(有雾的时候更明显);你还会看到当阳光透过墙上的小孔时,在较暗房间里会形成一道道光柱。这些美景的产生与胶体的重要性质——丁达尔效应密切相关。那么,什么是丁达尔效应?胶体还有哪些重要性质呢?
其实这是一类由特殊的物质群体产生的特殊现象。这类特殊的物质群体和大家熟悉的溶液都属于分散系,这就是这节我们要学习的主要内容。
分散系及其分类
1、分散系
(1)定义
分散系:把一种(或多种)物质分散在另一种(或多种)物质中所得到的混合物体系。
分散质:分散系中被分散的物质(少)。
分散剂:分散系中容纳分散质的物质(多)。
分散剂是:
氯化钠的水溶液
氯化钠
水
例:
氯化钠的水溶液
分散系是:
分散质是:
我们熟悉的溶液就是一种分散系,其中分散质称为溶质,分散剂称为溶剂。
生活中常见的分散系
氯化钠(固)
水(液)
液滴
空气
固体小颗粒
空气
CO2(气)
水(液)
固体颗粒
玻璃(固)
气、液、固
气体
举例 分散质 分散剂
食盐水
雾
烟
汽水
空气
有色玻璃
(2)分散系的分类
①按分散剂和分散质的状态分
9类
②按分散质粒子大小可分3类
胶体
<1nm
>100nm
1~100nm
分散系 分散质粒子大小
按分散质粒子直径的大小不同,分为以下三种:
结论:分散系的本质区别是分散质粒子大小不同
溶液
浊液
1nm
100nm
乳浊液
悬浊液
1纳米
1nm=10-9m
胶体
牛奶
泥水
练习1、溶液、胶体和浊液这三种分散系的根本区别是 ( )
A.是否为大量分子或离子的 集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
B
分散质粒子的大小是胶体区别于溶液、浊液的本质特征。
2、胶体
(1)胶体定义
胶体:分散质微粒的直径在1-100nm的分散系
本质特征
注:胶体不是一类物质,而是几乎任何物质都可能形成的一种分散状态。如:NaCl溶于水形成溶液,如果分散在酒精中则可形成胶体。
(2)胶体的分类
常见的胶体——固溶胶
Cu2O——红色
CuO——蓝绿色
Co2O3——蓝色
Ni2O3——墨绿色
MnO2——紫色
常见的胶体——气溶胶
常见的胶体——液溶胶
(3)胶体的制备
原理:使分散质粒子大小在1nm---100nm之间。
a.机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小,如墨汁、碳素墨水;
(1)物理方法
b.溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水等;
【科学探究】制备Fe(OH)3胶体(P26)
取一烧杯,加入25 mL蒸馏水,加热至沸腾,然后向沸水中滴加5~6滴FeCl3饱和溶液。继续煮沸至溶液呈红褐色后,停止加热,即制得Fe(OH)3胶体。
注意事项:
a.不能用自来水,因为自来水中有电解质会使胶体发生聚沉,应用蒸馏水;
b.FeCl3不能过量,过量的FeCl3也能使胶体发生聚沉;
c.不能过度加热;不能用玻璃棒搅拌
d.书写制备胶体的化学方程式时,生成的Fe(OH)3不加沉淀符号(↓)。
思考:能否向NaOH溶液滴加FeCl3溶液 ?
不能,得到的是Fe(OH)3沉淀而不是胶体。
滤纸上无滤渣,滤液颜色不变
滤纸上有滤渣,滤液澄清
结论:胶体的分散质粒子能通过滤纸孔隙,浊液的分散质粒子不能通过
将胶体和泥水分别进行过滤,观察现象
(P26科学探究)
过滤后的现象
Fe(OH)3胶体
泥水
半透膜
实验示意图
半透膜
实验示意图
半透膜
实验示意图
半透膜
形成一条光亮的通路
胶体粒子能使光波发生散射
无光路现象产生
溶液中粒子太小,对光的散射极微弱
用激光笔照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
光束照射时的现象 原因分析
Fe(OH)3胶体
CuSO4溶液
①丁达尔效应——特性
定义:光束通过胶体时看到一条光亮“通路”的现象。
应用:区分溶液与胶体
原因:胶体中分散质微粒对可见光(波长为400~700nm)散射而形成的
区分胶体与溶液的一种常用物理方法
为什么浊液及溶液没有丁达尔效应?
光射到粒子上可以发生两种情况,一是当粒子直径大于入射光波长很多倍时,发生光的反射;二是当粒子直径小于入射光的波长时,发生光的散射.浊液分散质粒子直径太大,对于入射光只有反射而不散射;溶液里溶质粒子太小,对于入射光散射很微弱,观察不到丁达尔效应.
注意:
①丁达尔效应可用来鉴别胶体和溶液;
②液溶胶和气溶胶能发生丁达尔效应;
③丁达尔效应能说明胶粒的大小范围;
④丁达尔现象是胶粒对光的散射作用而形成的。
光线透过树叶间密林
电影放映时的丁达尔效应
生活中的丁达尔现象
思考:
如果空气中没有气溶胶,我们的环境将会是什么样?
光照下无丁达尔效应
空间变得一团漆黑
人类难以生存
→
→
阅读 教材P28 “科学视野”,了解
①为什么溶液最稳定?
②什么是介稳性,胶体为什么有介稳性?
③什么是电泳,其本质是什么?
④如何让胶体聚沉?
性质小结
在金属、陶瓷、聚合物等材料中加入固态胶体粒子,不仅可以改进材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,也可以改进材料的光学性质,有色玻璃就是由某些胶态金属氧化物分散于玻璃中制成的。
血液本身就是由血细胞在血浆中形成的胶体分散系,与血液有关的疾病的一些治疗、诊断方法就利用了胶体的性质,如血液透析、血清纸上电泳等。
阅读教材P28-29内容
(6)胶体的应用
土壤里许多物质如粘土、腐殖质等常以胶体形式存在,所以土壤里发生的一些化学过程也与胶体有关。
在日常生活里,也会经常接触并应用到胶体知识,如食品中的牛奶、豆浆、粥等都与胶体有关。
胶体的用途:
(1)盐卤点豆腐; (2)肥皂的制取和分离; (3)明矾净水; (4)FeCl3溶液用于伤口止血。 (5)水泥硬化; (6)冶金厂大量烟尘用高压电除去。 (7)土壤胶体中离子吸附和交换过程,保肥作用。
【思维导图】
胶体的性质及其应用
贴近生活的胶体化学
胶体化学研究的对象是分散体系,我们最熟悉的胶体分散体系是牛奶,它是油脂的小珠分散在水中组成的乳状液。跟牛奶一样的胶体分散体系是很多的,例如冰激淋、雪花膏、豆腐等。
我们生活的环境中也存在着许多胶体分散体系。就拿我们最讨厌的烟尘来说,它们就是固体分散在气体(空气)中形成的分散体系。工厂产生的烟尘是造成大气污染的主要祸首之一。根据胶体化学原理(即电荷可以使胶体质点(烟尘)沉积下来的原理),可以利用静电除尘。
雾是液体(小水珠)分散在气体(空气)中形成的胶体分散体系,也可以用电荷把它破坏。利用飞机撒播带电的沙粒,首先将空气中的湿气凝结成雾,然后再将雾凝结为细雨,这曾经启发了人工降雨的实施。
你见过不会流动的酒精吗?你只要到商店里去买“固体酒精”,这个疑问便有了答案。在野外工作的人(如地质队员)携带液体燃料(酒精、煤油)是很不方便的,于是,化学家发明了固体酒精,专供野外使用。
煤是当前主要的燃料之一,可是,从煤矿将煤运到使用的地点,不像石油那样可以用管道输送方便。胶休化学家总想,有朝一日煤也能用管道运输,这种设想是把煤研成细粉,把它们分散在矿物油里,加入稳定剂便成了一种胶体分散体系,就可用管道运输。你能想出好办法吗?
第 * 页
三类分散系的比较
分散系 溶液 胶体 浊液
悬浊液 乳浊液
分散质粒子大小 <1 nm 1 nm~100 nm >100 nm >100 nm
分散质粒子结构 分子、离子 少量分子的集合体或大分子 大量分子聚集成的固体小颗粒 大量分子聚集成的液体小液滴
特点 均一透明 多数均一透明,较稳定 不均一、不透明,久置沉淀 不均一、不透明,久置分层
稳定性 稳定 介稳性 不稳定 不稳定
能否透过滤纸 能 能 不能 不能
能否透过半透膜 能 不能(分离) 不能 不能
实例 食盐水、蔗糖溶液 Fe(OH)3胶体、淀粉溶液 泥水、石灰乳 牛奶、油漆
练习2、把稀H2SO4溶液逐滴加入到氢氧化铁胶体中。
现象?
原因?
先沉淀后溶解
氢氧化铁胶体遇稀硫酸(电解质)先聚沉,
后氢氧化铁沉淀又溶于稀硫酸。
练习3、根据中央电视台报道,近年来我国一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
A.溶液 B.悬浊液
C.乳浊液 D.胶体
练习4、下列物质能发生丁达尔效应的是 ( )
A.蔗糖水 B.肥皂水
C.碘酒 D.碘化银固体
练习5、溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否为大量分子或离子的集合体
B.分散质微粒直径的大小
C.能否透过滤纸
D.是否均一、稳定、透明
B
B
D
