人教版高中化学必修一教学讲义,复习补习资料(含知识讲解,巩固练习):43【基础】《非金属及其化合物》全章复习与巩固-
文档属性
| 名称 | 人教版高中化学必修一教学讲义,复习补习资料(含知识讲解,巩固练习):43【基础】《非金属及其化合物》全章复习与巩固- |
|
|
| 格式 | zip | ||
| 文件大小 | 408.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-03 15:32:10 | ||
图片预览




文档简介
《非金属及其化合物》全章复习与巩固
【学习目标】
1.总结几种常见非金属(碳、硅、氯、硫、氮)及其化合物的主要性质,理解浓硫酸及硝酸的氧化性。 2. 掌握氯离子、铵根离子的检验方法。 3. 学会氨气、二氧化硫、二氧化碳的检验方法。
4. 掌握氯气、氨气的实验室制法。
【知识网络】
1、碳及其化合物的转化关系
/
2.硅及其化合物的转化关系
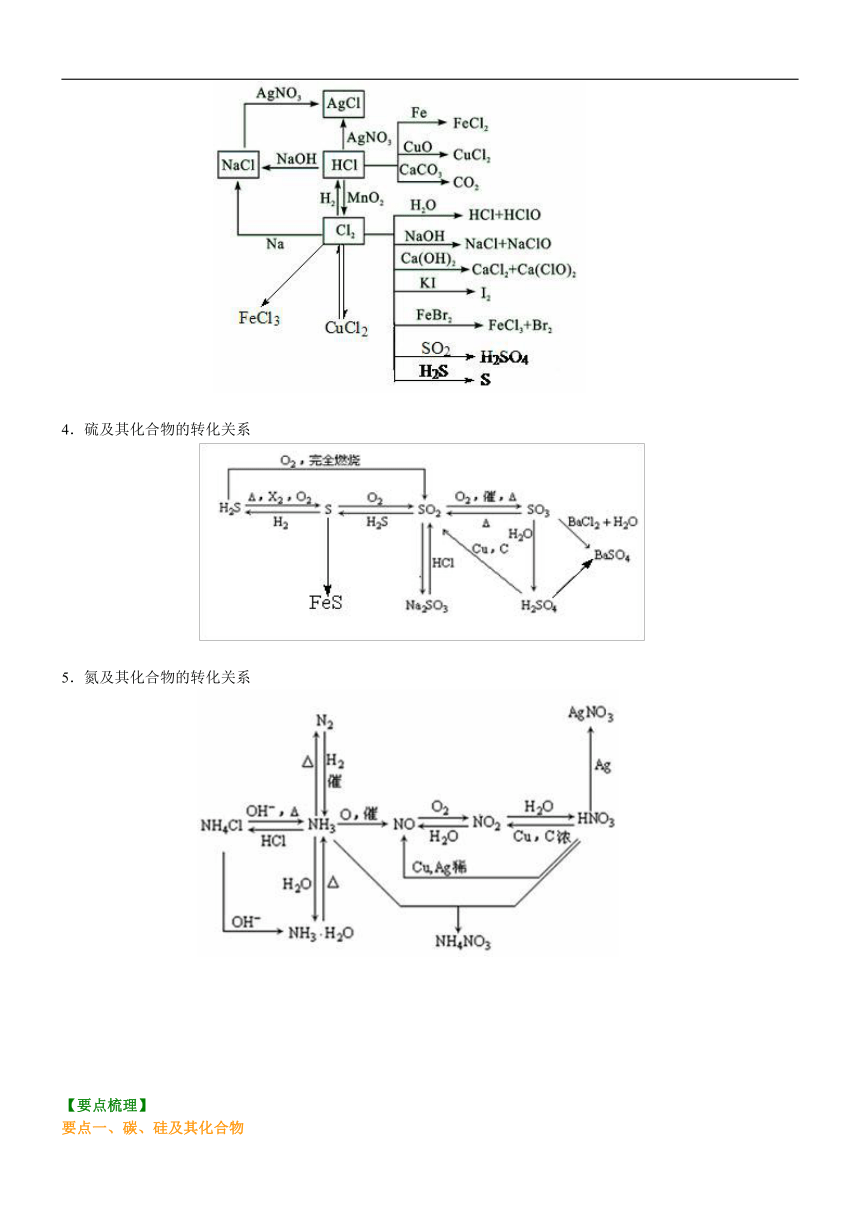
3.氯及其化合物的转化关系 / 4.硫及其化合物的转化关系 / 5.氮及其化合物的转化关系 /
【要点梳理】 要点一、碳、硅及其化合物 1.碳 碳在常温下非常稳定,但在高温条件下活动性增强,主要表现为还原性。 (1)与非金属单质反应 2C+O2/2CO C+O2/CO2 (2)与某些氧化物反应 C+CO2/2CO C+H2O(g)/CO+H2 2C+SiO2/Si+2CO↑ C+2CuO/2Cu+CO2↑ (3)与氧化性酸反应 C+2H2SO4(浓)/CO2↑+2SO2↑+2H2O C+4HNO3(浓)/CO2↑+4NO2↑+2H2O 2.碳的氧化物 (1)CO:主要表现还原性 2CO+O2/2CO2 3CO+Fe2O3/2Fe+3CO2 CO+H2O/CO2+H2 (2)CO2 ①弱氧化性:CO2+C/2CO ②酸性氧化物的三点通性 CO2+H2O/H2CO3 CO2+Ca(OH)2=CaCO3↓+H2O CO2+CaO/CaCO3
其它性质:
CO2+H2O+CaCO3=Ca(HCO3)2 2CO2+Ca(OH)2=Ca(HCO3)2 Na2SiO3?+CO2 +H2O ==H2SiO3↓+ Na2CO3 (CO2少量)
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 2Na2O2+2CO2=2Na2CO3+O2
3.碳酸盐 (1)溶解性 正盐中只有碱金属的碳酸盐和铵盐溶于水,所有酸式盐均溶于水。一般酸式盐比相应正盐易溶,但碱金属的碳酸氢盐比碳酸盐的溶解度小。 (2)热稳定性 一般规律:可溶性碳酸正盐>不溶性碳酸正盐>酸式碳酸盐。如: Na2CO3>CaCO3>NaHCO3 (3)正盐与酸式盐的相互转化 / 4.硅单质
地壳中含量最高的两种元素分别是氧和硅。硅是一种亲氧元素,在自然界中它总是与氧相互化合,硅主要以熔点很高的氧化物及硅酸盐的形式存在。硅原子结构和碳原子结构相似。硅元素是构成岩石与许多矿物的基本元素,碳元素是构成有机物的必要元素。 (1)硅的性质:还原性为主
Si+2Cl2/SiCl4(无色液体) Si+O2/SiO2 (2)硅的制取:工业上用碳在高温下还原二氧化硅可得粗硅:SiO2+2C/Si+2CO↑
(3)硅的用途 硅是一种重要的非金属单质,用途非常广泛,作为良好的半导体材料,硅可用来制造集成电路、晶体管、硅整流器、半导体器件。硅还可制成太阳能电池。 5.二氧化硅
(1)酸性氧化物的通性 SiO2+CaO/CaSiO3 SiO2+2NaOH==Na2SiO3+H2O
盛放碱性溶液的试剂瓶不能用玻璃塞
SiO2不溶于水,与水不反应 (2)氧化性 SiO2+2C/Si+2CO
(3) SiO2和HF反应:SiO2+4HF=SiF4↑+2H2O(特性) 玻璃中含有SiO2,可以用HF来刻蚀玻璃。盛放氢氟酸不能用玻璃瓶,可以用塑料瓶。
(4)SiO2用途
天然二氧化硅有结晶形和无定形两大类,统称硅石。它的硬度较大,熔点较高。以SiO2为主要成分的沙子是基本的建筑材料。纯净的SiO2是现代光学及光纤制品的基本原料(光导纤维的成分是二氧化硅)。石英、玛瑙(成分SiO2)用于制作饰物和工艺品。 6.硅酸
硅酸是一种溶解度很小的弱酸,酸性比碳酸弱,只能通过硅酸盐与酸反应制取。 Na2SiO3?+ 2HCl==H2SiO3(胶体)+2NaCl
要点二、氯及其化合物
氯原子很容易得到一个电子而形成氯离子(Cl-),表现为典型的氧化性。
1.氯气的化学性质 (1)与金属反应: Cl2+2Na/2NaCl 3Cl2+2Fe/2FeCl3 Cl2+Cu/CuCl2 (2)与非金属反应: Cl2+H2/2HCl
点燃的氢气在氯气瓶中继续燃烧,产生苍白色火焰,瓶口有大量的白雾(HCl气体和空气中的水形成盐酸酸雾)。 (3)与水反应 Cl2+H2O/ HCl+HClO
新制的氯水
久置的氯水
成分
分子:Cl2、H2O、HClO 离子:H+、Cl-、ClO-、OH-
分子:H2O 离子:H+、Cl-、OH-
颜色
黄绿色
无色
性质
酸性、漂白性
酸性且酸性增强、无漂白性
原因
新制的氯水中存在Cl2+H2O/HClO+H++Cl- 久置的氯水中HClO完全分解为O2而消耗,最后成为HCl溶液
(4)与碱反应: ①工业制漂白粉或漂粉精2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 漂白粉的主要成分为:CaCl2+Ca(ClO)2;有效成分为:Ca(ClO)2 漂白粉的使用:Ca(ClO)2+ 2HCl=CaCl2+2HClO Ca(ClO)2+ H2O+CO2=CaCO3↓+2HClO 通过此反应可比较得出酸性强弱:H2CO3>HClO ②氯气的尾气处理 Cl2+2NaOH=NaCl+NaClO+H2O (5)与某些盐溶液反应 Cl2+2KI=I2+2KCl Cl2+2Fe2+=2Fe3++2Cl— Cl2+ SO2+2H2O=2HCl+ H2SO4 2.氯气的实验室制备 MnO2+4HCl(浓)/MnCl2+Cl2↑+2H2O 3.次氯酸、漂白粉的性质 (1)HClO是一种弱酸,H2CO3>HClO Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO (2) HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,能使品红溶液褪色。 (3)HClO见光易分解:2HClO/2HCl+O2↑。? 4.氯离子的检验 在被检物质的溶液中,先滴入少量的稀硝酸,将其酸化,排除CO32-等离子的干扰,然后再滴入AgNO3溶液,如产生白色沉淀,则可判断该溶液中含有Cl-。 要点三、硫及其重要化合物的主要性质 1.S:
游离态的硫存在于火山口附近或地壳的岩层里。俗称硫磺,是一种黄色晶体,硫不溶于水,微溶于酒精,易溶于二硫化碳。 (1) 氧化性: ①和金属Fe+S/FeS(黑色) 2Cu+S/Cu2S(黑色) ②和非金属S+H2/H2S (2)还原性:S+O2/SO2 2.SO2
二氧化硫是无色、有刺激气味的有毒气体,密度比空气大,易溶于水。二氧化硫是形成酸雨的主要气体,排放到大气中有很大危害。
(1)酸性氧化物的通性 ①与H2O反应:SO2+H2O/H2SO3 ②与碱反应:SO2+2NaOH=Na2SO3+H2O SO2+Na2SO3+H2O= 2NaHSO3 SO2+Ca(OH)2=CaSO3↓+H2O SO2+CaSO3+H2O=Ca(HSO3)2 (CO2,SO2均可使澄清石灰水变浑浊) ③与碱性氧化物的作用 SO2+CaO =CaSO3 (2)氧化性和还原性 SO2中的S元素化合价为+4价,处于中间价态,表现出双重性,但以还原性为主。 例:SO2 +2H2S=3S↓+2H2O ——氧化性 SO2+I2+2H2O=H2SO4+2HI ——还原性 /
SO2可使酸性KMnO4溶液褪色 SO2可以被O2、Cl2、Br2、I2、KMnO4、HNO3、Fe3+等所氧化 (3)特性:漂白性 二氧化硫有漂白性,它能与某些有色物质化合生成不稳定的无色物质。这种物质容易分解而使有色物质恢复原来的颜色。因此,二氧化硫气体可使品红溶液褪色,加热后溶液又恢复原来的颜色。 小结所学的漂白剂及其漂白原理
漂白剂
漂白原理
活性炭
物理吸附
HClO、O3、H2O2
强氧化作用
SO2
结合生成不稳定的无色物质,加热又复色
3.浓硫酸
硫酸是一种强酸,其稀溶液具有酸的通性。但浓硫酸还具有三大特性: (1)吸水性:可做气体干燥剂。 (2)脱水性:按水的组成比脱去有机物中的氢、氧元素,生成水。浓硫酸对皮肤有强腐蚀性。 (3)强氧化性 2H2SO4(浓)+ C/CO2↑ + 2H2O + 2SO2↑ 2H2SO4(浓) + Cu /CuSO4 + 2H2O +SO2↑ 常温时, Fe、Al与浓硫酸作用,使金属表面生成致密氧化膜(钝化)。 要点四、氮及其重要化合物的主要性质 1.氮气 氮气占空气体积的78%左右,氮的化学性质稳定,不活泼,但在一定条件下可以和氧气、氢气发生反应: N2+O2?/2NO / 2.NO和NO2
NO
NO2
物 理性质
色态味
无色、无味、气体
红棕色、刺激性气味、气体
密度
略大于空气
大于空气
熔沸点
低
低
溶解性
不溶于水
易溶于水并反应
毒性
有毒
有毒
化学性质
与水
不反应
3NO2+H2O=2HNO3+NO NO2既是氧化剂,又是还原剂
与碱
不反应
2NO2+2NaOH=NaNO3+NaNO2+H2O
与氧气
2NO+O2=2NO2
不反应
实验室制法
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3.氨气(NH3) (1)与酸反应 NH3+HCl=NH4Cl(白烟) NH3+HNO3=NH4NO3( 白烟) 2NH3+H2SO4=(NH4)2SO4 (2)与水反应:
氨气是无色有刺激气味的气体,极易溶于水并发生反应,常温下,1体积水大约可溶解700体积氨气。实验室可以用氨气做喷泉实验。氨的水溶液是氨水,
NH3+H2O/NH3 ·H2O/NH4++OH- (NH3·H2O是弱碱) 所以,氨水中的微粒共有六种:
分子:NH3·H2O、H2O、NH3; 离子:NH4+ 、OH-、H+ (3)还原性
在催化剂作用下氨气可以被氧化成一氧化氮:
/
因此,氨经一系列反应可以得到硝酸: NH3/NO/NO2/HNO3 此外,氨还可与Cl2反应: 8NH3+3Cl2=2N2+6NH4Cl(氨过量) (4)氨气的实验室制法 ①原理: 2NH4Cl+Ca(OH)2/CaCl2+2NH3↑+2H2O ②装置:固-固反应加热装置(同制O2) ③干燥:碱石灰(或固体NaOH、固体CaO) (不能用浓H2SO4、CaCl2干燥,因CaCl2与NH3反应:CaCl2+8NH3= CaCl2·8 NH3) ④收集:向下排空气法收集 ⑤验满:用湿润的红色石蕊试纸(变蓝)或蘸有浓HCl的玻璃棒接近瓶口(产生白烟)。 ⑥尾气吸收:水(防止倒吸) 4.铵盐
(1)铵盐都是离子化合物,都易溶于水 (2)铵盐的化学性质 ①不稳定性,受热易分解
NH4Cl?/NH3?↑+ HCl↑(用于除去或分离铵盐) NH4HCO3?/NH3?↑+ H2O + CO2↑ ②与碱反应NH4++OH-/NH3↑+H2O(用于NH4+的检验) ③NH3与NH4+的相互转化 / 5.硝酸 (1)酸的通性:(石蕊、金属、碱、碱性化合物、某些盐) (2)氧化性: ①与金属单质的反应: a.活泼金属 b.Al、Fe钝化 常温浓硝酸可使铝、铁钝化,但加热能使它们发生剧烈的化学反应。 Al+6HNO3(浓)/Al(NO3)3+3NO2↑+3H2O c.不活泼金属 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O ②与非金属单质的反应: C+4HNO3(浓)/CO2+4NO2↑+2H2O ③与还原性物质的反应:如可使下列变化发生 Fe2+→Fe3+ ;SO32-→SO42- ; I-→I2 (3)不稳定性:
/ (浓硝酸应保存在棕色瓶中,并置于阴凉处)
【典型例题解析】
类型一:氯及其化合物
例1、某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验[实验室制取氯气的反应为MnO2+4HCl(浓)/MnCl2+Cl2+2H2O]。
/
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是________,反应的离子方程式为________。
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是________(填名称)。
(3)Cl2与石灰乳反应制取漂白粉的化学方程式为________。
(4)该兴趣小组用8.7 g MnO2与足量的浓盐酸反应制备氯气,则理论上最多可制得标准状况下的Cl2的体积为________。
【思路点拨】淀粉遇碘单质变蓝。
【答案】(1)溶液变蓝 Cl2+2I-==2Cl-+I2 (2)浓硫酸
(3)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (4)2.24
【解析】发生装置中产生的是氯气(混有氯化氢气体、水蒸气),气体通过饱和食盐水,除去了氯化氢,得到较纯净的氯气。(1)将Cl2通入淀粉碘化钾溶液,发生反应:Cl2+2I-==2Cl-+I2,I2能使淀粉变蓝(I2的特性)。(2)干燥的有色布条不褪色,湿润的有色布条褪色,说明氯气是经过干燥的,不含有水分,能吸水的液体是浓硫酸。(3)Cl2与石灰乳的反应为2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O。(4)根据反应关系式MnO2~Cl2,,因此产生的Cl2也是0.1 mol,标准状况下的体积为2.24 L。
【总结升华】氯气还可以和金属反应,和铁反应时直接将铁氧化到+3价。
举一反三:
【变式1】(2019 黑龙江大庆期末考)已知:①向MnO2固体中加入浓盐酸,加热后充分反应,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③向KMnO4晶体滴加浓盐酸,产生黄绿色气体。下列判断正确的是( )。
A.实验②证明Fe2+既有氧化性又有还原性
B.实验③生成的气体不能使湿润的淀粉KI试纸变蓝
C.上述实验中,有二三个氧化还原反应
D.上述实验证明氧化性:MnO2>MnO4->Cl2>Fe3+
【答案】C
【解析】实验②证明Fe2+具有还原性,A错误。实验③生成Cl2,Cl2的氧化性强于I2,能使湿润的淀粉KI试纸变蓝,B错误。三个实验的反应中都存在化合价的变化,均是氧化还原反应,C正确。常温下高锰酸钾能将浓盐酸氧化为氯气,加热时MnO2能将浓盐酸氧化为氯气,则氧化性:MnO4->MnO2;实验①中MnO2为氧化剂,氯气是氧化产物,所以氧化性MnO2>Cl2;氯气能将亚铁离子氧化为三价铁离子,氯气为氧化剂,所以氧化性Cl2>Fe3+,则氧化性MnO4->MnO2>Cl2>Fe3+,D错误。
类型二:硫及其化合物
例2、某学生课外活动小组利用下图所示装置,分别做如下实验:(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 _____________ 溶液;加热时溶液由红色逐渐变浅的原因是: _______________________________________。 (2)在试管中注入某无色溶液,加热试管,溶液变为红色。冷却后恢复无色,则此溶液可能是_______溶液。加热时溶液由无色变为红色的原因是:______________________ 。 【思路点拨】注意颜色的变化,以此作为突破口进行推测。
【答案】(1)稀氨水和酚酞;稀氨水中的NH3逸出,所以溶液的颜色变浅。 (2)溶有SO2的品红;SO2气体逸出,品红溶液恢复红色。 【解析】(1)认真观察实验装置的特点:试管口上套有气球,说明加热时会有气体逸出,一下就使“红色溶液”的范围缩小:溶有酸性气体的石蕊溶液或溶有碱性气体的酚酞溶液。而前者加热后,红色变为紫色,不符合“溶液颜色逐渐变浅”的条件,结论只有稀氨水和酚酞。 (2)由无色溶液/气体+溶液变红/气体+溶液无色。联想无色溶液虽多,但加热后放出气体且溶液变红不多,又冷却后该气体可使红色溶液褪色——显然该气体有漂白作用,并是一可逆过程,符合条件的无色溶液只能是SO2漂白过的品红溶液。 【总结升华】颜色的变化是此题的突破口,在中学教材中还有许多物质有特殊的颜色,这些特征颜色往往是解题的关键,要注意积累归纳。
举一反三: 【变式1】能鉴别CO2和SO2的试剂是( )。 A.品红溶液 B.澄清石灰水 C.紫色石蕊试液 D.氯化钡溶液和氯水混合液 【答案】AD
【解析】CO2与SO2溶于水可得碳酸和亚硫酸,均可电离出氢离子,均可使紫色石蕊试剂变红。它们与澄清石灰水均可生成白色沉淀,且过量后均可溶解。CO2与SO2在还原性方面不同。SO2具有还原性可以被氯单质氧化而在水溶液中生成硫酸根离子,可与氯化钡生成硫酸钡白色沉淀,而CO2不能。SO2有漂白性,CO2没有。
【变式2】三位同学设计了下述三个方案,并都认为:如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-。 / 试评价上述方案是否严密,并分别说明理由。 方案甲:_________; 方案乙:_________; 方案丙:_________。 【答案】甲:不合理,因试液中如含有Ag+,而不含SO42-的无色溶液同样产生白色沉淀。 乙:合理,加稀HCl排除CO32-、SO32-的干扰,同时无白色沉淀说明原无色溶液中无Ag+,再加入BaCl2产生白色沉淀说明原溶液肯定有SO42-。 丙:不合理,如含有SO32-不含SO42-,强氧化性的酸HNO3会把SO32-氧化成SO42-,从而和Ba(NO3)2反应生成BaSO4白色沉淀。
【解析】对检验SO42-干扰的离子有Ag+、CO32-、SO32-来进行分析。检验SO42-的方法是:先用HCl(HNO3)酸化再用钡盐滴定。如果有Ag+干扰可用HNO3酸化,如果有SO32-用稀HCl酸化,既有Ag+也有SO32-应用稀HCl酸化。 类型三:氮及其化合物
例3、如图表示,A、B、C、D、E五种含氮物质相互转化的关系图,其中A、B、C、D常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。 / (1)各物质的化学式为: A、__________,B、___________,C、__________,D、__________,E、___________。 (2)各步反应的化学方程式为: A→C:____________________________________ ; D→C:____________________________________ ; B→E:____________________________________ ; E→C:____________________________________ 。
【思路点拨】把B为红棕色气体作为突破口,根据框图中的反应条件进行推测。
【答案】(1)A:N2 B:NO2 C:NO D:NH3 E:HNO3 (2)A→C:N2+ O2/2NO D→C:4NH3+5O2/4NO+6H2O B→E:3NO2+H2O=2HNO3+NO
E→C: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
【解析】解题的突破口是B 为红棕色气体,则B为NO2,C与O2能生成气体B,故C为NO。E在常温下不是气体,故E为稀HNO3。由图转化关系进一步分析可知:A为N2、 D为NH3。 【总结升华】做推断题时要以特殊性质或现象作为突破口,特殊性质包括颜色、状态、气味等,在学习的过程中要加以积累、记忆。
举一反三: 【变式1】已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图示: / (1)D的化学式(分子式)是____________,E的化学式(分子式)是______________。 (2)A和B反应生成C的化学方程式是_______________________________________。 (3)E和F反应生成D、H和G的化学方程式是_________________________________。
【答案】(1)NH3 NH4Cl (2)H2+Cl2/2HCl (3)2NH4Cl+Ca(OH)2 /2NH3↑+2H2O+CaCl2
【解析】此题综合考查了元素化合物知识,是典型的框图推断题,要求对元素化合物知识要有全面的掌握,较难。在解答此题时要紧密结合物质的状态及已知物G进行假设。从题知:A、B、C、D为气态,E、F为固态,则H为液态;由最后生成D气体、H液体和固体CaCl2,再联想常见的生成液体为H2O,结合E、F为固体可猜测是实验室制NH3的反应,即D为NH3,则E、F分别为NH4Cl和Ca(OH)2;由于E是气态D(氨气)、C形成的,所以E为NH4Cl,C为HCl,F为Ca(OH)2;又由于C为HCl,所以A、B分别为H2和Cl2。验证假设的内容,发现符合框图,所以假设成立。
类型四:碳、硅及其化合物
例4、(2019 辽宁省实验中学期末考)在一定条件下,下列物质不能与二氧化硅反应的是( )。
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钠 ⑦水
A.③⑤⑦ B.⑤⑦ C.③⑤ D.⑤
【思路点拨】掌握SiO2与一些物质反应的条件及化学方程式,就可迅速解题。
【答案】B
【解析】①二氧化硅能被碳还原生成硅单质和一氧化碳,故①不选;
②二氧化硅能与碳酸钠反应生成硅酸钠和二氧化碳,故②不选;
③二氧化硅能与碳酸钙反应生成硅酸钙和二氧化碳,故③不选;
④二氧化硅能与氢氟酸反应生成四氟化硅气体,故④不选;
⑤二氧化不能与硝酸反应,故⑤选;
⑥二氧化硅能与氢氧化钠反应生成硅酸钠,故⑥不选;
⑦水与二氧化硅不反应,故⑦选。
【总结升华】二氧化硅的化学性质很稳定,常温下只与氢氟酸、强碱溶液反应,在加热条件下可体现二氧化硅酸性氧化物的通性。 作为酸性氧化物,SiO2可与强碱和碱性氧化物反应,在常温下SiO2可与氢氟酸反应,在加热时SiO2可被焦炭还原,可与碳酸钙、纯碱反应。
举一反三:
【变式1】不能用磨口玻璃塞的试剂瓶贮存的一组物质是( )。 A.溴水、氯水、碘水 B.氢溴酸、盐酸、氢硫酸 C.浓硝酸、浓硝酸、高氯酸 D.NaOH溶液、KOH溶液、Na2SiO3溶液 【答案】D 【变式2】向下列物质的浓溶液中缓慢地通入过量CO2气体,整个过程中无明显现象的是( )。 A.水玻璃 B.氯化钙
C.漂白粉 D.饱和碳酸钠 【答案】B
【解析】CO2溶于水生成碳酸,碳酸的酸性比盐酸弱,而比硅酸、次氯酸强。根据酸与盐反应的规律(弱酸不能制强酸),过量CO2通入硅酸钠溶液中有白色沉淀H2SiO3生成;CO2通入氯化钙溶液无明显现象; CO2通入次氯酸钙溶液过程中会生成碳酸钙白色沉淀,CO2过量最终沉淀会消失;过量CO2通入饱和碳酸钠溶液会生成碳酸氢钠,碳酸氢钠溶解度比碳酸钠溶解度小而结晶析出。
类型五:气体的实验室制法
例5、实验室用二氧化锰和浓盐酸加热来制取氯气,反应的化学方程式为________________,其中二氧化锰的作用是____________。按上述方法制得的氯气中,可能含有的杂质气体有________、________。若需制得纯净、干燥的氯气,应将由发生装置导出的气体依次通过分别盛有________、________的洗气瓶。为防止氯气污染空气,多余的氯气通常可用________吸收,这个反应的离子方程式为________________。 【思路点拨】本题考查氯气的实验室制法,在除杂过程中抓住每个杂质气体的特殊性质进行处理。
【答案】MnO2+4HCl (浓)/MnCl+Cl2+2H2O 氧化剂 HCl H2O(g) 饱和食盐水 浓硫酸 NaOH溶液 Cl2+2OH-==Cl-+ClO-+H2O 【解析】实验室制取氯气的反应为:MnO2+4HCl (浓)/MnCl2+Cl2↑+2H2O,由此分析从气体发生装置出来的氯气中有HCl和H2O(g)杂质,所以需用饱和食盐水洗去HCl,用浓硫酸干燥氯气;由氯气的密度和溶解性,可选择向上排空气法收集氯气;根据氯气的性质,可用湿润的KI淀粉试纸检验集气瓶是否充满,剩余的氯气可用NaOH溶液吸收。 【总结升华】要善于运用所学的实验知识和氯气的性质,通过分析整理出有关气体的实验室制法的七个方面的内容,使之成为理性记忆分析能力。 举一反三 【变式1】下图是某同学设计的实验室制备干燥的Cl2及吸收多余氯气的实验装置,根据图中的装置和有关试剂回答下列问题。 / (1)指出上述装置中的各处错误: ①_________________;②_________________;③_________________; ④_________________;⑤_________________ (2)在改正过来的装置中,下列物质的作用分别是: ①饱和食盐水_________________;②浓硫酸_________________; ③NaOH溶液_________________;④MnO2_________________; 【答案】(1)①不能用稀盐酸,应改用浓盐酸;②没有酒精灯;③盛有浓硫酸和饱和食盐水的位置颠倒;④缺少石棉网;⑤收集氯气的集气瓶的进气管和出气管接反 (2)①除去氯气中的HCl ②除去氯气中的H2O(g) ③吸收多余的氯气 ④作氧化剂
【解析】对气体的实验室制法,一般应从以下几个方面考虑分析:①反应原理 ②反应装置及仪器 ③除杂装置 ④干燥装置 ⑤气体收集方法及装置 ⑥验满方法 ⑦余气处理装置。 【变式2】实验室用下列两种方案制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。则所得氯气( )。 A.①多 B.②多 C.一样多 D.无法比较 【答案】B
【解析】问题①MnO2足量,反应后期浓盐酸变稀,稀盐酸与MnO2不反应,反应自动停止。
【巩固练习】
一、选择题(每题有1~2选项符合题意)
1.有关氯的叙述正确的是( )。 A.液氯和氯水是同一物质 B.氢气在氯气中燃烧时在集气瓶口有白烟 C.氯气与水的反应中氯是氧化剂,水是还原剂 D.用氯制漂白粉是为了得到易贮存的漂白剂 2.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )。 ①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液 A.①②③ B.①②③⑥ C.③⑥ D.③④⑥
3.下列对硫酸的叙述正确的是( )。 A.因浓硫酸具有强氧化性,故不可用它来干燥氢气 B.浓硫酸不活泼,可用铁铝容器存放 C.浓硫酸有强氧化性,稀硫酸不具有氧化性 D.浓硫酸与蔗糖混合的实验中,表现了脱水性与强氧化性 4.下列溶液可以盛放在玻璃试剂瓶中,但不能用磨口玻璃塞的是( )。 A.硅酸钠溶液 B.氢氟酸 C.NaOH溶液 D.浓盐酸 5.下列各物质与其用途对应不正确的是( )。 A.硅——变压器的铁芯 B.硅胶——干燥剂 C.石英——光导纤维 D.水玻璃——木材防火剂 6.检验溶液中的离子,实验步骤和结论均正确的是( )。 A.加入AgNO3溶液,有白色沉淀生成,证明一定含有Cl-离子。 B.加入HNO3酸化的Ba(NO3)2溶液有白色沉淀生成,证明一定含有SO42—离子。 C.加入HCl后产生气体,该气体能使品红溶液褪色,加热后又变成红色,证明一定含有SO32—离子。 D.加入BaCl2溶液,有白色沉淀,证明一定含有SO32—离子。 7.下列离子方程式中,错误的是( )。 A.氯气与烧碱溶液反应:Cl2+2OH-==Cl―+ClO―+H2O B.氯气与KOH溶液反应:Cl2+2OH―==Cl―+ClO―+H2O C.盐酸与AgNO3溶液反应:HCl+Ag+==H++AgCl↓ D.NaCl溶液与AgNO3溶液反应:Cl―+Ag+==AgCl↓
8.(2019 黑龙江牡丹江一中期末考)将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,则布条的颜色( )。
A.变白色 B.变无色 C.不变色 D.先褪色后又复原
9.下列现象说明SO2具有氧化性的是( ) 。 A、SO2通入品红溶液中使之褪色。 B、SO2通入酸性 KMnO4溶液中使之褪色。 C、SO2通入溴水中使之褪色。 D、SO2通入饱和 H2S 溶液中析出浅黄色沉淀。
10.(2019 江西临川期中)X、Y、Z、W有如图所示的转化关系,则X、W可能是( )。
①C、O2 ②HNO3、Fe ③S、O2 ④N2、O2
A.①②③ B.①② C.③④ D.②③④
11.我国农业因遭受酸雨而造成的损失每年高达15亿多元。为了有效控制酸雨,前不久国务院已批准了《酸雨控制区和二氧化硫浸染控制区划分方案》等法规。你认为减少酸雨产生的途径可采取的措施是( )。 ①少用煤作燃料;②把工厂烟囱造高;③使燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源。? A、①②③ B、②③④⑤ C、①③⑤ D、①③④⑤?
12.(2019 河北省衡水期中考)等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是(还原产物只有NO)( )。
A.FeO B.Fe C.Fe3O4 D.Cu
13.能将Na2SiO3、CaCO3、SiO2三种白色粉末鉴别开来的试剂是( )。 A.水 B.氢氟酸 C.稀盐酸 D.烧碱溶液 14.可用于鉴别浓硝酸和浓硫酸的试剂是( )。 A.铜片 B.氧化铜 C.铝条 D.酚酞试液
二、填空题 1.(2019 山东潍坊月考)喷泉是一种常见的现象,其产生的原因是存在压强差。
/
(1)实验开始之前,应先检验图Ⅰ装置的气密性是否良好,请用简单的语言来描述此过程:________。
(2)用图I装置进行喷泉实验,若图Ⅰ的烧瓶中充满标况下的HCl气体.请写出引发喷泉的操作________。反应后溶液充满整个烧瓶,则烧瓶内溶液的物质的量浓度为________。
(3)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是________。
A.Cu与稀硝酸 B.Cu与稀硫酸 C.CaCO3与浓硝酸 D.Fe与浓硝酸
(4)某学生积极思考喷泉原理的应用,设计了图Ⅲ所示的装置。
①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管,可能出现的现象为________。
②在①操作的基础上,打开活塞c,产生的现象是________。
(5)实验室中某同学想制备部分氨气,设计了下面的装置,并选用相关试剂,其中错误的是________。
/
2.在某NaOH溶液中加入几滴酚酞试液,溶液显红色,向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去。回答下列问题: (1)产生该现象的原因可能有两个: ①_______________________________;②_______________________________。 (2)请设计实验证明褪色的原因是①还是②。
【答案与解析】
1.D
【解析】液氯、氯水都是液体,但前者是纯氯,后者是氯与水的混合物。氯与水的反应是歧化反应, 水虽然是反应物,却未参加氧化还原。烟是分散在气体中的固体小颗粒,雾是分散在气体里的液体小珠滴,氢气与氯气反应生成极易溶于水的HCl再溶于水蒸气,形成盐酸小液滴,而出现白雾。
2.C
【解析】新制氯水、盐酸酸化的漂白粉溶液均含H+离子和HClO分子。
3.D
4.AC
5.A
6.C
【解析】(A)加AgNO3出现白色沉淀,不一定含有Cl-,也可能有SO42—、SO32—等。 (B)加入HNO3酸化的Ba(NO3)2,有白色沉淀生成此沉淀肯定为BaSO4。但不能证明原溶液中一定有SO42—离子,因为SO42—离子的来源可能是原溶液中有的,也可能是SO32-被硝酸氧化生成的。 (D)加入BaCl2出现白色沉淀,可能含有SO42—、SO32-、Ag+等。
7.C
【解析】本题考查离子方程式的正误判断。A、B中NaOH、KOH、NaCl、NaClO都是可溶的强电解质,都以离子形式表示,所以A、B都是正确的;C中盐酸中HCl完全电离,要以Cl―形式表示,C错误;D中AgNO3、NaCl、NaNO3都是可溶的强电解质,AgCl是难溶于水的沉淀,所以D正确。提示:离子方程式需要正确表达各物质的形态。 8.C
【解析】等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,发生反应生成硫酸和盐酸,反应为Cl2+SO2+2H2O= H2SO4+2HCl,生成物均不具有漂白性,则布条的颜色不变色,故选C。
9.D
【解析】A体现SO2的漂白性,B、C均体现SO2的还原性。
10.B
【解析】碳在少量的氧气中燃烧得一氧化碳,一氧化碳与氧气继续反应得二氧化碳,碳在过量氧气中燃烧得二氧化碳,故①正确;根据铁与硝酸反应时,铁少量得三价铁,铁过量得二价铁可知:X、W、Y、Z可以分别是硝酸、铁、硝酸铁、硝酸亚铁,故②正确:硫与氧气反应无法直接得到三氧化硫,故③错误;氮气与氧气反应无法直接得到二氧化氮,故④错误,选B。
11.C 12.B
【解析】假设物质的量质量为1 g。A项,FeO与硝酸发生氧化还原反应,生成NO,则失电子物质的量为 mol;B项,Fe与硝酸反应被氧化生成Fe3+,则失电子物质的量为;C项,Fe3O4中Fe元素的化合价有+2、+3价,与硝酸反应Fe2+被氧化生成Fe3+,则失电子物质的量为;D项,Cu与硝酸反应生成Cu2+,则失电子物质的量为;由以上分析可知,失电子最多的是Fe,则放出NO物质的量最多的是Fe,故选B。
13.C 14.A 二、填空题
1.【答案】
(1)将导管下端插入水中,用热毛巾捂住烧瓶,如果有气泡冒出,且移走热毛巾后在导管内形成一段稳定的水柱.则证明气密性良好。
(2)将胶头滴管中的水挤入烧瓶 或0.045 mol·L-1
(3)AC
(4)①盛有氨气的烧瓶内产生大量白烟 ②两烧瓶同时产生喷泉
(5)AC
【解析】(1)实验开始之前,应先检验图Ⅰ装置的气密性是否良好,方法是将导管下端插入水中,用热毛巾捂住烧瓶,如果有气泡冒出,且移走热毛巾后在导管内形成一段稳定的水梓.则证明气密性良好。
(2)用图Ⅰ装置进行喷泉实验,引发喷泉的操作是将胶头滴管小的水挤入烧瓶。设烧瓶的体积为P,则烧瓶内溶液的物质的量浓度为(V÷22.4 L·mol-1)/V=0.045 mol·L-1。
(4)①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管,可能出现的现象为盛有氨气的烧瓶内产生大量自烟。②在①操作的基础上,打开活塞c,产生的现象是两烧瓶同时产生喷泉。
(5)实验室制氨气选B、D;加热氯化铵得不到氨气;C项,试管口应稍微向下倾斜。
2.【答案】 (1)①氯水中HCl和HClO中和了NaOH ②氯水中HClO将酚酞氧化了 (2)向褪色后的溶液中滴加NaOH溶液,若溶液再次呈现红色,说明是原因①,不是原因②;若溶液不再呈现红色,说明是原因②,不是原因①。 【解析】使滴有酚酞试液的NaOH溶液的红色褪去,必然有两个原因:其一是NaOH没有了,使溶液不呈碱性了;其二是酚酞试液没有了。氯水中的物质,恰好具有这两方面的性质。 饱和氯水中存在HCl和HClO,由于它们都可中和NaOH,可能导致溶液红色褪去;也可能HClO具有强氧化性,将酚酞氧化变质而导致溶液红色褪去。前者加NaOH溶液后,溶液红色会再现,后者加NaOH溶液后,溶液红色不会再现。
【学习目标】
1.总结几种常见非金属(碳、硅、氯、硫、氮)及其化合物的主要性质,理解浓硫酸及硝酸的氧化性。 2. 掌握氯离子、铵根离子的检验方法。 3. 学会氨气、二氧化硫、二氧化碳的检验方法。
4. 掌握氯气、氨气的实验室制法。
【知识网络】
1、碳及其化合物的转化关系
/
2.硅及其化合物的转化关系
3.氯及其化合物的转化关系 / 4.硫及其化合物的转化关系 / 5.氮及其化合物的转化关系 /
【要点梳理】 要点一、碳、硅及其化合物 1.碳 碳在常温下非常稳定,但在高温条件下活动性增强,主要表现为还原性。 (1)与非金属单质反应 2C+O2/2CO C+O2/CO2 (2)与某些氧化物反应 C+CO2/2CO C+H2O(g)/CO+H2 2C+SiO2/Si+2CO↑ C+2CuO/2Cu+CO2↑ (3)与氧化性酸反应 C+2H2SO4(浓)/CO2↑+2SO2↑+2H2O C+4HNO3(浓)/CO2↑+4NO2↑+2H2O 2.碳的氧化物 (1)CO:主要表现还原性 2CO+O2/2CO2 3CO+Fe2O3/2Fe+3CO2 CO+H2O/CO2+H2 (2)CO2 ①弱氧化性:CO2+C/2CO ②酸性氧化物的三点通性 CO2+H2O/H2CO3 CO2+Ca(OH)2=CaCO3↓+H2O CO2+CaO/CaCO3
其它性质:
CO2+H2O+CaCO3=Ca(HCO3)2 2CO2+Ca(OH)2=Ca(HCO3)2 Na2SiO3?+CO2 +H2O ==H2SiO3↓+ Na2CO3 (CO2少量)
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 2Na2O2+2CO2=2Na2CO3+O2
3.碳酸盐 (1)溶解性 正盐中只有碱金属的碳酸盐和铵盐溶于水,所有酸式盐均溶于水。一般酸式盐比相应正盐易溶,但碱金属的碳酸氢盐比碳酸盐的溶解度小。 (2)热稳定性 一般规律:可溶性碳酸正盐>不溶性碳酸正盐>酸式碳酸盐。如: Na2CO3>CaCO3>NaHCO3 (3)正盐与酸式盐的相互转化 / 4.硅单质
地壳中含量最高的两种元素分别是氧和硅。硅是一种亲氧元素,在自然界中它总是与氧相互化合,硅主要以熔点很高的氧化物及硅酸盐的形式存在。硅原子结构和碳原子结构相似。硅元素是构成岩石与许多矿物的基本元素,碳元素是构成有机物的必要元素。 (1)硅的性质:还原性为主
Si+2Cl2/SiCl4(无色液体) Si+O2/SiO2 (2)硅的制取:工业上用碳在高温下还原二氧化硅可得粗硅:SiO2+2C/Si+2CO↑
(3)硅的用途 硅是一种重要的非金属单质,用途非常广泛,作为良好的半导体材料,硅可用来制造集成电路、晶体管、硅整流器、半导体器件。硅还可制成太阳能电池。 5.二氧化硅
(1)酸性氧化物的通性 SiO2+CaO/CaSiO3 SiO2+2NaOH==Na2SiO3+H2O
盛放碱性溶液的试剂瓶不能用玻璃塞
SiO2不溶于水,与水不反应 (2)氧化性 SiO2+2C/Si+2CO
(3) SiO2和HF反应:SiO2+4HF=SiF4↑+2H2O(特性) 玻璃中含有SiO2,可以用HF来刻蚀玻璃。盛放氢氟酸不能用玻璃瓶,可以用塑料瓶。
(4)SiO2用途
天然二氧化硅有结晶形和无定形两大类,统称硅石。它的硬度较大,熔点较高。以SiO2为主要成分的沙子是基本的建筑材料。纯净的SiO2是现代光学及光纤制品的基本原料(光导纤维的成分是二氧化硅)。石英、玛瑙(成分SiO2)用于制作饰物和工艺品。 6.硅酸
硅酸是一种溶解度很小的弱酸,酸性比碳酸弱,只能通过硅酸盐与酸反应制取。 Na2SiO3?+ 2HCl==H2SiO3(胶体)+2NaCl
要点二、氯及其化合物
氯原子很容易得到一个电子而形成氯离子(Cl-),表现为典型的氧化性。
1.氯气的化学性质 (1)与金属反应: Cl2+2Na/2NaCl 3Cl2+2Fe/2FeCl3 Cl2+Cu/CuCl2 (2)与非金属反应: Cl2+H2/2HCl
点燃的氢气在氯气瓶中继续燃烧,产生苍白色火焰,瓶口有大量的白雾(HCl气体和空气中的水形成盐酸酸雾)。 (3)与水反应 Cl2+H2O/ HCl+HClO
新制的氯水
久置的氯水
成分
分子:Cl2、H2O、HClO 离子:H+、Cl-、ClO-、OH-
分子:H2O 离子:H+、Cl-、OH-
颜色
黄绿色
无色
性质
酸性、漂白性
酸性且酸性增强、无漂白性
原因
新制的氯水中存在Cl2+H2O/HClO+H++Cl- 久置的氯水中HClO完全分解为O2而消耗,最后成为HCl溶液
(4)与碱反应: ①工业制漂白粉或漂粉精2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 漂白粉的主要成分为:CaCl2+Ca(ClO)2;有效成分为:Ca(ClO)2 漂白粉的使用:Ca(ClO)2+ 2HCl=CaCl2+2HClO Ca(ClO)2+ H2O+CO2=CaCO3↓+2HClO 通过此反应可比较得出酸性强弱:H2CO3>HClO ②氯气的尾气处理 Cl2+2NaOH=NaCl+NaClO+H2O (5)与某些盐溶液反应 Cl2+2KI=I2+2KCl Cl2+2Fe2+=2Fe3++2Cl— Cl2+ SO2+2H2O=2HCl+ H2SO4 2.氯气的实验室制备 MnO2+4HCl(浓)/MnCl2+Cl2↑+2H2O 3.次氯酸、漂白粉的性质 (1)HClO是一种弱酸,H2CO3>HClO Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO (2) HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,能使品红溶液褪色。 (3)HClO见光易分解:2HClO/2HCl+O2↑。? 4.氯离子的检验 在被检物质的溶液中,先滴入少量的稀硝酸,将其酸化,排除CO32-等离子的干扰,然后再滴入AgNO3溶液,如产生白色沉淀,则可判断该溶液中含有Cl-。 要点三、硫及其重要化合物的主要性质 1.S:
游离态的硫存在于火山口附近或地壳的岩层里。俗称硫磺,是一种黄色晶体,硫不溶于水,微溶于酒精,易溶于二硫化碳。 (1) 氧化性: ①和金属Fe+S/FeS(黑色) 2Cu+S/Cu2S(黑色) ②和非金属S+H2/H2S (2)还原性:S+O2/SO2 2.SO2
二氧化硫是无色、有刺激气味的有毒气体,密度比空气大,易溶于水。二氧化硫是形成酸雨的主要气体,排放到大气中有很大危害。
(1)酸性氧化物的通性 ①与H2O反应:SO2+H2O/H2SO3 ②与碱反应:SO2+2NaOH=Na2SO3+H2O SO2+Na2SO3+H2O= 2NaHSO3 SO2+Ca(OH)2=CaSO3↓+H2O SO2+CaSO3+H2O=Ca(HSO3)2 (CO2,SO2均可使澄清石灰水变浑浊) ③与碱性氧化物的作用 SO2+CaO =CaSO3 (2)氧化性和还原性 SO2中的S元素化合价为+4价,处于中间价态,表现出双重性,但以还原性为主。 例:SO2 +2H2S=3S↓+2H2O ——氧化性 SO2+I2+2H2O=H2SO4+2HI ——还原性 /
SO2可使酸性KMnO4溶液褪色 SO2可以被O2、Cl2、Br2、I2、KMnO4、HNO3、Fe3+等所氧化 (3)特性:漂白性 二氧化硫有漂白性,它能与某些有色物质化合生成不稳定的无色物质。这种物质容易分解而使有色物质恢复原来的颜色。因此,二氧化硫气体可使品红溶液褪色,加热后溶液又恢复原来的颜色。 小结所学的漂白剂及其漂白原理
漂白剂
漂白原理
活性炭
物理吸附
HClO、O3、H2O2
强氧化作用
SO2
结合生成不稳定的无色物质,加热又复色
3.浓硫酸
硫酸是一种强酸,其稀溶液具有酸的通性。但浓硫酸还具有三大特性: (1)吸水性:可做气体干燥剂。 (2)脱水性:按水的组成比脱去有机物中的氢、氧元素,生成水。浓硫酸对皮肤有强腐蚀性。 (3)强氧化性 2H2SO4(浓)+ C/CO2↑ + 2H2O + 2SO2↑ 2H2SO4(浓) + Cu /CuSO4 + 2H2O +SO2↑ 常温时, Fe、Al与浓硫酸作用,使金属表面生成致密氧化膜(钝化)。 要点四、氮及其重要化合物的主要性质 1.氮气 氮气占空气体积的78%左右,氮的化学性质稳定,不活泼,但在一定条件下可以和氧气、氢气发生反应: N2+O2?/2NO / 2.NO和NO2
NO
NO2
物 理性质
色态味
无色、无味、气体
红棕色、刺激性气味、气体
密度
略大于空气
大于空气
熔沸点
低
低
溶解性
不溶于水
易溶于水并反应
毒性
有毒
有毒
化学性质
与水
不反应
3NO2+H2O=2HNO3+NO NO2既是氧化剂,又是还原剂
与碱
不反应
2NO2+2NaOH=NaNO3+NaNO2+H2O
与氧气
2NO+O2=2NO2
不反应
实验室制法
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3.氨气(NH3) (1)与酸反应 NH3+HCl=NH4Cl(白烟) NH3+HNO3=NH4NO3( 白烟) 2NH3+H2SO4=(NH4)2SO4 (2)与水反应:
氨气是无色有刺激气味的气体,极易溶于水并发生反应,常温下,1体积水大约可溶解700体积氨气。实验室可以用氨气做喷泉实验。氨的水溶液是氨水,
NH3+H2O/NH3 ·H2O/NH4++OH- (NH3·H2O是弱碱) 所以,氨水中的微粒共有六种:
分子:NH3·H2O、H2O、NH3; 离子:NH4+ 、OH-、H+ (3)还原性
在催化剂作用下氨气可以被氧化成一氧化氮:
/
因此,氨经一系列反应可以得到硝酸: NH3/NO/NO2/HNO3 此外,氨还可与Cl2反应: 8NH3+3Cl2=2N2+6NH4Cl(氨过量) (4)氨气的实验室制法 ①原理: 2NH4Cl+Ca(OH)2/CaCl2+2NH3↑+2H2O ②装置:固-固反应加热装置(同制O2) ③干燥:碱石灰(或固体NaOH、固体CaO) (不能用浓H2SO4、CaCl2干燥,因CaCl2与NH3反应:CaCl2+8NH3= CaCl2·8 NH3) ④收集:向下排空气法收集 ⑤验满:用湿润的红色石蕊试纸(变蓝)或蘸有浓HCl的玻璃棒接近瓶口(产生白烟)。 ⑥尾气吸收:水(防止倒吸) 4.铵盐
(1)铵盐都是离子化合物,都易溶于水 (2)铵盐的化学性质 ①不稳定性,受热易分解
NH4Cl?/NH3?↑+ HCl↑(用于除去或分离铵盐) NH4HCO3?/NH3?↑+ H2O + CO2↑ ②与碱反应NH4++OH-/NH3↑+H2O(用于NH4+的检验) ③NH3与NH4+的相互转化 / 5.硝酸 (1)酸的通性:(石蕊、金属、碱、碱性化合物、某些盐) (2)氧化性: ①与金属单质的反应: a.活泼金属 b.Al、Fe钝化 常温浓硝酸可使铝、铁钝化,但加热能使它们发生剧烈的化学反应。 Al+6HNO3(浓)/Al(NO3)3+3NO2↑+3H2O c.不活泼金属 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O ②与非金属单质的反应: C+4HNO3(浓)/CO2+4NO2↑+2H2O ③与还原性物质的反应:如可使下列变化发生 Fe2+→Fe3+ ;SO32-→SO42- ; I-→I2 (3)不稳定性:
/ (浓硝酸应保存在棕色瓶中,并置于阴凉处)
【典型例题解析】
类型一:氯及其化合物
例1、某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验[实验室制取氯气的反应为MnO2+4HCl(浓)/MnCl2+Cl2+2H2O]。
/
请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是________,反应的离子方程式为________。
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是________(填名称)。
(3)Cl2与石灰乳反应制取漂白粉的化学方程式为________。
(4)该兴趣小组用8.7 g MnO2与足量的浓盐酸反应制备氯气,则理论上最多可制得标准状况下的Cl2的体积为________。
【思路点拨】淀粉遇碘单质变蓝。
【答案】(1)溶液变蓝 Cl2+2I-==2Cl-+I2 (2)浓硫酸
(3)2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (4)2.24
【解析】发生装置中产生的是氯气(混有氯化氢气体、水蒸气),气体通过饱和食盐水,除去了氯化氢,得到较纯净的氯气。(1)将Cl2通入淀粉碘化钾溶液,发生反应:Cl2+2I-==2Cl-+I2,I2能使淀粉变蓝(I2的特性)。(2)干燥的有色布条不褪色,湿润的有色布条褪色,说明氯气是经过干燥的,不含有水分,能吸水的液体是浓硫酸。(3)Cl2与石灰乳的反应为2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O。(4)根据反应关系式MnO2~Cl2,,因此产生的Cl2也是0.1 mol,标准状况下的体积为2.24 L。
【总结升华】氯气还可以和金属反应,和铁反应时直接将铁氧化到+3价。
举一反三:
【变式1】(2019 黑龙江大庆期末考)已知:①向MnO2固体中加入浓盐酸,加热后充分反应,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③向KMnO4晶体滴加浓盐酸,产生黄绿色气体。下列判断正确的是( )。
A.实验②证明Fe2+既有氧化性又有还原性
B.实验③生成的气体不能使湿润的淀粉KI试纸变蓝
C.上述实验中,有二三个氧化还原反应
D.上述实验证明氧化性:MnO2>MnO4->Cl2>Fe3+
【答案】C
【解析】实验②证明Fe2+具有还原性,A错误。实验③生成Cl2,Cl2的氧化性强于I2,能使湿润的淀粉KI试纸变蓝,B错误。三个实验的反应中都存在化合价的变化,均是氧化还原反应,C正确。常温下高锰酸钾能将浓盐酸氧化为氯气,加热时MnO2能将浓盐酸氧化为氯气,则氧化性:MnO4->MnO2;实验①中MnO2为氧化剂,氯气是氧化产物,所以氧化性MnO2>Cl2;氯气能将亚铁离子氧化为三价铁离子,氯气为氧化剂,所以氧化性Cl2>Fe3+,则氧化性MnO4->MnO2>Cl2>Fe3+,D错误。
类型二:硫及其化合物
例2、某学生课外活动小组利用下图所示装置,分别做如下实验:(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 _____________ 溶液;加热时溶液由红色逐渐变浅的原因是: _______________________________________。 (2)在试管中注入某无色溶液,加热试管,溶液变为红色。冷却后恢复无色,则此溶液可能是_______溶液。加热时溶液由无色变为红色的原因是:______________________ 。 【思路点拨】注意颜色的变化,以此作为突破口进行推测。
【答案】(1)稀氨水和酚酞;稀氨水中的NH3逸出,所以溶液的颜色变浅。 (2)溶有SO2的品红;SO2气体逸出,品红溶液恢复红色。 【解析】(1)认真观察实验装置的特点:试管口上套有气球,说明加热时会有气体逸出,一下就使“红色溶液”的范围缩小:溶有酸性气体的石蕊溶液或溶有碱性气体的酚酞溶液。而前者加热后,红色变为紫色,不符合“溶液颜色逐渐变浅”的条件,结论只有稀氨水和酚酞。 (2)由无色溶液/气体+溶液变红/气体+溶液无色。联想无色溶液虽多,但加热后放出气体且溶液变红不多,又冷却后该气体可使红色溶液褪色——显然该气体有漂白作用,并是一可逆过程,符合条件的无色溶液只能是SO2漂白过的品红溶液。 【总结升华】颜色的变化是此题的突破口,在中学教材中还有许多物质有特殊的颜色,这些特征颜色往往是解题的关键,要注意积累归纳。
举一反三: 【变式1】能鉴别CO2和SO2的试剂是( )。 A.品红溶液 B.澄清石灰水 C.紫色石蕊试液 D.氯化钡溶液和氯水混合液 【答案】AD
【解析】CO2与SO2溶于水可得碳酸和亚硫酸,均可电离出氢离子,均可使紫色石蕊试剂变红。它们与澄清石灰水均可生成白色沉淀,且过量后均可溶解。CO2与SO2在还原性方面不同。SO2具有还原性可以被氯单质氧化而在水溶液中生成硫酸根离子,可与氯化钡生成硫酸钡白色沉淀,而CO2不能。SO2有漂白性,CO2没有。
【变式2】三位同学设计了下述三个方案,并都认为:如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-。 / 试评价上述方案是否严密,并分别说明理由。 方案甲:_________; 方案乙:_________; 方案丙:_________。 【答案】甲:不合理,因试液中如含有Ag+,而不含SO42-的无色溶液同样产生白色沉淀。 乙:合理,加稀HCl排除CO32-、SO32-的干扰,同时无白色沉淀说明原无色溶液中无Ag+,再加入BaCl2产生白色沉淀说明原溶液肯定有SO42-。 丙:不合理,如含有SO32-不含SO42-,强氧化性的酸HNO3会把SO32-氧化成SO42-,从而和Ba(NO3)2反应生成BaSO4白色沉淀。
【解析】对检验SO42-干扰的离子有Ag+、CO32-、SO32-来进行分析。检验SO42-的方法是:先用HCl(HNO3)酸化再用钡盐滴定。如果有Ag+干扰可用HNO3酸化,如果有SO32-用稀HCl酸化,既有Ag+也有SO32-应用稀HCl酸化。 类型三:氮及其化合物
例3、如图表示,A、B、C、D、E五种含氮物质相互转化的关系图,其中A、B、C、D常温下都是气体,B为红棕色,写出A、B、C、D、E的化学式和各步反应的化学方程式。 / (1)各物质的化学式为: A、__________,B、___________,C、__________,D、__________,E、___________。 (2)各步反应的化学方程式为: A→C:____________________________________ ; D→C:____________________________________ ; B→E:____________________________________ ; E→C:____________________________________ 。
【思路点拨】把B为红棕色气体作为突破口,根据框图中的反应条件进行推测。
【答案】(1)A:N2 B:NO2 C:NO D:NH3 E:HNO3 (2)A→C:N2+ O2/2NO D→C:4NH3+5O2/4NO+6H2O B→E:3NO2+H2O=2HNO3+NO
E→C: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
【解析】解题的突破口是B 为红棕色气体,则B为NO2,C与O2能生成气体B,故C为NO。E在常温下不是气体,故E为稀HNO3。由图转化关系进一步分析可知:A为N2、 D为NH3。 【总结升华】做推断题时要以特殊性质或现象作为突破口,特殊性质包括颜色、状态、气味等,在学习的过程中要加以积累、记忆。
举一反三: 【变式1】已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图示: / (1)D的化学式(分子式)是____________,E的化学式(分子式)是______________。 (2)A和B反应生成C的化学方程式是_______________________________________。 (3)E和F反应生成D、H和G的化学方程式是_________________________________。
【答案】(1)NH3 NH4Cl (2)H2+Cl2/2HCl (3)2NH4Cl+Ca(OH)2 /2NH3↑+2H2O+CaCl2
【解析】此题综合考查了元素化合物知识,是典型的框图推断题,要求对元素化合物知识要有全面的掌握,较难。在解答此题时要紧密结合物质的状态及已知物G进行假设。从题知:A、B、C、D为气态,E、F为固态,则H为液态;由最后生成D气体、H液体和固体CaCl2,再联想常见的生成液体为H2O,结合E、F为固体可猜测是实验室制NH3的反应,即D为NH3,则E、F分别为NH4Cl和Ca(OH)2;由于E是气态D(氨气)、C形成的,所以E为NH4Cl,C为HCl,F为Ca(OH)2;又由于C为HCl,所以A、B分别为H2和Cl2。验证假设的内容,发现符合框图,所以假设成立。
类型四:碳、硅及其化合物
例4、(2019 辽宁省实验中学期末考)在一定条件下,下列物质不能与二氧化硅反应的是( )。
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钠 ⑦水
A.③⑤⑦ B.⑤⑦ C.③⑤ D.⑤
【思路点拨】掌握SiO2与一些物质反应的条件及化学方程式,就可迅速解题。
【答案】B
【解析】①二氧化硅能被碳还原生成硅单质和一氧化碳,故①不选;
②二氧化硅能与碳酸钠反应生成硅酸钠和二氧化碳,故②不选;
③二氧化硅能与碳酸钙反应生成硅酸钙和二氧化碳,故③不选;
④二氧化硅能与氢氟酸反应生成四氟化硅气体,故④不选;
⑤二氧化不能与硝酸反应,故⑤选;
⑥二氧化硅能与氢氧化钠反应生成硅酸钠,故⑥不选;
⑦水与二氧化硅不反应,故⑦选。
【总结升华】二氧化硅的化学性质很稳定,常温下只与氢氟酸、强碱溶液反应,在加热条件下可体现二氧化硅酸性氧化物的通性。 作为酸性氧化物,SiO2可与强碱和碱性氧化物反应,在常温下SiO2可与氢氟酸反应,在加热时SiO2可被焦炭还原,可与碳酸钙、纯碱反应。
举一反三:
【变式1】不能用磨口玻璃塞的试剂瓶贮存的一组物质是( )。 A.溴水、氯水、碘水 B.氢溴酸、盐酸、氢硫酸 C.浓硝酸、浓硝酸、高氯酸 D.NaOH溶液、KOH溶液、Na2SiO3溶液 【答案】D 【变式2】向下列物质的浓溶液中缓慢地通入过量CO2气体,整个过程中无明显现象的是( )。 A.水玻璃 B.氯化钙
C.漂白粉 D.饱和碳酸钠 【答案】B
【解析】CO2溶于水生成碳酸,碳酸的酸性比盐酸弱,而比硅酸、次氯酸强。根据酸与盐反应的规律(弱酸不能制强酸),过量CO2通入硅酸钠溶液中有白色沉淀H2SiO3生成;CO2通入氯化钙溶液无明显现象; CO2通入次氯酸钙溶液过程中会生成碳酸钙白色沉淀,CO2过量最终沉淀会消失;过量CO2通入饱和碳酸钠溶液会生成碳酸氢钠,碳酸氢钠溶解度比碳酸钠溶解度小而结晶析出。
类型五:气体的实验室制法
例5、实验室用二氧化锰和浓盐酸加热来制取氯气,反应的化学方程式为________________,其中二氧化锰的作用是____________。按上述方法制得的氯气中,可能含有的杂质气体有________、________。若需制得纯净、干燥的氯气,应将由发生装置导出的气体依次通过分别盛有________、________的洗气瓶。为防止氯气污染空气,多余的氯气通常可用________吸收,这个反应的离子方程式为________________。 【思路点拨】本题考查氯气的实验室制法,在除杂过程中抓住每个杂质气体的特殊性质进行处理。
【答案】MnO2+4HCl (浓)/MnCl+Cl2+2H2O 氧化剂 HCl H2O(g) 饱和食盐水 浓硫酸 NaOH溶液 Cl2+2OH-==Cl-+ClO-+H2O 【解析】实验室制取氯气的反应为:MnO2+4HCl (浓)/MnCl2+Cl2↑+2H2O,由此分析从气体发生装置出来的氯气中有HCl和H2O(g)杂质,所以需用饱和食盐水洗去HCl,用浓硫酸干燥氯气;由氯气的密度和溶解性,可选择向上排空气法收集氯气;根据氯气的性质,可用湿润的KI淀粉试纸检验集气瓶是否充满,剩余的氯气可用NaOH溶液吸收。 【总结升华】要善于运用所学的实验知识和氯气的性质,通过分析整理出有关气体的实验室制法的七个方面的内容,使之成为理性记忆分析能力。 举一反三 【变式1】下图是某同学设计的实验室制备干燥的Cl2及吸收多余氯气的实验装置,根据图中的装置和有关试剂回答下列问题。 / (1)指出上述装置中的各处错误: ①_________________;②_________________;③_________________; ④_________________;⑤_________________ (2)在改正过来的装置中,下列物质的作用分别是: ①饱和食盐水_________________;②浓硫酸_________________; ③NaOH溶液_________________;④MnO2_________________; 【答案】(1)①不能用稀盐酸,应改用浓盐酸;②没有酒精灯;③盛有浓硫酸和饱和食盐水的位置颠倒;④缺少石棉网;⑤收集氯气的集气瓶的进气管和出气管接反 (2)①除去氯气中的HCl ②除去氯气中的H2O(g) ③吸收多余的氯气 ④作氧化剂
【解析】对气体的实验室制法,一般应从以下几个方面考虑分析:①反应原理 ②反应装置及仪器 ③除杂装置 ④干燥装置 ⑤气体收集方法及装置 ⑥验满方法 ⑦余气处理装置。 【变式2】实验室用下列两种方案制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应。则所得氯气( )。 A.①多 B.②多 C.一样多 D.无法比较 【答案】B
【解析】问题①MnO2足量,反应后期浓盐酸变稀,稀盐酸与MnO2不反应,反应自动停止。
【巩固练习】
一、选择题(每题有1~2选项符合题意)
1.有关氯的叙述正确的是( )。 A.液氯和氯水是同一物质 B.氢气在氯气中燃烧时在集气瓶口有白烟 C.氯气与水的反应中氯是氧化剂,水是还原剂 D.用氯制漂白粉是为了得到易贮存的漂白剂 2.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )。 ①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液 A.①②③ B.①②③⑥ C.③⑥ D.③④⑥
3.下列对硫酸的叙述正确的是( )。 A.因浓硫酸具有强氧化性,故不可用它来干燥氢气 B.浓硫酸不活泼,可用铁铝容器存放 C.浓硫酸有强氧化性,稀硫酸不具有氧化性 D.浓硫酸与蔗糖混合的实验中,表现了脱水性与强氧化性 4.下列溶液可以盛放在玻璃试剂瓶中,但不能用磨口玻璃塞的是( )。 A.硅酸钠溶液 B.氢氟酸 C.NaOH溶液 D.浓盐酸 5.下列各物质与其用途对应不正确的是( )。 A.硅——变压器的铁芯 B.硅胶——干燥剂 C.石英——光导纤维 D.水玻璃——木材防火剂 6.检验溶液中的离子,实验步骤和结论均正确的是( )。 A.加入AgNO3溶液,有白色沉淀生成,证明一定含有Cl-离子。 B.加入HNO3酸化的Ba(NO3)2溶液有白色沉淀生成,证明一定含有SO42—离子。 C.加入HCl后产生气体,该气体能使品红溶液褪色,加热后又变成红色,证明一定含有SO32—离子。 D.加入BaCl2溶液,有白色沉淀,证明一定含有SO32—离子。 7.下列离子方程式中,错误的是( )。 A.氯气与烧碱溶液反应:Cl2+2OH-==Cl―+ClO―+H2O B.氯气与KOH溶液反应:Cl2+2OH―==Cl―+ClO―+H2O C.盐酸与AgNO3溶液反应:HCl+Ag+==H++AgCl↓ D.NaCl溶液与AgNO3溶液反应:Cl―+Ag+==AgCl↓
8.(2019 黑龙江牡丹江一中期末考)将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,则布条的颜色( )。
A.变白色 B.变无色 C.不变色 D.先褪色后又复原
9.下列现象说明SO2具有氧化性的是( ) 。 A、SO2通入品红溶液中使之褪色。 B、SO2通入酸性 KMnO4溶液中使之褪色。 C、SO2通入溴水中使之褪色。 D、SO2通入饱和 H2S 溶液中析出浅黄色沉淀。
10.(2019 江西临川期中)X、Y、Z、W有如图所示的转化关系,则X、W可能是( )。
①C、O2 ②HNO3、Fe ③S、O2 ④N2、O2
A.①②③ B.①② C.③④ D.②③④
11.我国农业因遭受酸雨而造成的损失每年高达15亿多元。为了有效控制酸雨,前不久国务院已批准了《酸雨控制区和二氧化硫浸染控制区划分方案》等法规。你认为减少酸雨产生的途径可采取的措施是( )。 ①少用煤作燃料;②把工厂烟囱造高;③使燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源。? A、①②③ B、②③④⑤ C、①③⑤ D、①③④⑤?
12.(2019 河北省衡水期中考)等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是(还原产物只有NO)( )。
A.FeO B.Fe C.Fe3O4 D.Cu
13.能将Na2SiO3、CaCO3、SiO2三种白色粉末鉴别开来的试剂是( )。 A.水 B.氢氟酸 C.稀盐酸 D.烧碱溶液 14.可用于鉴别浓硝酸和浓硫酸的试剂是( )。 A.铜片 B.氧化铜 C.铝条 D.酚酞试液
二、填空题 1.(2019 山东潍坊月考)喷泉是一种常见的现象,其产生的原因是存在压强差。
/
(1)实验开始之前,应先检验图Ⅰ装置的气密性是否良好,请用简单的语言来描述此过程:________。
(2)用图I装置进行喷泉实验,若图Ⅰ的烧瓶中充满标况下的HCl气体.请写出引发喷泉的操作________。反应后溶液充满整个烧瓶,则烧瓶内溶液的物质的量浓度为________。
(3)在图Ⅱ的锥形瓶中,分别加入足量的下列物质后,能产生喷泉的是________。
A.Cu与稀硝酸 B.Cu与稀硫酸 C.CaCO3与浓硝酸 D.Fe与浓硝酸
(4)某学生积极思考喷泉原理的应用,设计了图Ⅲ所示的装置。
①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管,可能出现的现象为________。
②在①操作的基础上,打开活塞c,产生的现象是________。
(5)实验室中某同学想制备部分氨气,设计了下面的装置,并选用相关试剂,其中错误的是________。
/
2.在某NaOH溶液中加入几滴酚酞试液,溶液显红色,向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去。回答下列问题: (1)产生该现象的原因可能有两个: ①_______________________________;②_______________________________。 (2)请设计实验证明褪色的原因是①还是②。
【答案与解析】
1.D
【解析】液氯、氯水都是液体,但前者是纯氯,后者是氯与水的混合物。氯与水的反应是歧化反应, 水虽然是反应物,却未参加氧化还原。烟是分散在气体中的固体小颗粒,雾是分散在气体里的液体小珠滴,氢气与氯气反应生成极易溶于水的HCl再溶于水蒸气,形成盐酸小液滴,而出现白雾。
2.C
【解析】新制氯水、盐酸酸化的漂白粉溶液均含H+离子和HClO分子。
3.D
4.AC
5.A
6.C
【解析】(A)加AgNO3出现白色沉淀,不一定含有Cl-,也可能有SO42—、SO32—等。 (B)加入HNO3酸化的Ba(NO3)2,有白色沉淀生成此沉淀肯定为BaSO4。但不能证明原溶液中一定有SO42—离子,因为SO42—离子的来源可能是原溶液中有的,也可能是SO32-被硝酸氧化生成的。 (D)加入BaCl2出现白色沉淀,可能含有SO42—、SO32-、Ag+等。
7.C
【解析】本题考查离子方程式的正误判断。A、B中NaOH、KOH、NaCl、NaClO都是可溶的强电解质,都以离子形式表示,所以A、B都是正确的;C中盐酸中HCl完全电离,要以Cl―形式表示,C错误;D中AgNO3、NaCl、NaNO3都是可溶的强电解质,AgCl是难溶于水的沉淀,所以D正确。提示:离子方程式需要正确表达各物质的形态。 8.C
【解析】等物质的量的SO2气体和Cl2同时作用于湿润的红色布条,发生反应生成硫酸和盐酸,反应为Cl2+SO2+2H2O= H2SO4+2HCl,生成物均不具有漂白性,则布条的颜色不变色,故选C。
9.D
【解析】A体现SO2的漂白性,B、C均体现SO2的还原性。
10.B
【解析】碳在少量的氧气中燃烧得一氧化碳,一氧化碳与氧气继续反应得二氧化碳,碳在过量氧气中燃烧得二氧化碳,故①正确;根据铁与硝酸反应时,铁少量得三价铁,铁过量得二价铁可知:X、W、Y、Z可以分别是硝酸、铁、硝酸铁、硝酸亚铁,故②正确:硫与氧气反应无法直接得到三氧化硫,故③错误;氮气与氧气反应无法直接得到二氧化氮,故④错误,选B。
11.C 12.B
【解析】假设物质的量质量为1 g。A项,FeO与硝酸发生氧化还原反应,生成NO,则失电子物质的量为 mol;B项,Fe与硝酸反应被氧化生成Fe3+,则失电子物质的量为;C项,Fe3O4中Fe元素的化合价有+2、+3价,与硝酸反应Fe2+被氧化生成Fe3+,则失电子物质的量为;D项,Cu与硝酸反应生成Cu2+,则失电子物质的量为;由以上分析可知,失电子最多的是Fe,则放出NO物质的量最多的是Fe,故选B。
13.C 14.A 二、填空题
1.【答案】
(1)将导管下端插入水中,用热毛巾捂住烧瓶,如果有气泡冒出,且移走热毛巾后在导管内形成一段稳定的水柱.则证明气密性良好。
(2)将胶头滴管中的水挤入烧瓶 或0.045 mol·L-1
(3)AC
(4)①盛有氨气的烧瓶内产生大量白烟 ②两烧瓶同时产生喷泉
(5)AC
【解析】(1)实验开始之前,应先检验图Ⅰ装置的气密性是否良好,方法是将导管下端插入水中,用热毛巾捂住烧瓶,如果有气泡冒出,且移走热毛巾后在导管内形成一段稳定的水梓.则证明气密性良好。
(2)用图Ⅰ装置进行喷泉实验,引发喷泉的操作是将胶头滴管小的水挤入烧瓶。设烧瓶的体积为P,则烧瓶内溶液的物质的量浓度为(V÷22.4 L·mol-1)/V=0.045 mol·L-1。
(4)①如果关闭活塞c,打开活塞a、b,再挤压胶头滴管,可能出现的现象为盛有氨气的烧瓶内产生大量自烟。②在①操作的基础上,打开活塞c,产生的现象是两烧瓶同时产生喷泉。
(5)实验室制氨气选B、D;加热氯化铵得不到氨气;C项,试管口应稍微向下倾斜。
2.【答案】 (1)①氯水中HCl和HClO中和了NaOH ②氯水中HClO将酚酞氧化了 (2)向褪色后的溶液中滴加NaOH溶液,若溶液再次呈现红色,说明是原因①,不是原因②;若溶液不再呈现红色,说明是原因②,不是原因①。 【解析】使滴有酚酞试液的NaOH溶液的红色褪去,必然有两个原因:其一是NaOH没有了,使溶液不呈碱性了;其二是酚酞试液没有了。氯水中的物质,恰好具有这两方面的性质。 饱和氯水中存在HCl和HClO,由于它们都可中和NaOH,可能导致溶液红色褪去;也可能HClO具有强氧化性,将酚酞氧化变质而导致溶液红色褪去。前者加NaOH溶液后,溶液红色会再现,后者加NaOH溶液后,溶液红色不会再现。
