人教版九上化学第二单元 我们周围的空气 单元复习 教案
文档属性
| 名称 | 人教版九上化学第二单元 我们周围的空气 单元复习 教案 |  | |
| 格式 | zip | ||
| 文件大小 | 167.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-04 08:25:27 | ||
图片预览

文档简介
课 题
主题三 (一)我们周围的空气
主备教师
课 时
第 1课时(总 1 课时)
课 型
复习课
上课教师
教
学
目
标
通过引导学生对本主题内容的分析、归纳、分类,进一步了解空气的主要成分、污染物和空气污染的危害及防治,熟练掌握氧气的物理性质、化学性质,理解并掌握氧气的实验室制法。
通过同学交流、讨论、展示知识网络,形成知识体系,加深对已学知识的理解,培养学生合作、表达能力。
通过课堂练习,进一步巩固所学知识,培养学生运用所学知识解决实际问题的能力。
重
点
知道氧气的主要性质(跟C、S、P、Fe、Al等物质发生氧化反应)和用途
实验探究氧气的性质、测定空气中氧气含量
难
点
正确书写有氧气参与和生成的反应的化学方程式,理解测定空气中氧气含量的实验原理
教
学
过
程
教学过程设计
对学生预习的本单元知识网络的整理进行评价,表扬好的同学以及好的形式,指出存在的不足,并请2-3位同学展示、表达自己的成果。教师根据学生总结情况,查漏补缺,对重点知识点进行强化,使学生形成能力。
考点1、空气
生物赖以生存的必需物质
重要性
重要自然资源
空气 成分: 氮气、氧气、稀有气体、二氧化碳、其他气体和杂质
污染物
污染及防治 污染的危害
防治措施
例题:将下列气体与其用途连线
灭火
氮气 霓虹灯
制汽水
氧气 保护气
助燃剂
二氧化碳 医疗急救
光合作用
稀有气体 供动植物呼吸
制造硝酸和氮肥
考点2、空气中氧气含量的测定
回忆测定空气中氧气含量的实验现象和结论
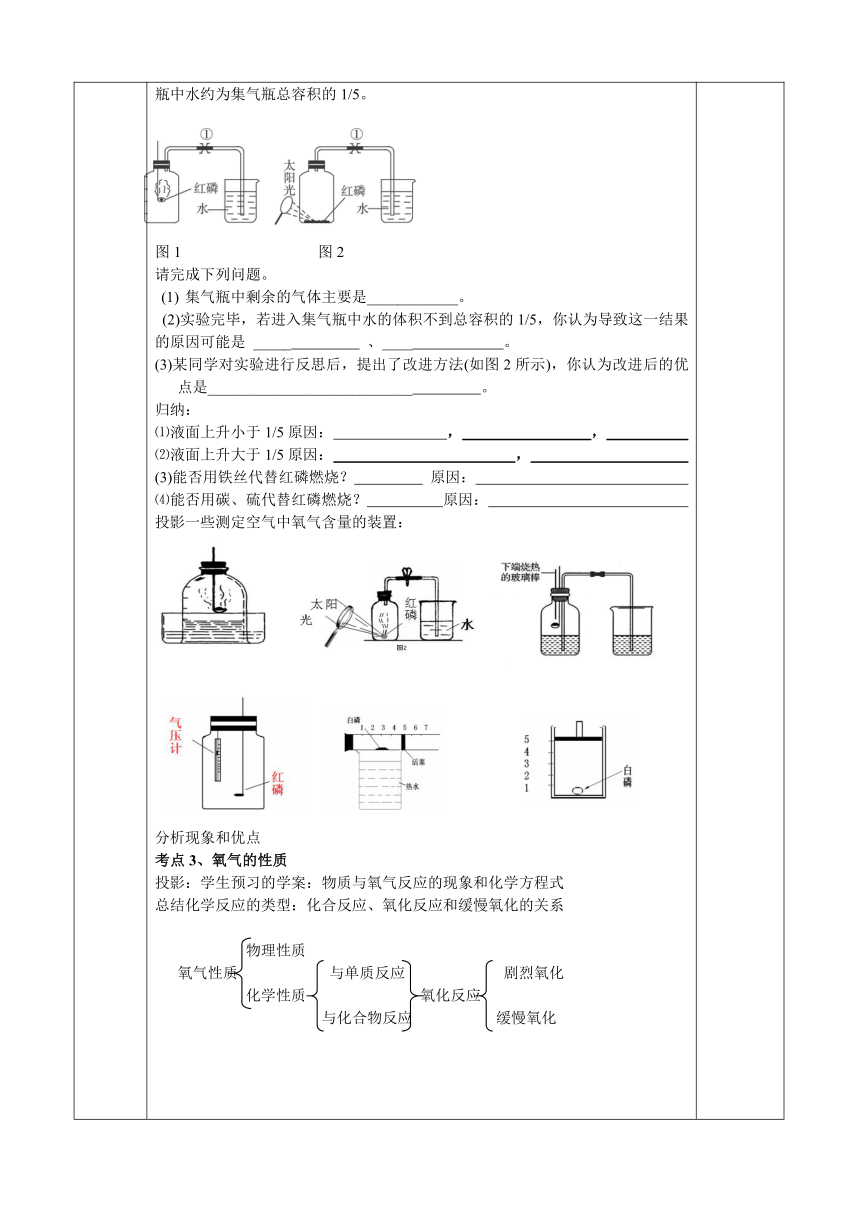
例题:用来测定空气成分的方法很多,图1所示的是用红磷在空气中燃烧的测定方法。实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中,并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水约为集气瓶总容积的1/5。
图1 图2
请完成下列问题。
集气瓶中剩余的气体主要是____________。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是 _____ 、____ 。
(3)某同学对实验进行反思后,提出了改进方法(如图2所示),你认为改进后的优点是___________________________ 。
归纳:
⑴液面上升小于1/5原因: , ,
⑵液面上升大于1/5原因: ,
(3)能否用铁丝代替红磷燃烧? 原因:
⑷能否用碳、硫代替红磷燃烧? 原因:
投影一些测定空气中氧气含量的装置:
分析现象和优点
考点3、氧气的性质
投影:学生预习的学案:物质与氧气反应的现象和化学方程式
总结化学反应的类型:化合反应、氧化反应和缓慢氧化的关系
物理性质
氧气性质 与单质反应 剧烈氧化
化学性质 氧化反应
与化合物反应 缓慢氧化
例题:
1、氧气是空气的主要成分之一,有关氧气说法错误的是 ( )
A.用带火星的木条可以检验氧气
B.用加热高锰酸钾的方法可以制取氧气
C.鱼类能在水中生活,证明氧气易溶于水
D.红磷在氧气中燃烧,产生大量白烟
2、属于缓慢氧化的变化是 ( )
A.木炭燃烧 B.食物腐败 C.蜡烛燃烧 D.汽油燃烧
考点4、生成氧气的化学反应
投影:学生写的的化学方程式
例题:
已知下面的转化图(部分反应条件省略)中涉及的A、B、C、D、E、F、G、H、I九种物质都是同学们所熟悉的。请你推断并回答:
(1)写出下列物质的名称:H ,I 。
(2)写出下列反应的化学方程式,并标注基本反应类型(化合反应或分解反应)
①A →E+ D: ,( 反应)
②F →D+G: ,
③B→F+ D: ,
④铁丝在气体D中燃烧: ,( 反应)
二次备课
练习
反馈
1、空气成分中,体积分数最大的是
A.氮气 B.二氧化碳 C.氧气 D.稀有气体
2、南京市即将正式发布PM2.5检测数据。PM2.5是指大气中直径小于或等于2.5微米的颗粒物,下列情况通常不可能引起大气中PM2.5增大的是
A.焚烧秸杆 B.汽车尾气 C.燃烧煤炭 D.光合作用
3、下列物质中属于纯净物的是
A.蒸馏水 B.矿泉水 C.自来水 D.天然水
4、下列物质能在空气中燃烧,且产生大量白烟的是
A.木炭 B.硫粉 C.红磷 D.铁丝
5、下列变化过程中,不包含缓慢氧化的是
A.动植物的呼吸 B.蔗糖的溶解 C.酒和醋的酿造 D.食物的腐烂
6、现有四种物质:①氧气、②氦气、③氩气、④氮气。请选择相应物质的序号填空:
(1)可用于填充气球、飞艇的是 ;
(2)可用于食品防腐的是 ;
(3)可用于医疗、航天的是 ;
(4)可用作保护气的是 。
7、右图是一个具有刻度和活塞可滑动的玻璃容器,其中有空气和足量白磷(白磷的着火点为40℃),将它放在盛有沸水的烧杯上方进行实验,请完成实验报告。
实验目的
实验现象
实验结论
测定空气中氧气的体积分数
白磷着火燃烧,冒出 ,
活塞先右移,后左移,最后停在刻度约为 (填整数)的位置上
空气的成分按体积计算氧气约占
8、化学课上,同学们做了人体呼出的气体使澄清石灰水变浑浊的实验后,对呼出的气体中主要成分及含量非常好奇,设计实验进行探究. 【提出问题】呼出的气体中有哪些主要成分,它们的含量是多少? 【查阅资料】①呼出的气体中仍含有O2. ②CO2在饱和NaHCO3溶液中的溶解度非常小. 【猜想与实验】 猜想:呼出的气体中主要成分是N2、O2、CO2、水蒸气等. 实验I:验证呼出的气体中含有水蒸气. (1)实验操作如图所示.
(2)观察到的现象为玻璃片表面有一层水雾,根据该现象可以判断呼出的气体中含有水蒸气. 实验II:验证呼出的气体中含有N2、O2、CO2,并测定其含量.同学们在老师的指导下设计了如下图所示装置(B是带刻度的量气装置).
(1)实验记录
实验操作
主要实验现象
实验结论及解释
①
检查装置的气密性.向装置中加入药品.关闭止水夹a~f.
装置的气密性良好.
②
打开b、c、d,向B中吹入一定量气体后关闭d,并冷却到室温.
B中液体进入到A中,B中液体减少500mL.
收集500mL气体.
③
关闭b,打开a、e、f,用打气筒向A中缓缓充气,直到B中气体刚好全部排出.
,D中液体为475mL.
反应的化学方程式为:
④
关闭e、f,用凸透镜聚光引燃白磷.
白磷燃烧,产生大量白烟,
放出大量热.
呼出的气体中含有O2.
⑤
待白磷熄灭并冷却到室温,打开f.
,D中剩余液体为400mL.
呼出的气体中含有N2.
(2)数据处理:呼出的气体中主要成分的含量
N2
O2
CO2
体积/mL
体积分数/%
同学们经过3次重复实验,确认了呼出气体中的主要成分及其含量. 【实验反思】(1)该实验设计依据的N2性质有 (填字母序号)A.难溶于水B.不能和NaOH溶液反应 C.无色无味的气体 D.不能燃烧,也不支持燃烧 (2)实验II操作⑤中,若C中气体未完全冷却就打开f并读数,则所测O2的体积分数 (填“偏小”、“不变”或“偏大”).
作业
布置
教后记
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
