人教版九上化学 第三单元 物质构成的奥秘 单元复习 教案
文档属性
| 名称 | 人教版九上化学 第三单元 物质构成的奥秘 单元复习 教案 |

|
|
| 格式 | zip | ||
| 文件大小 | 73.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-04 00:00:00 | ||
图片预览



文档简介
第三单元 “物质构成的奥秘”复习课
一、教材分析(复习课定位)
本节课教学内容是第三单元的知识复习。第三单元包括三个课题,分别是“分子和原子”“原子的结构”和“元素”。这些课题所涉及的内容在初中化学课程中占有重要的基础地位。这些生长性强的基本概念是支撑和构建初中化学知识的重要节点。正确理解这些基本概念,熟练运用有关化学术语和用语,是学习元素化合物、化学实验和化学基本计算等其他知识板块的重要基础和工具。
本单元包括分子、原子、离子、元素等基本概念,内容比较抽象,与学生的生活经验距离较远,学生不容易理解。各个知识点之间存在大量联系,可以举一反三,但学生刚接触无法融会贯通,也无法清晰地整理好各个概念之间的联系,这是学生觉得第三单元难的其中一个原因。
学情分析
1、化学和物理基本同一时间讲分子原子,在此之前学生极少微观感性认识,通过第三单元新课学习,学生只是初步建立微粒观。
2、本单元包括分子、原子、离子、元素等基本概念,内容比较抽象,与学生的生活经验距离较远,学生不容易理解。在不容易理解的基础上,大量陌生的名词如“相对原子质量”“相对稳定结构”“核电荷数”等让学生容易混淆。学生普遍存在听课能听懂,做题错得多的情况。这种情况的发生是由于习题的提问形式偏注重理解,学生学习化学时间不长,累积的知识和感性经验有限,不容易通过大量例子多角度地理解概念,导致概念理解不透彻。
3、本单元重点较多但零散,学生做题时遇到的困难无法直接在课本上找到知识的附着点,学生对概念之间是如何联系和发展的联系很模糊。
4、本单元的教学内容从第一、二单元的实验操作和元素化合物知识跳入抽象概念的学习,与前两个单元的识记类内容形成强烈反差,学生容易产生惧难情绪。
教学目标
回顾、进一步理解有关分子、原子、离子、元素等概念。
通过具体物质(元素),及其变化为例构建本章知识网络。
进一步强化“化学变化过程中分子、离子的变化,而原子、元素种类不变”的观念
4、进一步建立起微粒观,并能运用微粒观解释有关问题
四、教学重难点
(一)重点:1、分子、原子、元素、离子等基本概念复习;
2、理解物质与它们之间的关系,形成完整的知识网络
3、进一步建立起微粒观,并能运用微粒观解释某些常见现象。
(二)难点:用微观离子的运动解释宏观物质的性质与变化
五、教学设计
每一环节包括三个部分:
构建知识网络;
把教材中重要的知识点和观点以“思考与交流”的方式呈现;
六、教学过程
【引入】
物质由看不见的微小粒子构成,这本来只是科学家的一个大胆猜测,随着科技进步,我们通过先进的科学仪器观察到这些微粒的存在
【提出问题】那么构成物质的微粒有哪些?
【个别回答】有三种微粒,分别是分子、原子、离子。
【板书】一、分子、原子、离子
【提出问题】由分子、原子、离子构成的物质分别有哪些? 请各举2例
【个别回答】由离子构成的物质有氯化钠和硫酸铜;由原子构成的物质有金刚石、铁和汞等;由分子构成的物质有氧气、氢气、氨气等。
【归纳】感谢同学分享了他的答案。其实以铁、汞为代表的金属,都由原子构成。如常见的金属铜,由铜原子构成,金属铝由铝原子构成,还有如课本P.60所示的金刚石由原子构成;而常见的气体,一般由分子构成,如空气的主要成分氮气、氧气和二氧化碳,分别由氮气分子,氧气分子和二氧化碳分子构成;由离子构成的物质课本介绍了氯化钠和硫酸铜
【过渡】物质由分子、原子、离子构成,那么什么是分子、原子、离子呢?
他们之间怎样转化?
【学生活动】1、下列关于分子、原子、离子的说法中,正确的是(B)
A.原子是最小粒子。
B.分子是由原子构成的。
C.由分子构成的物质,分子是保持其性质的最小粒子。
D.带电的原子叫离子,离子可以分为正离子和负离子。
2、分子、原子、离子怎样转化。
分子 原子 离子
【个别回答】A更改为“原子是化学反应中的最小粒子”。
C更改为“由分子构成的物质,分子是保持其化学性质的最小粒子”。
D更改为“带电的原子叫离子,离子分为阳离子和阴离子”。
【投影学生答案】分子在化学反应中可以分解为原子,原子可以构成分子。
原子通过最外层电子的得失变为离子。
【板书】
【思考与交流】1、构成物质的三种微粒有哪些基本特性?
【个别回答】 1、构成物质的三种微粒具有的特性
(1)分子、原子、离子都很小;
(2)分子、原子、离子都不停地做无规则运动;
(3)分子、原子、离子之间有间隔。
【过渡】物质由微粒构成,我们也复习了微粒的特性。日常生活中,我们要会应用微粒角度解释一些常见现象。这叫“宏观现象—微观解释”。这是很重要的化学学习方法,同学们能否把它应用到实际,请尝试用这种思考方向回答以下问题?
【思考与交流】 2、“宏观现象——微观分析”:
(1)解释生活中的一些常见现象:
(桂花十里飘香
(空气和水谁更容易被压缩。
(汽油由具有可燃性的多种分子构成,加油站要严禁烟火。
【个别回答】(桂花十里飘香说明分子不断运动
(空气更易被压缩,因为气体分子间间隔比液体大。
(分子不断运动,分子是保持物质化学性质的最小粒子,构成汽油的分子具有可燃性。
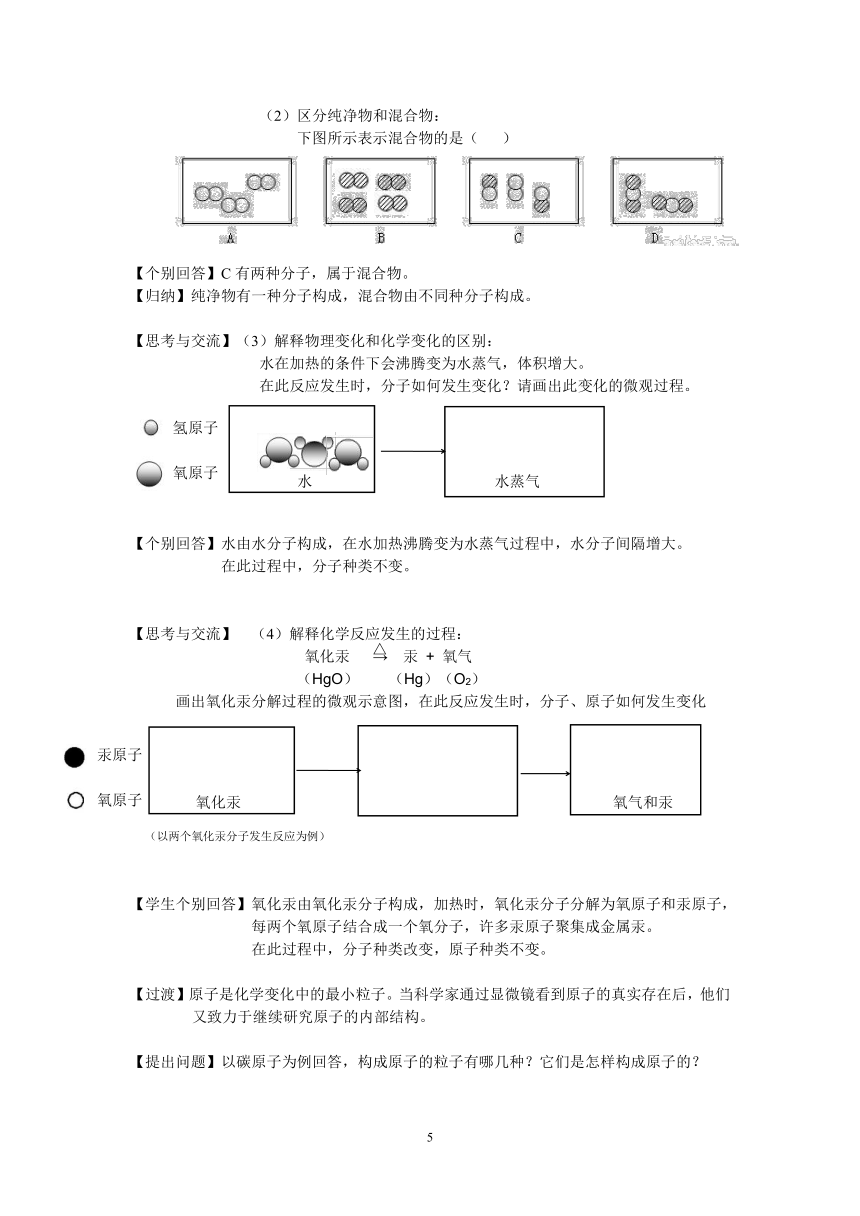
(2)区分纯净物和混合物:
下图所示表示混合物的是( )
【个别回答】C有两种分子,属于混合物。
【归纳】纯净物有一种分子构成,混合物由不同种分子构成。
【思考与交流】(3)解释物理变化和化学变化的区别:
水在加热的条件下会沸腾变为水蒸气,体积增大。
在此反应发生时,分子如何发生变化?请画出此变化的微观过程。
【个
【个别回答】水由水分子构成,在水加热沸腾变为水蒸气过程中,水分子间隔增大。
在此过程中,分子种类不变。
【思考与交流】 (4)解释化学反应发生的过程:
氧化汞 → 汞 + 氧气
(HgO) (Hg)(O2)
画出氧化汞分解过程的微观示意图,在此反应发生时,分子、原子如何发生变化
(以两个氧化汞分子发生反应为例)
【学生个别回答】氧化汞由氧化汞分子构成,加热时,氧化汞分子分解为氧原子和汞原子,每两个氧原子结合成一个氧分子,许多汞原子聚集成金属汞。
在此过程中,分子种类改变,原子种类不变。
【过渡】原子是化学变化中的最小粒子。当科学家通过显微镜看到原子的真实存在后,他们又致力于继续研究原子的内部结构。
【提出问题】以碳原子为例回答,构成原子的粒子有哪几种?它们是怎样构成原子的?
【个别回答】构成原子的粒子有3种,分别是质子、中子、电子。
6个质子和6个中子构成原子核,6个电子在核外作高速运动,构成碳原子。
【板书】二、原子的结构
【过渡】我们会用原子结构示意图简明、方便地表示原子内质子数和核外电子分层排布。
请根据相关知识小组讨论【思考与交流】。
【思考与交流】1、填写下表并回答
原子结构示意图
质子数
电子层数
电子数
最外层电子数
元素分类(金属或非金属)
得失电子情况(得到或失去)
形成离子(阳离子或阴离子)
(1)为什么整个原子不显电性?
(2)氯元素属于非金属元素的判断依据是什么?
2、以下微粒结构示意图中,不属于相对稳定结构的是( )
A. B. C. D.
试归纳什么是相对稳定结构?
【个别回答】
原子结构示意图
质子数
电子层数
电子数
最外层电子数
元素分类(金属或非金属)
得失电子趋势(得到或失去)
形成离子(阳离子或阴离子)
17
3
17
7
非金属元素
得1个电子
阴离子
(1)质子与核外电子的数量相等,电性相反,因此原子不显电性。
(2)氯原子最外层电子数为7,大于4,属于非金属原子。
【归纳】 1、(1)同种原子,质子数=核电荷数=电子数
(2)金属元素原子最外层一般少于4个电子;
非金属元素原子最外层一般多于4个电子;
稀有气体元素原子最外层都有8个电子(He为2个);
2、当最外层电子数等于8时(只有一层为2个电子),该结构化学性质稳定,这种结构叫相对稳定结构。
【思考与交流】 3、“宏观现象——微观分析”:
试从微观角度描述钠和氯气反应,形成氯化钠的过程。
粒子结构示意图
化学符号
粒子结构示意图
化学符号
【个别回答】 钠由钠原子构成,钠原子在发生化学反应时会失去一个电子,形成钠离子,钠离子用符号Na+,带一个单位正电荷。氯原子在发生化学反应时会得到一个电子,形成氯离子,氯离子用符号Cl—表示,带一个单位负电荷。
带相反电荷的钠离子和氯离子在静电作用下互相吸引,但是其原子核间的正电荷互相排斥,两种离子的电子也互相排斥,在吸引和排斥之间达到平衡,形成了氯化钠。
【过渡】(ppt)展示食品包装袋上的成分表
【提出问题】食品包装袋上表明含有铁,此处的“铁”指的是什么呢?铁原子?铁粉?铁元素?
【全班回答】铁元素
【讲解】元素是从另外一个角度,宏观角度来描述物质的组成。什么是元素?
以氧气为为例,氧气由氧元素组成,翻阅课本,你能得到关于氧元素的什么信息呢?
【学生活动】填写以下关系图
概念
元素子
元素是_______________________________的总称。
【教师点评】个别学生答案投影点评
氧气由氧元素组成,元素符号为O,该元素在元素周期表的第二周期,属于非金属元素,原子序数为8,相对原子质量为16.00。氧元素在地壳中的含量为48.60%。地壳中元素含量前四位的分别是氧、硅、铝、铁。请同学们注意和空气中的元素含量区分。
【板书】三、元素
【思考和交流】1、钠元素和氯元素的区别是什么?
A.质子数不同 B.中子数不同
C.相对原子质量不同 D.中子数与核外电子数之和不同
2、化学反应前后,元素的种类是否改变?
试根据氧化汞分解为例说明 氧化汞 → 汞 + 氧气
(HgO) (Hg)(O2)
3、 以氧元素为例,氧元素化学性质与氧原子结构中的哪部分关系最密切?
4、以元素符号N为例,既可以代表____________,又可以代表___________。
5、元素周期表中的原子序数与_______________在数值上相同。
【教师点评】1、根据元素概念,元素是质子数相同的一类原子的总称。不同种元素最本质的区别是质子数不同。
2、以氧化汞分解为例,氧化汞在加热的条件下分解,生成氧气和汞。
反应前氧化汞由汞元素和氧元素组成,反应后汞由汞元素组成,氧气由氧元素
组成,反应前后元素种类不变。
3、元素的化学性质与其原子的核外电子排布,特别是最外层电子数有关。
4、元素符号N可以代表氮元素、又可以代表一个氮原子。
5、元素周期表中的原子序数与元素原子核电荷数在数值上相同。
【总结】通过这节课的学习,我们复习了第三单元的基本概念,并且把各个概念联系成了一个框架。
下面我们来看看,同学们对第三单元学习的分子、原子、离子、元素等内容还有什么想了解的呢……
【ppt】投影学生课前收集的问题,为以后的学习作铺垫。
板书设计
第三单元 物质构成的奥秘 复习课
一、分子、原子和离子
二、原子的结构
三、元素
四、物质的组成和构成间的关系
八、课前调查问卷设计
班别_______________ 姓名___________________ 学号____________
通过第3单元的学习,下列知识是否感到困惑,是的选A,不是选B,填在答题卡相应位置
物质是由什么微粒构成的;
分子原子不停运动用于解释现象;
分子原子间有间隔用于解释体积变化,三态变化,热胀冷缩;
由分子构成的物质,分子是保持化学性质的最小粒子;
在化学变化中,原子的种类不变;
用分子原子角度解释物理变化、化学变化;
从分子原子角度看混合物和纯净物;
原子的构成;
原子结构示意图怎么看;
如何从原子结构示意图判断原子分类;
原子怎么变成离子;
氯化钠是怎样形成的;
相对原子质量≈质子数+中子数
元素是质子数相同的一类原子的总称;不同种元素的本质区别是什么;
如何判断元素属于金属元素、非金属元素?
元素的化学性质与什么有关;
什么物质由分子构成,什么物质由原子、离子构成;
元素符号的意义;
元素周期表的信息;
在作业中最让你百思不得其解的习题是哪一条?请把原题摘录下来
通过第3单元的学习,你想进一步了解分子、原子、离子、元素的其他什么知识?
【课后练习】
元素周期表是化学学习和研究的重要工具,下面是元素周期表的一部分
从表中可以查出硅(Si)原子的相对原子质量为__________。
6-11号元素中,属于金属元素的是_________________________(
一、教材分析(复习课定位)
本节课教学内容是第三单元的知识复习。第三单元包括三个课题,分别是“分子和原子”“原子的结构”和“元素”。这些课题所涉及的内容在初中化学课程中占有重要的基础地位。这些生长性强的基本概念是支撑和构建初中化学知识的重要节点。正确理解这些基本概念,熟练运用有关化学术语和用语,是学习元素化合物、化学实验和化学基本计算等其他知识板块的重要基础和工具。
本单元包括分子、原子、离子、元素等基本概念,内容比较抽象,与学生的生活经验距离较远,学生不容易理解。各个知识点之间存在大量联系,可以举一反三,但学生刚接触无法融会贯通,也无法清晰地整理好各个概念之间的联系,这是学生觉得第三单元难的其中一个原因。
学情分析
1、化学和物理基本同一时间讲分子原子,在此之前学生极少微观感性认识,通过第三单元新课学习,学生只是初步建立微粒观。
2、本单元包括分子、原子、离子、元素等基本概念,内容比较抽象,与学生的生活经验距离较远,学生不容易理解。在不容易理解的基础上,大量陌生的名词如“相对原子质量”“相对稳定结构”“核电荷数”等让学生容易混淆。学生普遍存在听课能听懂,做题错得多的情况。这种情况的发生是由于习题的提问形式偏注重理解,学生学习化学时间不长,累积的知识和感性经验有限,不容易通过大量例子多角度地理解概念,导致概念理解不透彻。
3、本单元重点较多但零散,学生做题时遇到的困难无法直接在课本上找到知识的附着点,学生对概念之间是如何联系和发展的联系很模糊。
4、本单元的教学内容从第一、二单元的实验操作和元素化合物知识跳入抽象概念的学习,与前两个单元的识记类内容形成强烈反差,学生容易产生惧难情绪。
教学目标
回顾、进一步理解有关分子、原子、离子、元素等概念。
通过具体物质(元素),及其变化为例构建本章知识网络。
进一步强化“化学变化过程中分子、离子的变化,而原子、元素种类不变”的观念
4、进一步建立起微粒观,并能运用微粒观解释有关问题
四、教学重难点
(一)重点:1、分子、原子、元素、离子等基本概念复习;
2、理解物质与它们之间的关系,形成完整的知识网络
3、进一步建立起微粒观,并能运用微粒观解释某些常见现象。
(二)难点:用微观离子的运动解释宏观物质的性质与变化
五、教学设计
每一环节包括三个部分:
构建知识网络;
把教材中重要的知识点和观点以“思考与交流”的方式呈现;
六、教学过程
【引入】
物质由看不见的微小粒子构成,这本来只是科学家的一个大胆猜测,随着科技进步,我们通过先进的科学仪器观察到这些微粒的存在
【提出问题】那么构成物质的微粒有哪些?
【个别回答】有三种微粒,分别是分子、原子、离子。
【板书】一、分子、原子、离子
【提出问题】由分子、原子、离子构成的物质分别有哪些? 请各举2例
【个别回答】由离子构成的物质有氯化钠和硫酸铜;由原子构成的物质有金刚石、铁和汞等;由分子构成的物质有氧气、氢气、氨气等。
【归纳】感谢同学分享了他的答案。其实以铁、汞为代表的金属,都由原子构成。如常见的金属铜,由铜原子构成,金属铝由铝原子构成,还有如课本P.60所示的金刚石由原子构成;而常见的气体,一般由分子构成,如空气的主要成分氮气、氧气和二氧化碳,分别由氮气分子,氧气分子和二氧化碳分子构成;由离子构成的物质课本介绍了氯化钠和硫酸铜
【过渡】物质由分子、原子、离子构成,那么什么是分子、原子、离子呢?
他们之间怎样转化?
【学生活动】1、下列关于分子、原子、离子的说法中,正确的是(B)
A.原子是最小粒子。
B.分子是由原子构成的。
C.由分子构成的物质,分子是保持其性质的最小粒子。
D.带电的原子叫离子,离子可以分为正离子和负离子。
2、分子、原子、离子怎样转化。
分子 原子 离子
【个别回答】A更改为“原子是化学反应中的最小粒子”。
C更改为“由分子构成的物质,分子是保持其化学性质的最小粒子”。
D更改为“带电的原子叫离子,离子分为阳离子和阴离子”。
【投影学生答案】分子在化学反应中可以分解为原子,原子可以构成分子。
原子通过最外层电子的得失变为离子。
【板书】
【思考与交流】1、构成物质的三种微粒有哪些基本特性?
【个别回答】 1、构成物质的三种微粒具有的特性
(1)分子、原子、离子都很小;
(2)分子、原子、离子都不停地做无规则运动;
(3)分子、原子、离子之间有间隔。
【过渡】物质由微粒构成,我们也复习了微粒的特性。日常生活中,我们要会应用微粒角度解释一些常见现象。这叫“宏观现象—微观解释”。这是很重要的化学学习方法,同学们能否把它应用到实际,请尝试用这种思考方向回答以下问题?
【思考与交流】 2、“宏观现象——微观分析”:
(1)解释生活中的一些常见现象:
(桂花十里飘香
(空气和水谁更容易被压缩。
(汽油由具有可燃性的多种分子构成,加油站要严禁烟火。
【个别回答】(桂花十里飘香说明分子不断运动
(空气更易被压缩,因为气体分子间间隔比液体大。
(分子不断运动,分子是保持物质化学性质的最小粒子,构成汽油的分子具有可燃性。
(2)区分纯净物和混合物:
下图所示表示混合物的是( )
【个别回答】C有两种分子,属于混合物。
【归纳】纯净物有一种分子构成,混合物由不同种分子构成。
【思考与交流】(3)解释物理变化和化学变化的区别:
水在加热的条件下会沸腾变为水蒸气,体积增大。
在此反应发生时,分子如何发生变化?请画出此变化的微观过程。
【个
【个别回答】水由水分子构成,在水加热沸腾变为水蒸气过程中,水分子间隔增大。
在此过程中,分子种类不变。
【思考与交流】 (4)解释化学反应发生的过程:
氧化汞 → 汞 + 氧气
(HgO) (Hg)(O2)
画出氧化汞分解过程的微观示意图,在此反应发生时,分子、原子如何发生变化
(以两个氧化汞分子发生反应为例)
【学生个别回答】氧化汞由氧化汞分子构成,加热时,氧化汞分子分解为氧原子和汞原子,每两个氧原子结合成一个氧分子,许多汞原子聚集成金属汞。
在此过程中,分子种类改变,原子种类不变。
【过渡】原子是化学变化中的最小粒子。当科学家通过显微镜看到原子的真实存在后,他们又致力于继续研究原子的内部结构。
【提出问题】以碳原子为例回答,构成原子的粒子有哪几种?它们是怎样构成原子的?
【个别回答】构成原子的粒子有3种,分别是质子、中子、电子。
6个质子和6个中子构成原子核,6个电子在核外作高速运动,构成碳原子。
【板书】二、原子的结构
【过渡】我们会用原子结构示意图简明、方便地表示原子内质子数和核外电子分层排布。
请根据相关知识小组讨论【思考与交流】。
【思考与交流】1、填写下表并回答
原子结构示意图
质子数
电子层数
电子数
最外层电子数
元素分类(金属或非金属)
得失电子情况(得到或失去)
形成离子(阳离子或阴离子)
(1)为什么整个原子不显电性?
(2)氯元素属于非金属元素的判断依据是什么?
2、以下微粒结构示意图中,不属于相对稳定结构的是( )
A. B. C. D.
试归纳什么是相对稳定结构?
【个别回答】
原子结构示意图
质子数
电子层数
电子数
最外层电子数
元素分类(金属或非金属)
得失电子趋势(得到或失去)
形成离子(阳离子或阴离子)
17
3
17
7
非金属元素
得1个电子
阴离子
(1)质子与核外电子的数量相等,电性相反,因此原子不显电性。
(2)氯原子最外层电子数为7,大于4,属于非金属原子。
【归纳】 1、(1)同种原子,质子数=核电荷数=电子数
(2)金属元素原子最外层一般少于4个电子;
非金属元素原子最外层一般多于4个电子;
稀有气体元素原子最外层都有8个电子(He为2个);
2、当最外层电子数等于8时(只有一层为2个电子),该结构化学性质稳定,这种结构叫相对稳定结构。
【思考与交流】 3、“宏观现象——微观分析”:
试从微观角度描述钠和氯气反应,形成氯化钠的过程。
粒子结构示意图
化学符号
粒子结构示意图
化学符号
【个别回答】 钠由钠原子构成,钠原子在发生化学反应时会失去一个电子,形成钠离子,钠离子用符号Na+,带一个单位正电荷。氯原子在发生化学反应时会得到一个电子,形成氯离子,氯离子用符号Cl—表示,带一个单位负电荷。
带相反电荷的钠离子和氯离子在静电作用下互相吸引,但是其原子核间的正电荷互相排斥,两种离子的电子也互相排斥,在吸引和排斥之间达到平衡,形成了氯化钠。
【过渡】(ppt)展示食品包装袋上的成分表
【提出问题】食品包装袋上表明含有铁,此处的“铁”指的是什么呢?铁原子?铁粉?铁元素?
【全班回答】铁元素
【讲解】元素是从另外一个角度,宏观角度来描述物质的组成。什么是元素?
以氧气为为例,氧气由氧元素组成,翻阅课本,你能得到关于氧元素的什么信息呢?
【学生活动】填写以下关系图
概念
元素子
元素是_______________________________的总称。
【教师点评】个别学生答案投影点评
氧气由氧元素组成,元素符号为O,该元素在元素周期表的第二周期,属于非金属元素,原子序数为8,相对原子质量为16.00。氧元素在地壳中的含量为48.60%。地壳中元素含量前四位的分别是氧、硅、铝、铁。请同学们注意和空气中的元素含量区分。
【板书】三、元素
【思考和交流】1、钠元素和氯元素的区别是什么?
A.质子数不同 B.中子数不同
C.相对原子质量不同 D.中子数与核外电子数之和不同
2、化学反应前后,元素的种类是否改变?
试根据氧化汞分解为例说明 氧化汞 → 汞 + 氧气
(HgO) (Hg)(O2)
3、 以氧元素为例,氧元素化学性质与氧原子结构中的哪部分关系最密切?
4、以元素符号N为例,既可以代表____________,又可以代表___________。
5、元素周期表中的原子序数与_______________在数值上相同。
【教师点评】1、根据元素概念,元素是质子数相同的一类原子的总称。不同种元素最本质的区别是质子数不同。
2、以氧化汞分解为例,氧化汞在加热的条件下分解,生成氧气和汞。
反应前氧化汞由汞元素和氧元素组成,反应后汞由汞元素组成,氧气由氧元素
组成,反应前后元素种类不变。
3、元素的化学性质与其原子的核外电子排布,特别是最外层电子数有关。
4、元素符号N可以代表氮元素、又可以代表一个氮原子。
5、元素周期表中的原子序数与元素原子核电荷数在数值上相同。
【总结】通过这节课的学习,我们复习了第三单元的基本概念,并且把各个概念联系成了一个框架。
下面我们来看看,同学们对第三单元学习的分子、原子、离子、元素等内容还有什么想了解的呢……
【ppt】投影学生课前收集的问题,为以后的学习作铺垫。
板书设计
第三单元 物质构成的奥秘 复习课
一、分子、原子和离子
二、原子的结构
三、元素
四、物质的组成和构成间的关系
八、课前调查问卷设计
班别_______________ 姓名___________________ 学号____________
通过第3单元的学习,下列知识是否感到困惑,是的选A,不是选B,填在答题卡相应位置
物质是由什么微粒构成的;
分子原子不停运动用于解释现象;
分子原子间有间隔用于解释体积变化,三态变化,热胀冷缩;
由分子构成的物质,分子是保持化学性质的最小粒子;
在化学变化中,原子的种类不变;
用分子原子角度解释物理变化、化学变化;
从分子原子角度看混合物和纯净物;
原子的构成;
原子结构示意图怎么看;
如何从原子结构示意图判断原子分类;
原子怎么变成离子;
氯化钠是怎样形成的;
相对原子质量≈质子数+中子数
元素是质子数相同的一类原子的总称;不同种元素的本质区别是什么;
如何判断元素属于金属元素、非金属元素?
元素的化学性质与什么有关;
什么物质由分子构成,什么物质由原子、离子构成;
元素符号的意义;
元素周期表的信息;
在作业中最让你百思不得其解的习题是哪一条?请把原题摘录下来
通过第3单元的学习,你想进一步了解分子、原子、离子、元素的其他什么知识?
【课后练习】
元素周期表是化学学习和研究的重要工具,下面是元素周期表的一部分
从表中可以查出硅(Si)原子的相对原子质量为__________。
6-11号元素中,属于金属元素的是_________________________(
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
