人教版九上化学第二单元 我们周围的空气 单元复习导学案
文档属性
| 名称 | 人教版九上化学第二单元 我们周围的空气 单元复习导学案 |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-05 21:43:59 | ||
图片预览


文档简介
单元总结提升
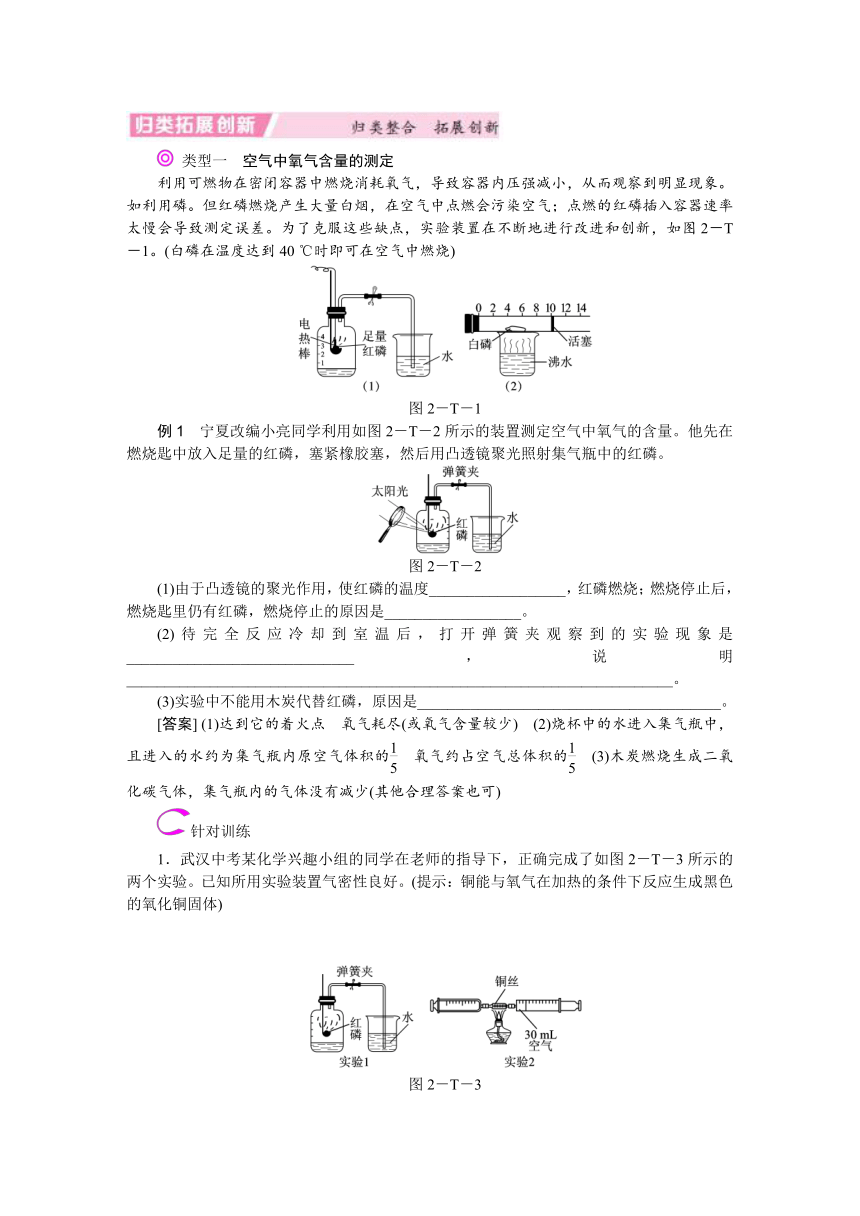
类型一 空气中氧气含量的测定
利用可燃物在密闭容器中燃烧消耗氧气,导致容器内压强减小,从而观察到明显现象。如利用磷。但红磷燃烧产生大量白烟,在空气中点燃会污染空气;点燃的红磷插入容器速率太慢会导致测定误差。为了克服这些缺点,实验装置在不断地进行改进和创新,如图2-T-1。(白磷在温度达到40 ℃时即可在空气中燃烧)
图2-T-1
例1 宁夏改编小亮同学利用如图2-T-2所示的装置测定空气中氧气的含量。他先在燃烧匙中放入足量的红磷,塞紧橡胶塞,然后用凸透镜聚光照射集气瓶中的红磷。
图2-T-2
(1)由于凸透镜的聚光作用,使红磷的温度__________________,红磷燃烧;燃烧停止后,燃烧匙里仍有红磷,燃烧停止的原因是__________________。
(2)待完全反应冷却到室温后,打开弹簧夹观察到的实验现象是______________________________,说明________________________________________________________________________。
(3)实验中不能用木炭代替红磷,原因是________________________________________。
[答案] (1)达到它的着火点 氧气耗尽(或氧气含量较少) (2)烧杯中的水进入集气瓶中,且进入的水约为集气瓶内原空气体积的 氧气约占空气总体积的 (3)木炭燃烧生成二氧化碳气体,集气瓶内的气体没有减少(其他合理答案也可)
针对训练
1.武汉中考某化学兴趣小组的同学在老师的指导下,正确完成了如图2-T-3所示的两个实验。已知所用实验装置气密性良好。(提示:铜能与氧气在加热的条件下反应生成黑色的氧化铜固体)
图2-T-3
关于该实验,有如下说法:①红磷熄灭并冷却后才能打开弹簧夹;②点燃酒精灯加热铜丝,可观察到铜丝由红色变成黑色;③停止加热后即可读出注射器内气体的体积约为24 mL;④实验取用铜丝质量的多少不会影响实验结果;⑤两个实验均能证明空气是混合物;⑥两个实验均能证明空气中约含体积的氧气。其中正确说法的个数有( )
A.2个 B.3个
C.4个 D.5个
[解析] C 应该在停止加热并冷却至室温才能读数,故③说法错误;实验过程中为了将空气中的氧气完全耗尽,加入的铜丝必须是过量的,故④说法错误;其余说法均正确。
类型二 氧气的化学性质
氧气是一种比较活泼的气体,在一定条件下(点燃或加热)能和许多物质发生剧烈反应,如木炭、硫、铁丝、蜡烛等,反应同时放出大量的热。氧气在反应中提供氧,这种性质称为氧化性,物质与氧气的反应属于氧化反应。
例2 氧气的化学性质比较活泼,能与多种物质反应。下列对有关反应的描述正确的是( )
A.在点燃的条件下,细铁丝在氧气中剧烈燃烧,火星四射,生成黑色的三氧化二铁
B.在点燃的条件下,硫在氧气里燃烧,发出蓝紫色火焰,生成无色、无味的气体
C.铁、硫、酒精在氧气中的燃烧都是化合反应
D.物质与氧气发生的反应属于氧化反应,氧气具有氧化性
[解析] D 在点燃的条件下,细铁丝在氧气中剧烈燃烧会生成黑色的四氧化三铁,故A错;在点燃的条件下,硫在氧气中燃烧,生成有刺激性气味的气体,故B错;铁、硫在氧气中的燃烧是化合反应,但酒精在氧气中的燃烧不是化合反应,故C错;物质与氧气发生的反应属于氧化反应,氧气具有氧化性,故D正确。
针对训练
2.氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应。如:
①硫+氧气二氧化硫
②磷+氧气五氧化二磷
③铁+氧气四氧化三铁
关于上述三个反应的叙述中,不正确的是 ( )
A.都需要点燃
B.都是氧化反应
C.都属于化合反应
D.生成物都是固体
[解析] D 硫在氧气中燃烧的生成物二氧化硫是气体,故D错误。
类型三 制取氧气的实验探究
如图2-T-4是实验室制取氧气的常用装置:
图2-T-4
(1)如果选用过氧化氢溶液和二氧化锰制取氧气,应用固体与液体反应且不需要加热的装置,则选择图A装置,收集装置选择C或D。
(2)如果选用加热高锰酸钾或氯酸钾和二氧化锰的混合物制取氧气,应用固体加热型装置,则选择图B装置,收集装置选择C或D。
例3 东营中考熟悉和使用中学化学实验中常见仪器及用品,是学习化学的基本要求。如图2-T-5是实验室中常用的几种化学仪器。试回答以下问题。
图2-T-5
(1)仪器A、E的名称是____________、________。
(2) “磨砂”是增加玻璃仪器密封性的一种处理工艺。在上述仪器中,用到“磨砂”工艺处理的有____________(填字母序号)。
(3)欲装配一套用高锰酸钾制取氧气的发生装置,需要用到的仪器有____________(填字母序号),还须补充的一种用品是____________。请简述如何组装一套给试管里的固体加热的装置:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[答案] (1)试管 长颈漏斗
(2)BFI
(3)ADFH 棉花 首先放置好酒精灯,然后根据酒精灯火焰的高度将盛有药品的试管固定在铁架台上,试管口略向下倾斜
[解析] (2)凡是玻璃相互接触,不能漏水、漏气的均要磨砂处理,用到“磨砂”工艺处理的玻璃仪器有:集气瓶、酒精灯、毛玻璃片等。(3)高锰酸钾制取氧气属于加热固体制取气体,组装发生装置需用到试管、铁架台、酒精灯、带导管的单孔橡胶塞、棉花。组装发生制取装置按照从上到下、从左到到右的顺序。
针对训练
3.某市中考化学实验考查时,小青同学抽到的题目是“氧气的制取、收集和检验”。
图2-T-6是完成该实验所需的部分实验用品。
图2-T-6
请回答下列问题。
(1)小青在清点药品时发现装有液体的试剂瓶G的标签掉了,你认为该瓶所装试剂是____________。
(2)小青用以上实验用品组装了一套制取氧气的发生装置,你认为她所选的仪器是________(填序号)。
(3)写出用所给药品制取氧气的文字表达式:
________________________________________________________________________。
(4)用排水法收集氧气时,当水槽中集气瓶内的水排尽后,把集气瓶转移到桌面上的操作是________________________________________________________________________
________________________________________________________________________。
(5)小青检验集气瓶中的气体为氧气的操作是
________________________________________________________________________。
[答案] (1)过氧化氢溶液 (2)ABF
(3)过氧化氢水+氧气
(4)用玻璃片盖住集气瓶口,把集气瓶移出水槽,正放在桌面上
(5)把带火星的木条伸入集气瓶中,木条复燃,证明该瓶气体为氧气
[解析] 从题给的实验用品中可以看出,小青同学是用过氧化氢溶液和二氧化锰混合来制氧气,试剂瓶G所装试剂应是过氧化氢溶液;故发生装置所需要的仪器是试管、带铁夹的铁架台和带导管的橡胶塞;当水槽中集气瓶内的水排尽后,应在水下用玻璃片盖住集气瓶口,再把集气瓶移出水槽,正放在桌面上;检验集气瓶中的气体为氧气的操作是将带火星的木条伸入集气瓶中,观察木条是否复燃。
类型四 有关催化剂的实验探究
催化剂的概念应从下面几个方面来理解:
(1)“改变”包括“加快”和“减慢”两层意思,不能将“质量和化学性质不变”误解为“在反应过程中不变”或“物理性质不变”。
(2)催化剂≠二氧化锰。在某些反应中,二氧化锰是催化剂,但在某些反应中,二氧化锰也可能是反应物或生成物。硫酸铜溶液、红砖粉等对过氧化氢的分解也具有催化作用。
(3)催化剂只能改变化学反应速率,不能增加或减少生成物的质量。
(4)对于一个反应,没有催化剂并不意味着该反应不能进行。
例4 某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
Ⅰ.将3.0 g 氯酸钾与1.0 g 二氧化锰均匀混合加热。
Ⅱ.将x g氯酸钾与1.0 g氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
Ⅰ中反应的文字表达式是____________________________________________________
____________;Ⅱ中x的值应为________。
(2)乙探究了影响过氧化氢分解速率的某种因素,实验数据记录如下:
过氧化氢溶
液的质量
过氧化氢溶
液的浓度
二氧化锰
的质量
相同时间内产
生氧气的体积
Ⅰ
50.0 g
1%
0.1 g
9 mL
Ⅱ
50.0 g
2%
0.1 g
16 mL
Ⅲ
50.0 g
4%
0.1 g
31 mL
本实验中,测量氧气体积的装置是图2-T-7中的________(填编号)。
图2-T-7 图2-T-8
实验结论:在相同条件下,________,过氧化氢分解得越快。丙用图2-T-8所示装置进行实验,通过比较____________________也能达到实验目的。
[答案] (1)氯酸钾氯化钾+氧气 3.0
(2)c 过氧化氢溶液浓度越大 相同时间内天平读数差值大小(其他合理答案也可)
[解析] 氯酸钾在二氧化锰的催化作用下加热能快速地产生氧气。进行实验探究时要注意控制到只有一个变量,故x为3.0;根据表中数据可以看出,过氧化氢溶液的浓度越大,相同时间产生氧气的体积越大;丙使用称量剩余物质的质量的方法得出生成氧气的质量,根据相同时间内天平读数的差值大小,可以判断反应的快慢。
针对训练
4.实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:________________________________________________________________________
________________________________________________________________________。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
[提出猜想] 除二氧化锰、氧化铜外,三氧化二铁也可以作氯酸钾分解的催化剂。
[完成实验] 按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号
实验药品
分解温度/℃
①
氯酸钾
580
②
氯酸钾、二氧化锰(质量比1∶1)
350
③
氯酸钾、氧化铜(质量比1∶1)
370
④
氯酸钾、三氧化二铁(质量比1∶1)
390
[分析数据、得出结论] (1)由实验________与实验④对比,证明猜想合理。
(2)实验所用的三种物质,催化效果最好的是________。
[反思] (1)若要证明三氧化二铁是该反应的催化剂,还要验证它在化学反应前后质量和________不变。
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证:________________________________________________________________________
________________________________________________________________________。
(3)同种催化剂,还有哪些因素可能影响催化效果?请你再探究(探究一种因素即可)。
[答案] 氯酸钾氯化钾+氧气
[分析数据、得出结论] (1)① (2)二氧化锰
[反思] (1)化学性质
(2)将氯酸钾与颗粒大小不同的同种催化剂等质量比充分混合加热,测定分解温度
(3)[提出假设] 催化剂与反应物的质量比不同,催化效果不同。
[设计方案] ①取同颗粒大小的同一催化剂与氯酸钾以不同质量比充分混合;②分别加热,测定分解温度。
[得出结论] 如果分解温度不同,说明假设成立;反之则不成立。
类型一 空气中氧气含量的测定
利用可燃物在密闭容器中燃烧消耗氧气,导致容器内压强减小,从而观察到明显现象。如利用磷。但红磷燃烧产生大量白烟,在空气中点燃会污染空气;点燃的红磷插入容器速率太慢会导致测定误差。为了克服这些缺点,实验装置在不断地进行改进和创新,如图2-T-1。(白磷在温度达到40 ℃时即可在空气中燃烧)
图2-T-1
例1 宁夏改编小亮同学利用如图2-T-2所示的装置测定空气中氧气的含量。他先在燃烧匙中放入足量的红磷,塞紧橡胶塞,然后用凸透镜聚光照射集气瓶中的红磷。
图2-T-2
(1)由于凸透镜的聚光作用,使红磷的温度__________________,红磷燃烧;燃烧停止后,燃烧匙里仍有红磷,燃烧停止的原因是__________________。
(2)待完全反应冷却到室温后,打开弹簧夹观察到的实验现象是______________________________,说明________________________________________________________________________。
(3)实验中不能用木炭代替红磷,原因是________________________________________。
[答案] (1)达到它的着火点 氧气耗尽(或氧气含量较少) (2)烧杯中的水进入集气瓶中,且进入的水约为集气瓶内原空气体积的 氧气约占空气总体积的 (3)木炭燃烧生成二氧化碳气体,集气瓶内的气体没有减少(其他合理答案也可)
针对训练
1.武汉中考某化学兴趣小组的同学在老师的指导下,正确完成了如图2-T-3所示的两个实验。已知所用实验装置气密性良好。(提示:铜能与氧气在加热的条件下反应生成黑色的氧化铜固体)
图2-T-3
关于该实验,有如下说法:①红磷熄灭并冷却后才能打开弹簧夹;②点燃酒精灯加热铜丝,可观察到铜丝由红色变成黑色;③停止加热后即可读出注射器内气体的体积约为24 mL;④实验取用铜丝质量的多少不会影响实验结果;⑤两个实验均能证明空气是混合物;⑥两个实验均能证明空气中约含体积的氧气。其中正确说法的个数有( )
A.2个 B.3个
C.4个 D.5个
[解析] C 应该在停止加热并冷却至室温才能读数,故③说法错误;实验过程中为了将空气中的氧气完全耗尽,加入的铜丝必须是过量的,故④说法错误;其余说法均正确。
类型二 氧气的化学性质
氧气是一种比较活泼的气体,在一定条件下(点燃或加热)能和许多物质发生剧烈反应,如木炭、硫、铁丝、蜡烛等,反应同时放出大量的热。氧气在反应中提供氧,这种性质称为氧化性,物质与氧气的反应属于氧化反应。
例2 氧气的化学性质比较活泼,能与多种物质反应。下列对有关反应的描述正确的是( )
A.在点燃的条件下,细铁丝在氧气中剧烈燃烧,火星四射,生成黑色的三氧化二铁
B.在点燃的条件下,硫在氧气里燃烧,发出蓝紫色火焰,生成无色、无味的气体
C.铁、硫、酒精在氧气中的燃烧都是化合反应
D.物质与氧气发生的反应属于氧化反应,氧气具有氧化性
[解析] D 在点燃的条件下,细铁丝在氧气中剧烈燃烧会生成黑色的四氧化三铁,故A错;在点燃的条件下,硫在氧气中燃烧,生成有刺激性气味的气体,故B错;铁、硫在氧气中的燃烧是化合反应,但酒精在氧气中的燃烧不是化合反应,故C错;物质与氧气发生的反应属于氧化反应,氧气具有氧化性,故D正确。
针对训练
2.氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应。如:
①硫+氧气二氧化硫
②磷+氧气五氧化二磷
③铁+氧气四氧化三铁
关于上述三个反应的叙述中,不正确的是 ( )
A.都需要点燃
B.都是氧化反应
C.都属于化合反应
D.生成物都是固体
[解析] D 硫在氧气中燃烧的生成物二氧化硫是气体,故D错误。
类型三 制取氧气的实验探究
如图2-T-4是实验室制取氧气的常用装置:
图2-T-4
(1)如果选用过氧化氢溶液和二氧化锰制取氧气,应用固体与液体反应且不需要加热的装置,则选择图A装置,收集装置选择C或D。
(2)如果选用加热高锰酸钾或氯酸钾和二氧化锰的混合物制取氧气,应用固体加热型装置,则选择图B装置,收集装置选择C或D。
例3 东营中考熟悉和使用中学化学实验中常见仪器及用品,是学习化学的基本要求。如图2-T-5是实验室中常用的几种化学仪器。试回答以下问题。
图2-T-5
(1)仪器A、E的名称是____________、________。
(2) “磨砂”是增加玻璃仪器密封性的一种处理工艺。在上述仪器中,用到“磨砂”工艺处理的有____________(填字母序号)。
(3)欲装配一套用高锰酸钾制取氧气的发生装置,需要用到的仪器有____________(填字母序号),还须补充的一种用品是____________。请简述如何组装一套给试管里的固体加热的装置:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[答案] (1)试管 长颈漏斗
(2)BFI
(3)ADFH 棉花 首先放置好酒精灯,然后根据酒精灯火焰的高度将盛有药品的试管固定在铁架台上,试管口略向下倾斜
[解析] (2)凡是玻璃相互接触,不能漏水、漏气的均要磨砂处理,用到“磨砂”工艺处理的玻璃仪器有:集气瓶、酒精灯、毛玻璃片等。(3)高锰酸钾制取氧气属于加热固体制取气体,组装发生装置需用到试管、铁架台、酒精灯、带导管的单孔橡胶塞、棉花。组装发生制取装置按照从上到下、从左到到右的顺序。
针对训练
3.某市中考化学实验考查时,小青同学抽到的题目是“氧气的制取、收集和检验”。
图2-T-6是完成该实验所需的部分实验用品。
图2-T-6
请回答下列问题。
(1)小青在清点药品时发现装有液体的试剂瓶G的标签掉了,你认为该瓶所装试剂是____________。
(2)小青用以上实验用品组装了一套制取氧气的发生装置,你认为她所选的仪器是________(填序号)。
(3)写出用所给药品制取氧气的文字表达式:
________________________________________________________________________。
(4)用排水法收集氧气时,当水槽中集气瓶内的水排尽后,把集气瓶转移到桌面上的操作是________________________________________________________________________
________________________________________________________________________。
(5)小青检验集气瓶中的气体为氧气的操作是
________________________________________________________________________。
[答案] (1)过氧化氢溶液 (2)ABF
(3)过氧化氢水+氧气
(4)用玻璃片盖住集气瓶口,把集气瓶移出水槽,正放在桌面上
(5)把带火星的木条伸入集气瓶中,木条复燃,证明该瓶气体为氧气
[解析] 从题给的实验用品中可以看出,小青同学是用过氧化氢溶液和二氧化锰混合来制氧气,试剂瓶G所装试剂应是过氧化氢溶液;故发生装置所需要的仪器是试管、带铁夹的铁架台和带导管的橡胶塞;当水槽中集气瓶内的水排尽后,应在水下用玻璃片盖住集气瓶口,再把集气瓶移出水槽,正放在桌面上;检验集气瓶中的气体为氧气的操作是将带火星的木条伸入集气瓶中,观察木条是否复燃。
类型四 有关催化剂的实验探究
催化剂的概念应从下面几个方面来理解:
(1)“改变”包括“加快”和“减慢”两层意思,不能将“质量和化学性质不变”误解为“在反应过程中不变”或“物理性质不变”。
(2)催化剂≠二氧化锰。在某些反应中,二氧化锰是催化剂,但在某些反应中,二氧化锰也可能是反应物或生成物。硫酸铜溶液、红砖粉等对过氧化氢的分解也具有催化作用。
(3)催化剂只能改变化学反应速率,不能增加或减少生成物的质量。
(4)对于一个反应,没有催化剂并不意味着该反应不能进行。
例4 某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
Ⅰ.将3.0 g 氯酸钾与1.0 g 二氧化锰均匀混合加热。
Ⅱ.将x g氯酸钾与1.0 g氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
Ⅰ中反应的文字表达式是____________________________________________________
____________;Ⅱ中x的值应为________。
(2)乙探究了影响过氧化氢分解速率的某种因素,实验数据记录如下:
过氧化氢溶
液的质量
过氧化氢溶
液的浓度
二氧化锰
的质量
相同时间内产
生氧气的体积
Ⅰ
50.0 g
1%
0.1 g
9 mL
Ⅱ
50.0 g
2%
0.1 g
16 mL
Ⅲ
50.0 g
4%
0.1 g
31 mL
本实验中,测量氧气体积的装置是图2-T-7中的________(填编号)。
图2-T-7 图2-T-8
实验结论:在相同条件下,________,过氧化氢分解得越快。丙用图2-T-8所示装置进行实验,通过比较____________________也能达到实验目的。
[答案] (1)氯酸钾氯化钾+氧气 3.0
(2)c 过氧化氢溶液浓度越大 相同时间内天平读数差值大小(其他合理答案也可)
[解析] 氯酸钾在二氧化锰的催化作用下加热能快速地产生氧气。进行实验探究时要注意控制到只有一个变量,故x为3.0;根据表中数据可以看出,过氧化氢溶液的浓度越大,相同时间产生氧气的体积越大;丙使用称量剩余物质的质量的方法得出生成氧气的质量,根据相同时间内天平读数的差值大小,可以判断反应的快慢。
针对训练
4.实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:________________________________________________________________________
________________________________________________________________________。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
[提出猜想] 除二氧化锰、氧化铜外,三氧化二铁也可以作氯酸钾分解的催化剂。
[完成实验] 按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号
实验药品
分解温度/℃
①
氯酸钾
580
②
氯酸钾、二氧化锰(质量比1∶1)
350
③
氯酸钾、氧化铜(质量比1∶1)
370
④
氯酸钾、三氧化二铁(质量比1∶1)
390
[分析数据、得出结论] (1)由实验________与实验④对比,证明猜想合理。
(2)实验所用的三种物质,催化效果最好的是________。
[反思] (1)若要证明三氧化二铁是该反应的催化剂,还要验证它在化学反应前后质量和________不变。
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证:________________________________________________________________________
________________________________________________________________________。
(3)同种催化剂,还有哪些因素可能影响催化效果?请你再探究(探究一种因素即可)。
[答案] 氯酸钾氯化钾+氧气
[分析数据、得出结论] (1)① (2)二氧化锰
[反思] (1)化学性质
(2)将氯酸钾与颗粒大小不同的同种催化剂等质量比充分混合加热,测定分解温度
(3)[提出假设] 催化剂与反应物的质量比不同,催化效果不同。
[设计方案] ①取同颗粒大小的同一催化剂与氯酸钾以不同质量比充分混合;②分别加热,测定分解温度。
[得出结论] 如果分解温度不同,说明假设成立;反之则不成立。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
