人教版高中化学必修一教学资料,复习补习资料(巩固练习):11【提高】《从实验学化学》全章复习与巩固
文档属性
| 名称 | 人教版高中化学必修一教学资料,复习补习资料(巩固练习):11【提高】《从实验学化学》全章复习与巩固 | 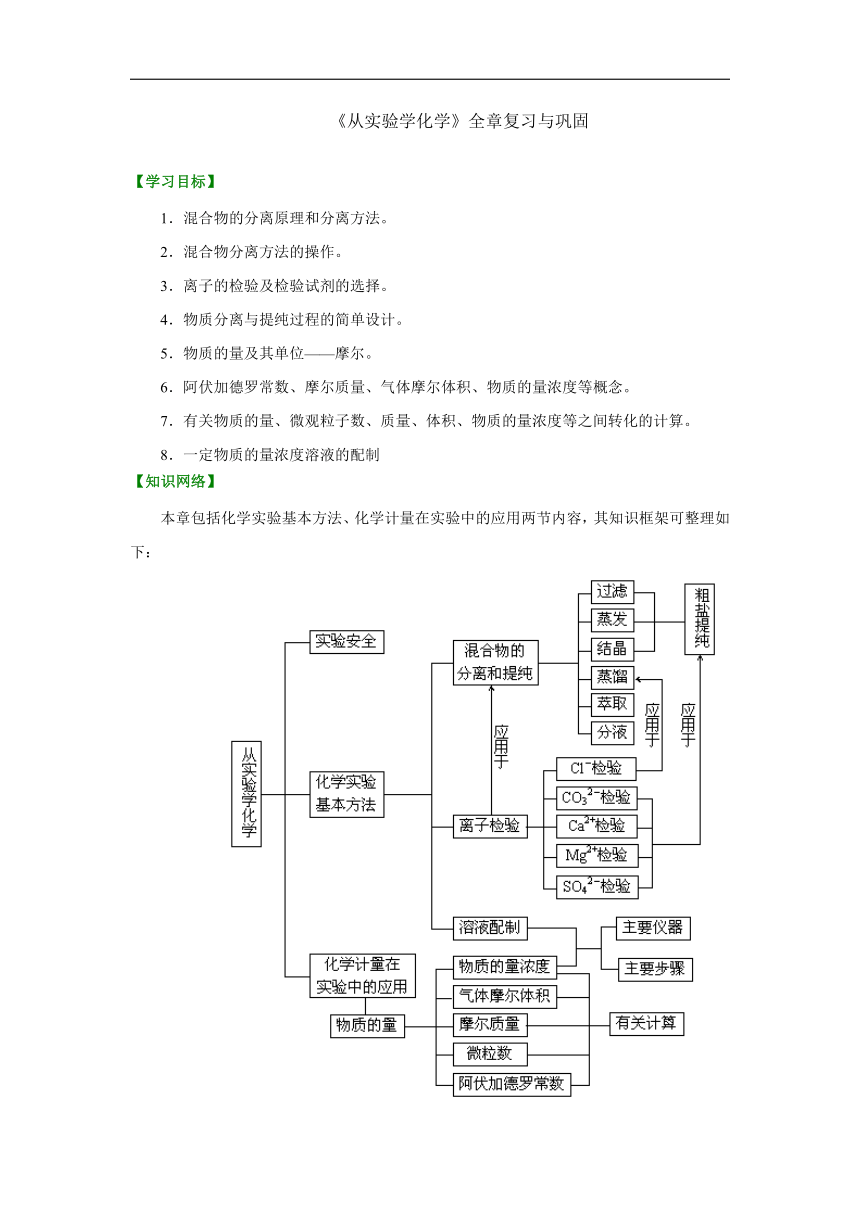 | |
| 格式 | zip | ||
| 文件大小 | 88.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-08 12:02:38 | ||
图片预览





文档简介
《从实验学化学》全章复习与巩固
【学习目标】
1.混合物的分离原理和分离方法。 2.混合物分离方法的操作。 3.离子的检验及检验试剂的选择。 4.物质分离与提纯过程的简单设计。 5.物质的量及其单位——摩尔。 6.阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等概念。 7.有关物质的量、微观粒子数、质量、体积、物质的量浓度等之间转化的计算。 8.一定物质的量浓度溶液的配制
【知识网络】
本章包括化学实验基本方法、化学计量在实验中的应用两节内容,其知识框架可整理如下: /
【巩固练习】
一、 选择题 (每小题有一或二个选项符合题意)
1.瓦斯中甲烷与氧气的质量比为1∶4时极易爆炸,此时甲烷与氧气的体积比为( )。 A.1∶4 B.1∶2 C.1∶1 D.2∶1
2.(2019 江苏启东期中考)运输乙醇或汽油的车辆,贴有的危险化学品标志是( )。
A./ B. / C. / D. /
3.(2019 河南省许昌高中期中考)某无土栽培用的营养液要求KCl、K2SO4、NH4Cl三种固体原料的物质的量之比为1∶4∶8,若用696 g K2SO4配成1 L营养液,关于该营养液的说法正确的是( )。
A.所需KCl和NH4Cl的质量分别为:74.5 g和428 g
B.所配营养液K+的物质的量浓度为8 mol/L
C.若用1000 mL的容量瓶配制,定容时俯视刻度线,所配营养液浓度偏低
D.所用的容量瓶除检查是否漏水外,容量瓶要保持干燥
4.现有三组溶液:①汽油和氯化钠溶液 ②75%的乙醇溶液 ③氯化钠和单质溴的水溶液(分离出溴单质),分离以上各混合液的正确方法依次是( )。 A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
5.要除掉粗盐中含有的氯化镁、硫酸镁等杂质。现设计一个除杂质的方案:把盐溶液溶于水,过滤成澄清溶液,再进行下列各步骤的处理:①加入氯化钡溶液至沉淀完全;②用盐酸调节pH至溶液呈微酸性;③加入NaOH溶液至沉淀完全;④过滤废弃滤出的沉淀;⑤加入碳酸钠溶液至沉淀完全;⑥蒸发浓缩使NaCl晶体析出。对上述各处理步骤的顺序安排合理的是( )。 A.①②③④⑤⑥ B.③①⑤④②⑥ C.②①③④⑤⑥ D.②③⑤④①⑥
6.下列各组溶液,不用其他试剂就可以将它们区别开的是( )。 A.HCl、KOH、K2SO4、K2CO3 B.NaNO3、BaCl2、Na2CO3、NaOH C.BaCl2、CaCl2、Na2SO4、KNO3 D.KOH、K2CO3、MgSO4、H2SO4
7.除去下列溶液中的杂质(括号内的物质),下列做法不正确的是( )。 A.NaCl溶液(BaCl2),加Na2SO4溶液,过滤 B.KNO3溶液(AgNO3),加NaCl溶液,过滤 C.NaCl溶液(I2),加酒精,分液 D.KNO3溶液(I2),加四氯化碳,分液
8.根据阿伏加德罗定律,下列叙述中正确的是( )。 A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于密度之比 C.同温同压下两种气体的摩尔质量之比等于密度之比 D.同温同体积下两种气体的物质的量之比等于压强之比
9.(2019 宁夏银川市育才中学期中考)下列溶液中的氯离子数目、浓度与50 mol 1 mol·L―1的FeCl3溶液中氯离子数目、浓度相等的是( )。
A.50 mL 1.5 mol·L―1的CaCl2溶液
B.100 mL 3 mol·L―1的NH4Cl溶液
C.75 mL 3 mol·L―1的KCl溶液
D.50 mL 2 mol·L―1的FeCl2溶液
10.20℃时,饱和KCl溶液的密度为1.174g·cm―3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是( )。 A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1 B.此溶液中KCl的质量分数为
C.20℃时,密度小于1.174 g·cm―3的KCl溶液是不饱和溶液 D.将此溶液蒸发部分水,再恢复到20℃,溶液密度一定大于1.174 g·cm―3
11.配制250 mL 0.10 mol·L―1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )。 A.转移溶液后未洗涤烧杯和玻璃棒就直接定容 B.在容量瓶中进行定容时仰视刻度线 C.在容量瓶中进行定容时俯视刻度线 D.定容后把容量瓶倒置摇匀,发现液面低于刻度,再补充几滴水至刻度线
12.溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合,混合溶液中H2SO4的质量分数为( )。 A.3a% B.6a% C.>3a% D.<3a%
二 填空题
1.20℃时,在100 g水中溶解11.1 g K2SO4恰好达到饱和,此饱和溶液的密度为1.08 g·cm-3。若将350 mL此温度下K2SO4饱和溶液用水稀释至500 mL。计算稀释后溶液中K2SO4的物质的量浓度。 2.(2019 宁夏大学附中期中考)下列A﹣F中均为分离混合物的一些方法,请用字母分别填空。
A.萃取 B.过滤 C.结晶 D.分液 E.蒸馏
(1)分离饱和食盐水和沙子的混合物 。
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾 。
(3)分离水和煤油的混合物 。
(4)分离水和酒精 。
(5)分离溴水中的溴和水 。
3.实验室用固体烧碱配制500 mL 0.1 mol·L―1的NaOH溶液。 (1)需称量________g的烧碱固体,它应该盛放在________中进行称量。 (2)配制过程中,不需要使用的仪器是(填写代号)________。 A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平 E.药匙 F.500 mL容量瓶 G.胶头滴管 H.漏斗 (3)除上述可使用的仪器,还缺少的仪器是_________,它在实验中的作用为________________。 (4)叙述定容过程中的操作___________________________________________________。 (5)要配制浓度约为2 mol·L―1 NaOH溶液100 mL,下列操作正确的是________。 ①称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解。 ②称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL。 ③称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,塞好瓶塞,反复摇匀。 ④用100 mL量筒量取40 mL 5 mol·L―1 NaOH,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中。 4.有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验: ①将部分粉末加入水中,振荡有白色沉淀生成。 ②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。 ③取少量②的溶液,滴加稀硫酸,有白色沉淀生成。 ④另取少量②的溶液,滴加AgNO3溶液,有白色沉淀生成。 请回答: (1)根据上述实验现象,判断原白色粉末的组成成分是___________(填写名称)。 (2)写出①—④中涉及的化学方程式: ①______________________________ ②_____________________________ ③______________________________ ④_____________________________
【参考答案与解析】
1.B
【解析】在相同条件下(等压等温)气体的体积比等于物质量之比,质量/摩尔质量=物质的量;甲烷的物质的量=1g/16 g/mol=1/16mol;氧气的物质的量=4g/32g/mol=1/8mol;甲烷与氧气的物质的量比是1:2;所以体积比也是1:2。
2.A
【解析】A.乙醇或汽油具有可燃性,属于易燃液体,故A正确;
B.乙醇和汽油不易爆炸,故B错误;
C.乙醇和汽油无腐蚀性,故C错误;
D.乙醇和汽油无氧化性,故D错误。
3.A
【解析】696 g K2SO4的物质的量,KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1∶4∶8,则n(KCl)=1 mol,n(NH4Cl)=8 mol。
A项,则m(KCl)=1 mol×74.5 g/mol=74.5 g,m(NH4Cl)=8 mol×53.5 g/mol=428 g,故A正确;
B项,溶液中n(K+)=n(KCl)+2n(K2SO4)=9 mol,则溶液中K+的物质的量浓度为,故B错误;
C项,定容时俯视刻度线,液面在刻度线下方,所配溶液体积偏小,根据可知,所配溶液浓度偏大,故C错误;
D项,所用的容量瓶需要检查是否漏水,由于需要加水进行定容,容量瓶不干燥对所配溶液浓度无影响,故D错误。
4.C 【解析】本题考查物质分离方法。汽油与氯化钠溶液相互不溶解,可用分液法;分离75%的乙醇溶液应选用蒸馏;从NaCl水溶液中分离出单质溴的方法,可用萃取。 5.B 【解析】本题考查物质的除杂。要除去NaCl中的MgCl2、MgSO4等杂质,需加入NaOH除去Mg2+,加入BaCl2除去SO42-;并且为了保证杂质离子除净,加入试剂应过量,所以需加入Na2CO3除去过量的Ba2+,还需加入适量的盐酸除去过量的CO32-,所以合理顺序为①③⑤④②⑥或③①⑤④②⑥。 6.D 【解析】 本题考查物质的检验。A中四种物质间的反应只有HCl和Na2CO3产生气体,所以无法区别四种物质;B中也只有BaCl2和Na2CO3产生白色沉淀,也无法区别四种物质;C中BaCl2、CaCl2都与Na2SO4产生白色沉淀,可以区别开Na2SO4、KNO3,而BaCl2、CaCl2区别不开;D中KOH、K2CO3与MgSO4分别产生MgCO3、Mg(OH)2白色沉淀,而H2SO4又能与K2CO3产生气体,由此可区别开四种物质。 提示:不用其它试剂的区别题,很显然要用物质间的相互反应,但必须要有明显的现象。
7.B、C 【解析】本题考查物质的除杂和分离加Na2SO4溶液,可使BaCl2转化为BaSO4和NaCl,过滤除去BaSO4即可得到NaCl溶液,A正确;B中加入NaCl溶液使AgNO3转化为AgCl和NaNO3,过滤除去AgCl后,KNO3溶液中会含有NaNO3,B错误;酒精与水互溶,不能作为I2的萃取剂,C错误;四氯化碳将I2萃取出来,分液后可得KNO3溶液,D正确。 提示:除杂原则为:“不增(新杂质)、不减(主要物质)、安全易分离。” 8.C、D 【解析】本题考查阿伏加德罗定律。由/可推知:在同温同压下,对两种气体而言: /,/,所以A、B错误,C正确;在同温同体积下:/,D正确。 提示:学会运用数学公式进行分析,是一种理性思维,可避免大量的枯燥记忆。 9.A
【解析】50 mL 1 mol·L―1的FeCl3溶液中氯离子的物质的量为0.05 L×1 mol/L×3=0.15 mol,氯离子浓度是3 mol/L。
A项,50 mL 1.5 mol·L―1的CaCl2溶液中氯离子物质的量为0.05 L×1.5 mol/L×2=0.15 mol,氯离子浓度是3 mol/L,故A正确;
B项,100 mL 3 mol·L―1的NH4Cl溶液中氯离子物质的量为0.1 L×3 mol/L=0.3 mol,氯离子浓度是3 mol/L,故B错误;
C项,75 mL 3 mol·L―1的KCl溶液中氯离子物质的量为0.075 L×3 mol/L=0.225 mol,氯离子家度是3 mol/L,故C错误;
D项,50 mL 2 mol·L―1的FeCl2溶液中氯离子物质的量为0.05 L×2 mol/L×2=0.2 mol,氯离子浓度是4 mol/L,故D错误。
10.D 【解析】本题考查饱和溶液的理解。25℃时,KCl的溶解度更大,溶质质量分数和溶质物质的量浓度也都增大,A正确;20℃,饱和溶液的密度最大并且保持不变,溶质质量分数、溶质物质的量浓度也都最大且不变,所以C正确,D错误,饱和溶液中溶质质量分数为 /,B正确。 提示:某温度下,某物质的饱和溶液是其最大溶解限度。 11.C 【解析】本题考查溶液配制过程中误差分析。由公式/可以n增大或V减小都可使C偏大。A中
使n减小,B中使V增大,C中使V减小,D中使V增大,所以C的操作会使浓度C偏大。 提示:在容量瓶定容时,不同的视线角度对体积变化如图: / 12.C 【解析】本题考查溶液混合后溶质质量分数的变化。设a%、5a%的H2SO4溶液的密度为/、/, 则可知/,所以两种溶液混合后,溶质的质量分数为 / //。 提示: (1)两种不同质量分数的溶液等体积混合,若溶液的密度大于1 g·cm―3,则混合溶液的质量分数大于它们和的一半;若溶液的密度小于1 g·cm―3,则混合溶液的质量分数小于它们和的一半。 (2)无论溶液的密度大于1 g·cm―3,还是小于1 g·cm―3,等质量混合时,混合溶液的质量分数都等于它们和的一半。
二 填空题
1.【解析】本题考查溶液稀释及物质的量浓度的计算。 11.1 g K2SO4溶液于100 g水中形成K2SO4的饱和溶液。 / / 因此/ 由稀释定律C (稀)·V (稀)=C (浓)·V (浓)知 / 提示:计算数值虽然麻烦,但只要抓住定义表达式细心运算,就可得到正确结果。
2.(1)B(2)C (3)D (4)E (5)A
【解析】(1)食盐水和沙子为固、液混合物,应选择过滤方法分离,故选:B;
(2)硝酸钾和氯化钠溶解度随着温度变化相差很大的两种溶质,应选择结晶法分离,故选:C;
(3)水和煤油互不相溶的两种液体,应选择分液法分离,故选:D;
(4)水和酒精沸点不同,相互溶解的两种液体,应选择蒸馏法分离,故选:E;
(5)溴在水中的溶解度小,在有机物中的溶解度大,可利用萃取法分离,故选A。
3.(1)2.0 小烧杯 (2)C、H (3)玻璃棒 溶解NaOH时,搅拌加速NaOH溶解 转移溶液时,引流,防止液体溅失。 (4)用玻璃棒引流,加蒸馏水至离刻度1~2 cm处,改用胶头滴管逐滴滴加,使溶液凹液面、刻度线、视线相平。 (5)①④ 4.(1)硝酸钡、氯化钙、碳酸钾 (2)①Ba(NO3)2+K2CO3==BaCO3↓+2KNO3 CaCl2+K2CO3==CaCO3↓+2KCl ②BaCO3+2HNO3==Ba(NO3)2+CO2↑+H2O CaCO3+2HNO3==Ca(NO3)2+CO2↑+H2O ③Ba(NO3)2+H2SO4==BaSO4↓+2HNO3 ④KCl+AgNO3==KNO3+AgCl↓ 【解析】本题考查物质的检验。由题中实验的明显实验现象,由①②可推知一定含有K2CO3,Ba(NO3)2、
CaCl2中至少含有一种;由③可推知②的溶液中含有Ba2+,证明原物质含有Ba(NO3)2;由④可推知②的溶液中含有Cl―,证明原物质含有CaCl2,由明显的现象推断出某离子后,还应分析这种离子是原物质中的,还是加入新试剂带入的。
【学习目标】
1.混合物的分离原理和分离方法。 2.混合物分离方法的操作。 3.离子的检验及检验试剂的选择。 4.物质分离与提纯过程的简单设计。 5.物质的量及其单位——摩尔。 6.阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等概念。 7.有关物质的量、微观粒子数、质量、体积、物质的量浓度等之间转化的计算。 8.一定物质的量浓度溶液的配制
【知识网络】
本章包括化学实验基本方法、化学计量在实验中的应用两节内容,其知识框架可整理如下: /
【巩固练习】
一、 选择题 (每小题有一或二个选项符合题意)
1.瓦斯中甲烷与氧气的质量比为1∶4时极易爆炸,此时甲烷与氧气的体积比为( )。 A.1∶4 B.1∶2 C.1∶1 D.2∶1
2.(2019 江苏启东期中考)运输乙醇或汽油的车辆,贴有的危险化学品标志是( )。
A./ B. / C. / D. /
3.(2019 河南省许昌高中期中考)某无土栽培用的营养液要求KCl、K2SO4、NH4Cl三种固体原料的物质的量之比为1∶4∶8,若用696 g K2SO4配成1 L营养液,关于该营养液的说法正确的是( )。
A.所需KCl和NH4Cl的质量分别为:74.5 g和428 g
B.所配营养液K+的物质的量浓度为8 mol/L
C.若用1000 mL的容量瓶配制,定容时俯视刻度线,所配营养液浓度偏低
D.所用的容量瓶除检查是否漏水外,容量瓶要保持干燥
4.现有三组溶液:①汽油和氯化钠溶液 ②75%的乙醇溶液 ③氯化钠和单质溴的水溶液(分离出溴单质),分离以上各混合液的正确方法依次是( )。 A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
5.要除掉粗盐中含有的氯化镁、硫酸镁等杂质。现设计一个除杂质的方案:把盐溶液溶于水,过滤成澄清溶液,再进行下列各步骤的处理:①加入氯化钡溶液至沉淀完全;②用盐酸调节pH至溶液呈微酸性;③加入NaOH溶液至沉淀完全;④过滤废弃滤出的沉淀;⑤加入碳酸钠溶液至沉淀完全;⑥蒸发浓缩使NaCl晶体析出。对上述各处理步骤的顺序安排合理的是( )。 A.①②③④⑤⑥ B.③①⑤④②⑥ C.②①③④⑤⑥ D.②③⑤④①⑥
6.下列各组溶液,不用其他试剂就可以将它们区别开的是( )。 A.HCl、KOH、K2SO4、K2CO3 B.NaNO3、BaCl2、Na2CO3、NaOH C.BaCl2、CaCl2、Na2SO4、KNO3 D.KOH、K2CO3、MgSO4、H2SO4
7.除去下列溶液中的杂质(括号内的物质),下列做法不正确的是( )。 A.NaCl溶液(BaCl2),加Na2SO4溶液,过滤 B.KNO3溶液(AgNO3),加NaCl溶液,过滤 C.NaCl溶液(I2),加酒精,分液 D.KNO3溶液(I2),加四氯化碳,分液
8.根据阿伏加德罗定律,下列叙述中正确的是( )。 A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于密度之比 C.同温同压下两种气体的摩尔质量之比等于密度之比 D.同温同体积下两种气体的物质的量之比等于压强之比
9.(2019 宁夏银川市育才中学期中考)下列溶液中的氯离子数目、浓度与50 mol 1 mol·L―1的FeCl3溶液中氯离子数目、浓度相等的是( )。
A.50 mL 1.5 mol·L―1的CaCl2溶液
B.100 mL 3 mol·L―1的NH4Cl溶液
C.75 mL 3 mol·L―1的KCl溶液
D.50 mL 2 mol·L―1的FeCl2溶液
10.20℃时,饱和KCl溶液的密度为1.174g·cm―3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是( )。 A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1 B.此溶液中KCl的质量分数为
C.20℃时,密度小于1.174 g·cm―3的KCl溶液是不饱和溶液 D.将此溶液蒸发部分水,再恢复到20℃,溶液密度一定大于1.174 g·cm―3
11.配制250 mL 0.10 mol·L―1的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )。 A.转移溶液后未洗涤烧杯和玻璃棒就直接定容 B.在容量瓶中进行定容时仰视刻度线 C.在容量瓶中进行定容时俯视刻度线 D.定容后把容量瓶倒置摇匀,发现液面低于刻度,再补充几滴水至刻度线
12.溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合,混合溶液中H2SO4的质量分数为( )。 A.3a% B.6a% C.>3a% D.<3a%
二 填空题
1.20℃时,在100 g水中溶解11.1 g K2SO4恰好达到饱和,此饱和溶液的密度为1.08 g·cm-3。若将350 mL此温度下K2SO4饱和溶液用水稀释至500 mL。计算稀释后溶液中K2SO4的物质的量浓度。 2.(2019 宁夏大学附中期中考)下列A﹣F中均为分离混合物的一些方法,请用字母分别填空。
A.萃取 B.过滤 C.结晶 D.分液 E.蒸馏
(1)分离饱和食盐水和沙子的混合物 。
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾 。
(3)分离水和煤油的混合物 。
(4)分离水和酒精 。
(5)分离溴水中的溴和水 。
3.实验室用固体烧碱配制500 mL 0.1 mol·L―1的NaOH溶液。 (1)需称量________g的烧碱固体,它应该盛放在________中进行称量。 (2)配制过程中,不需要使用的仪器是(填写代号)________。 A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平 E.药匙 F.500 mL容量瓶 G.胶头滴管 H.漏斗 (3)除上述可使用的仪器,还缺少的仪器是_________,它在实验中的作用为________________。 (4)叙述定容过程中的操作___________________________________________________。 (5)要配制浓度约为2 mol·L―1 NaOH溶液100 mL,下列操作正确的是________。 ①称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解。 ②称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL。 ③称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,塞好瓶塞,反复摇匀。 ④用100 mL量筒量取40 mL 5 mol·L―1 NaOH,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中。 4.有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验: ①将部分粉末加入水中,振荡有白色沉淀生成。 ②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生。 ③取少量②的溶液,滴加稀硫酸,有白色沉淀生成。 ④另取少量②的溶液,滴加AgNO3溶液,有白色沉淀生成。 请回答: (1)根据上述实验现象,判断原白色粉末的组成成分是___________(填写名称)。 (2)写出①—④中涉及的化学方程式: ①______________________________ ②_____________________________ ③______________________________ ④_____________________________
【参考答案与解析】
1.B
【解析】在相同条件下(等压等温)气体的体积比等于物质量之比,质量/摩尔质量=物质的量;甲烷的物质的量=1g/16 g/mol=1/16mol;氧气的物质的量=4g/32g/mol=1/8mol;甲烷与氧气的物质的量比是1:2;所以体积比也是1:2。
2.A
【解析】A.乙醇或汽油具有可燃性,属于易燃液体,故A正确;
B.乙醇和汽油不易爆炸,故B错误;
C.乙醇和汽油无腐蚀性,故C错误;
D.乙醇和汽油无氧化性,故D错误。
3.A
【解析】696 g K2SO4的物质的量,KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1∶4∶8,则n(KCl)=1 mol,n(NH4Cl)=8 mol。
A项,则m(KCl)=1 mol×74.5 g/mol=74.5 g,m(NH4Cl)=8 mol×53.5 g/mol=428 g,故A正确;
B项,溶液中n(K+)=n(KCl)+2n(K2SO4)=9 mol,则溶液中K+的物质的量浓度为,故B错误;
C项,定容时俯视刻度线,液面在刻度线下方,所配溶液体积偏小,根据可知,所配溶液浓度偏大,故C错误;
D项,所用的容量瓶需要检查是否漏水,由于需要加水进行定容,容量瓶不干燥对所配溶液浓度无影响,故D错误。
4.C 【解析】本题考查物质分离方法。汽油与氯化钠溶液相互不溶解,可用分液法;分离75%的乙醇溶液应选用蒸馏;从NaCl水溶液中分离出单质溴的方法,可用萃取。 5.B 【解析】本题考查物质的除杂。要除去NaCl中的MgCl2、MgSO4等杂质,需加入NaOH除去Mg2+,加入BaCl2除去SO42-;并且为了保证杂质离子除净,加入试剂应过量,所以需加入Na2CO3除去过量的Ba2+,还需加入适量的盐酸除去过量的CO32-,所以合理顺序为①③⑤④②⑥或③①⑤④②⑥。 6.D 【解析】 本题考查物质的检验。A中四种物质间的反应只有HCl和Na2CO3产生气体,所以无法区别四种物质;B中也只有BaCl2和Na2CO3产生白色沉淀,也无法区别四种物质;C中BaCl2、CaCl2都与Na2SO4产生白色沉淀,可以区别开Na2SO4、KNO3,而BaCl2、CaCl2区别不开;D中KOH、K2CO3与MgSO4分别产生MgCO3、Mg(OH)2白色沉淀,而H2SO4又能与K2CO3产生气体,由此可区别开四种物质。 提示:不用其它试剂的区别题,很显然要用物质间的相互反应,但必须要有明显的现象。
7.B、C 【解析】本题考查物质的除杂和分离加Na2SO4溶液,可使BaCl2转化为BaSO4和NaCl,过滤除去BaSO4即可得到NaCl溶液,A正确;B中加入NaCl溶液使AgNO3转化为AgCl和NaNO3,过滤除去AgCl后,KNO3溶液中会含有NaNO3,B错误;酒精与水互溶,不能作为I2的萃取剂,C错误;四氯化碳将I2萃取出来,分液后可得KNO3溶液,D正确。 提示:除杂原则为:“不增(新杂质)、不减(主要物质)、安全易分离。” 8.C、D 【解析】本题考查阿伏加德罗定律。由/可推知:在同温同压下,对两种气体而言: /,/,所以A、B错误,C正确;在同温同体积下:/,D正确。 提示:学会运用数学公式进行分析,是一种理性思维,可避免大量的枯燥记忆。 9.A
【解析】50 mL 1 mol·L―1的FeCl3溶液中氯离子的物质的量为0.05 L×1 mol/L×3=0.15 mol,氯离子浓度是3 mol/L。
A项,50 mL 1.5 mol·L―1的CaCl2溶液中氯离子物质的量为0.05 L×1.5 mol/L×2=0.15 mol,氯离子浓度是3 mol/L,故A正确;
B项,100 mL 3 mol·L―1的NH4Cl溶液中氯离子物质的量为0.1 L×3 mol/L=0.3 mol,氯离子浓度是3 mol/L,故B错误;
C项,75 mL 3 mol·L―1的KCl溶液中氯离子物质的量为0.075 L×3 mol/L=0.225 mol,氯离子家度是3 mol/L,故C错误;
D项,50 mL 2 mol·L―1的FeCl2溶液中氯离子物质的量为0.05 L×2 mol/L×2=0.2 mol,氯离子浓度是4 mol/L,故D错误。
10.D 【解析】本题考查饱和溶液的理解。25℃时,KCl的溶解度更大,溶质质量分数和溶质物质的量浓度也都增大,A正确;20℃,饱和溶液的密度最大并且保持不变,溶质质量分数、溶质物质的量浓度也都最大且不变,所以C正确,D错误,饱和溶液中溶质质量分数为 /,B正确。 提示:某温度下,某物质的饱和溶液是其最大溶解限度。 11.C 【解析】本题考查溶液配制过程中误差分析。由公式/可以n增大或V减小都可使C偏大。A中
使n减小,B中使V增大,C中使V减小,D中使V增大,所以C的操作会使浓度C偏大。 提示:在容量瓶定容时,不同的视线角度对体积变化如图: / 12.C 【解析】本题考查溶液混合后溶质质量分数的变化。设a%、5a%的H2SO4溶液的密度为/、/, 则可知/,所以两种溶液混合后,溶质的质量分数为 / //。 提示: (1)两种不同质量分数的溶液等体积混合,若溶液的密度大于1 g·cm―3,则混合溶液的质量分数大于它们和的一半;若溶液的密度小于1 g·cm―3,则混合溶液的质量分数小于它们和的一半。 (2)无论溶液的密度大于1 g·cm―3,还是小于1 g·cm―3,等质量混合时,混合溶液的质量分数都等于它们和的一半。
二 填空题
1.【解析】本题考查溶液稀释及物质的量浓度的计算。 11.1 g K2SO4溶液于100 g水中形成K2SO4的饱和溶液。 / / 因此/ 由稀释定律C (稀)·V (稀)=C (浓)·V (浓)知 / 提示:计算数值虽然麻烦,但只要抓住定义表达式细心运算,就可得到正确结果。
2.(1)B(2)C (3)D (4)E (5)A
【解析】(1)食盐水和沙子为固、液混合物,应选择过滤方法分离,故选:B;
(2)硝酸钾和氯化钠溶解度随着温度变化相差很大的两种溶质,应选择结晶法分离,故选:C;
(3)水和煤油互不相溶的两种液体,应选择分液法分离,故选:D;
(4)水和酒精沸点不同,相互溶解的两种液体,应选择蒸馏法分离,故选:E;
(5)溴在水中的溶解度小,在有机物中的溶解度大,可利用萃取法分离,故选A。
3.(1)2.0 小烧杯 (2)C、H (3)玻璃棒 溶解NaOH时,搅拌加速NaOH溶解 转移溶液时,引流,防止液体溅失。 (4)用玻璃棒引流,加蒸馏水至离刻度1~2 cm处,改用胶头滴管逐滴滴加,使溶液凹液面、刻度线、视线相平。 (5)①④ 4.(1)硝酸钡、氯化钙、碳酸钾 (2)①Ba(NO3)2+K2CO3==BaCO3↓+2KNO3 CaCl2+K2CO3==CaCO3↓+2KCl ②BaCO3+2HNO3==Ba(NO3)2+CO2↑+H2O CaCO3+2HNO3==Ca(NO3)2+CO2↑+H2O ③Ba(NO3)2+H2SO4==BaSO4↓+2HNO3 ④KCl+AgNO3==KNO3+AgCl↓ 【解析】本题考查物质的检验。由题中实验的明显实验现象,由①②可推知一定含有K2CO3,Ba(NO3)2、
CaCl2中至少含有一种;由③可推知②的溶液中含有Ba2+,证明原物质含有Ba(NO3)2;由④可推知②的溶液中含有Cl―,证明原物质含有CaCl2,由明显的现象推断出某离子后,还应分析这种离子是原物质中的,还是加入新试剂带入的。
