苏教版化学必修1专题4 硫、氮和可持续发展第一单元 含硫化合物的性质和应用 (课件28张ppt)
文档属性
| 名称 | 苏教版化学必修1专题4 硫、氮和可持续发展第一单元 含硫化合物的性质和应用 (课件28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-08 15:57:25 | ||
图片预览








文档简介
(共29张PPT)
硫酸的制备和性质
本节重点
浓硫酸的性质
本节难点
浓硫酸的强氧化性
学前导入
硫酸是当今世界上最重要的化工产品之一,其产量是衡量一个国家化工生产水平的标志。早在一千多年前我国就已经采用加热胆矾或绿矾的方法制取硫酸。
学前导入
公元650~683年(唐高宗时),炼丹家孤刚子在《黄帝九鼎神丹经诀》中记载“炼石胆取精华”,即加热胆矾制硫酸。
CuSO4·5H2O CuSO4+5H2O
CuSO4 CuO+SO3↑
SO3+H2O H2SO4
△
高温
学前导入
FeSO4·7H2O FeSO4+7H2O
△
8世纪阿拉伯炼金家贾比尔发现,加热绿矾,所得气体溶于水得硫酸。
那么目前工业上是用什么方法制硫酸的呢?
2FeSO4 Fe2O3+SO2↑+SO3↑
高温
接触法制硫酸
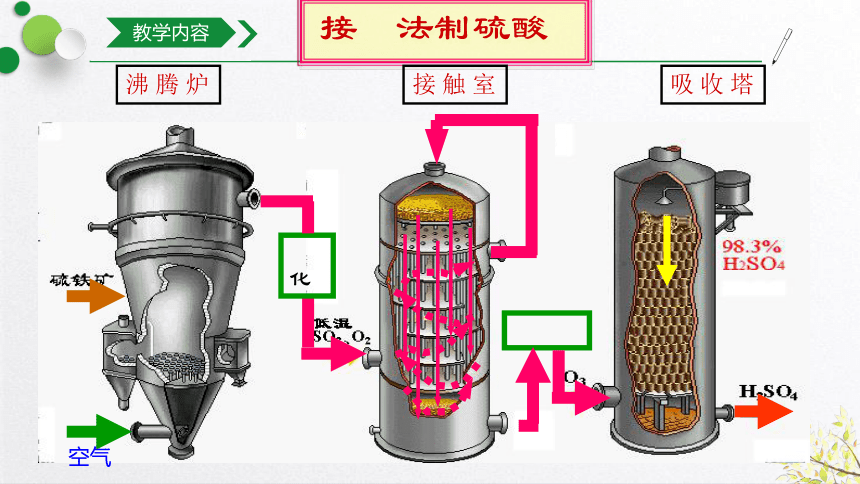
教学内容
制取硫酸流程
H2SO4
SO3
SO2
S
FeS2
H2O
O2
O2
O2
V2O5
第一步:
第三步:
第二步:
4FeS2+11O2 2Fe2O3+8SO2
高温
2SO2+O2 2SO3
催化剂
△
SO3 + H2O = H2SO4
造气
接触氧化
SO3的吸收
一、接触法制硫酸
教学内容
接触法制硫酸
沸 腾 炉
接 触 室
吸 收 塔
净化
冷 却
空气
教学内容
2.如何处理尾气?
2NH3 + H2O + SO2 = (NH4)2SO3
氨水吸收
(NH4)2SO3 + H2SO4 = (NH4)2SO4 +H2O + SO2↑
化肥
循环利用
1.为什么不用水而用浓硫酸来吸收SO3?
三氧化硫与水反应放出大量热,直接用水吸收三氧化硫易形成酸雾,而不利于三氧化硫的吸收,因此,用98.3%的浓硫酸。
教学内容
工业生产得到的硫酸一般都是质量分数较高的发烟硫酸。在实际应用中,人们常根据需要,把浓硫酸稀释成不同浓度的稀硫酸。
教学内容
(1)使指示剂变色:
(2)与活泼金属反应放出氢气
(3)与碱发生中和反应:
(4)与碱性氧化物反应:
(5)与某些盐反应:
使紫色石蕊试液变红
H++ OH -= H2O
2H++ CuO = Cu2++ H2O
2H++ CO32- = H2O + CO2↑
H2SO4=2H++SO42-
具有酸的通性
1、稀硫酸
二、硫酸
教学内容
2、浓硫酸
(1)浓H2SO4的物理性质
色、态:无色、粘稠的油状液体
沸点:约338℃——难挥发酸(高沸点酸)
密度:1.84g/cm3——高密度酸
溶解性:跟水任意比互溶,溶解放出大量热
用于制易挥发
酸,如盐酸。
教学内容
稀释浓硫酸时应该如何操作?
“酸入水, 沿杯壁,
慢慢注, 及时搅”
入水中, 并用玻璃棒及时搅拌。
将浓硫酸沿烧杯内壁慢慢注
正确操作:
教学内容
① 吸水性
浓硫酸吸收物质本来就有的水,直接与水分子结合
(2) 浓硫酸的特性
浓硫酸
稀硫酸
现象:浓硫酸使蓝色晶体变为白色(变淡)
CuSO4·5H2O
蓝色
浓H2SO4
CuSO4
白色
教学内容
① 吸水性
用途:可以作干燥剂
(2) 浓硫酸的特性
不能干燥
碱性气体:NH3
常温下具有强还原性的气体:H2S HBr、HI等
教学内容
② 脱水性
浓硫酸能把有机物中的氢、氧原子按2:1(H2O)的个数比脱去。
【实验】取10g蔗糖放入小烧杯中,加入几滴水,用玻璃棒搅拌均匀,再加入10mL浓硫酸,并用玻璃棒迅速搅拌。观察物质的颜色、体积变化并闻味。
教学内容
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C== CO2 + 2H2O + 2SO2
脱水性
氧化性
△
教学内容
a、 与某些非金属反应
C + 2H2SO4 (浓) = CO2 +2SO2 + 2H2O
△
设计一实验,证明浓硫酸与碳反应的生成物含有水、二氧化硫和二氧化碳 。
思考题
③浓硫酸强氧化性
教学内容
KMnO4
澄清石灰水
品红
无水硫酸铜
a
b
c
d
e
f
g
h
i
教学内容
品红溶液
澄清石灰水
品红溶液
KMnO4溶液
浓硫酸除了与C反应外还可以与S、P等大多数非金属单质反应:
S + 2H2SO4 (浓) = 3SO2 + 2H2O
△
2P + 5H2SO4 (浓) = 2H2PO4 + 5SO2 + 2H2O
△
教学内容
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与Fe、Al反应。
b、与金属反应
加热时,大多数金属( Pt和Au除外)都能被浓硫酸氧化。
运硫酸的铁罐车
教学内容
在试管中放入
一块铜片,加入
少量的浓硫酸,
加热。通入品红
溶液,检验放出
的气体;再通入
紫色的石蕊溶液;
把反应后的溶
液倒在水中稀释。
实 验
现象:
加热能反应,产生的气体能使品红褪色,使石蕊溶液变红;溶液稀释后呈蓝色。
b、与金属反应
浸有碱液的棉团的作用:吸收多余的SO2,防止污染环境
品红溶液
石蕊溶液
教学内容
浓硫酸既表现氧化性又表现酸性
Cu + 2H2SO4(浓) = CuSO4 + SO2 + 2H2O
△
练习1.将3mol Cu加入到含有2mol H2SO4的浓硫酸中并加热,充分反应。
(1)硫酸能反应完吗?
(2)产生的SO2的物质的量 1mol(填“大于”、“等于”或“小于”)
不能
小于
随堂练习
思考:如何区分浓硫酸和稀硫酸?
6、投入胆矾晶体看颜色变化。(吸水性)
1、溶解放热。
2、观察状态。(看粘稠度)
3、取体积大小相同的两瓶试液,称取质量。
4、钝化。(投入铁片看是否有气体)
5、玻璃棒写字。(脱水性)
7、加铜片加热看是否有气泡。
教学内容
3、硫酸的用途:
硫酸是世界上用量最大、用途最广的基本化工原料之一,其产量的多少是衡量一个国家化学工业发达水平的标准,素有“化学工业之母”之称。
随堂练习
① 浓硫酸常温使纸片变黑: ;
② 浓硫酸与铜共热产生气体: ;
③ 浓硫酸使蔗糖变成“黑面包”: ;
④ 浓硫酸常温下使铁铝钝化: ;
⑤ 浓硫酸使胆矾变成白色粉末: ;
D
B E
CDE
E
C
练习2.硫酸在下列用途或现象中所表现的性质是:A.高沸点 B. 酸性 C.吸水性 D.脱水性 E.强氧化性
板书设计
一、接触法制硫酸
硫酸的制备和性质
1、稀硫酸
二、硫酸
2、浓硫酸
(1)浓硫酸的物理性质
(2)浓硫酸的特性
① 吸水性
② 脱水性
3、硫酸的用途
③浓硫酸强氧化性
归纳小结
本节课重点介绍了浓硫酸的三大特性:吸水性、脱水性、强氧化性。吸水性的关键是看物质中是否有现成的水或结晶水,脱水性的关键不是物质中有现成的水或结晶水,而是有氢和氧并按照水分子中氢和氧的比例关系脱去,强氧化性是指+6价的硫化合价降低得到相应的还原产物。
课后作业
作业:《课时作业》P36-37
硫酸的制备和性质
本节重点
浓硫酸的性质
本节难点
浓硫酸的强氧化性
学前导入
硫酸是当今世界上最重要的化工产品之一,其产量是衡量一个国家化工生产水平的标志。早在一千多年前我国就已经采用加热胆矾或绿矾的方法制取硫酸。
学前导入
公元650~683年(唐高宗时),炼丹家孤刚子在《黄帝九鼎神丹经诀》中记载“炼石胆取精华”,即加热胆矾制硫酸。
CuSO4·5H2O CuSO4+5H2O
CuSO4 CuO+SO3↑
SO3+H2O H2SO4
△
高温
学前导入
FeSO4·7H2O FeSO4+7H2O
△
8世纪阿拉伯炼金家贾比尔发现,加热绿矾,所得气体溶于水得硫酸。
那么目前工业上是用什么方法制硫酸的呢?
2FeSO4 Fe2O3+SO2↑+SO3↑
高温
接触法制硫酸
教学内容
制取硫酸流程
H2SO4
SO3
SO2
S
FeS2
H2O
O2
O2
O2
V2O5
第一步:
第三步:
第二步:
4FeS2+11O2 2Fe2O3+8SO2
高温
2SO2+O2 2SO3
催化剂
△
SO3 + H2O = H2SO4
造气
接触氧化
SO3的吸收
一、接触法制硫酸
教学内容
接触法制硫酸
沸 腾 炉
接 触 室
吸 收 塔
净化
冷 却
空气
教学内容
2.如何处理尾气?
2NH3 + H2O + SO2 = (NH4)2SO3
氨水吸收
(NH4)2SO3 + H2SO4 = (NH4)2SO4 +H2O + SO2↑
化肥
循环利用
1.为什么不用水而用浓硫酸来吸收SO3?
三氧化硫与水反应放出大量热,直接用水吸收三氧化硫易形成酸雾,而不利于三氧化硫的吸收,因此,用98.3%的浓硫酸。
教学内容
工业生产得到的硫酸一般都是质量分数较高的发烟硫酸。在实际应用中,人们常根据需要,把浓硫酸稀释成不同浓度的稀硫酸。
教学内容
(1)使指示剂变色:
(2)与活泼金属反应放出氢气
(3)与碱发生中和反应:
(4)与碱性氧化物反应:
(5)与某些盐反应:
使紫色石蕊试液变红
H++ OH -= H2O
2H++ CuO = Cu2++ H2O
2H++ CO32- = H2O + CO2↑
H2SO4=2H++SO42-
具有酸的通性
1、稀硫酸
二、硫酸
教学内容
2、浓硫酸
(1)浓H2SO4的物理性质
色、态:无色、粘稠的油状液体
沸点:约338℃——难挥发酸(高沸点酸)
密度:1.84g/cm3——高密度酸
溶解性:跟水任意比互溶,溶解放出大量热
用于制易挥发
酸,如盐酸。
教学内容
稀释浓硫酸时应该如何操作?
“酸入水, 沿杯壁,
慢慢注, 及时搅”
入水中, 并用玻璃棒及时搅拌。
将浓硫酸沿烧杯内壁慢慢注
正确操作:
教学内容
① 吸水性
浓硫酸吸收物质本来就有的水,直接与水分子结合
(2) 浓硫酸的特性
浓硫酸
稀硫酸
现象:浓硫酸使蓝色晶体变为白色(变淡)
CuSO4·5H2O
蓝色
浓H2SO4
CuSO4
白色
教学内容
① 吸水性
用途:可以作干燥剂
(2) 浓硫酸的特性
不能干燥
碱性气体:NH3
常温下具有强还原性的气体:H2S HBr、HI等
教学内容
② 脱水性
浓硫酸能把有机物中的氢、氧原子按2:1(H2O)的个数比脱去。
【实验】取10g蔗糖放入小烧杯中,加入几滴水,用玻璃棒搅拌均匀,再加入10mL浓硫酸,并用玻璃棒迅速搅拌。观察物质的颜色、体积变化并闻味。
教学内容
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
C12H22O11 12C + 11H2O
浓硫酸
2H2SO4 (浓) + C== CO2 + 2H2O + 2SO2
脱水性
氧化性
△
教学内容
a、 与某些非金属反应
C + 2H2SO4 (浓) = CO2 +2SO2 + 2H2O
△
设计一实验,证明浓硫酸与碳反应的生成物含有水、二氧化硫和二氧化碳 。
思考题
③浓硫酸强氧化性
教学内容
KMnO4
澄清石灰水
品红
无水硫酸铜
a
b
c
d
e
f
g
h
i
教学内容
品红溶液
澄清石灰水
品红溶液
KMnO4溶液
浓硫酸除了与C反应外还可以与S、P等大多数非金属单质反应:
S + 2H2SO4 (浓) = 3SO2 + 2H2O
△
2P + 5H2SO4 (浓) = 2H2PO4 + 5SO2 + 2H2O
△
教学内容
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与Fe、Al反应。
b、与金属反应
加热时,大多数金属( Pt和Au除外)都能被浓硫酸氧化。
运硫酸的铁罐车
教学内容
在试管中放入
一块铜片,加入
少量的浓硫酸,
加热。通入品红
溶液,检验放出
的气体;再通入
紫色的石蕊溶液;
把反应后的溶
液倒在水中稀释。
实 验
现象:
加热能反应,产生的气体能使品红褪色,使石蕊溶液变红;溶液稀释后呈蓝色。
b、与金属反应
浸有碱液的棉团的作用:吸收多余的SO2,防止污染环境
品红溶液
石蕊溶液
教学内容
浓硫酸既表现氧化性又表现酸性
Cu + 2H2SO4(浓) = CuSO4 + SO2 + 2H2O
△
练习1.将3mol Cu加入到含有2mol H2SO4的浓硫酸中并加热,充分反应。
(1)硫酸能反应完吗?
(2)产生的SO2的物质的量 1mol(填“大于”、“等于”或“小于”)
不能
小于
随堂练习
思考:如何区分浓硫酸和稀硫酸?
6、投入胆矾晶体看颜色变化。(吸水性)
1、溶解放热。
2、观察状态。(看粘稠度)
3、取体积大小相同的两瓶试液,称取质量。
4、钝化。(投入铁片看是否有气体)
5、玻璃棒写字。(脱水性)
7、加铜片加热看是否有气泡。
教学内容
3、硫酸的用途:
硫酸是世界上用量最大、用途最广的基本化工原料之一,其产量的多少是衡量一个国家化学工业发达水平的标准,素有“化学工业之母”之称。
随堂练习
① 浓硫酸常温使纸片变黑: ;
② 浓硫酸与铜共热产生气体: ;
③ 浓硫酸使蔗糖变成“黑面包”: ;
④ 浓硫酸常温下使铁铝钝化: ;
⑤ 浓硫酸使胆矾变成白色粉末: ;
D
B E
CDE
E
C
练习2.硫酸在下列用途或现象中所表现的性质是:A.高沸点 B. 酸性 C.吸水性 D.脱水性 E.强氧化性
板书设计
一、接触法制硫酸
硫酸的制备和性质
1、稀硫酸
二、硫酸
2、浓硫酸
(1)浓硫酸的物理性质
(2)浓硫酸的特性
① 吸水性
② 脱水性
3、硫酸的用途
③浓硫酸强氧化性
归纳小结
本节课重点介绍了浓硫酸的三大特性:吸水性、脱水性、强氧化性。吸水性的关键是看物质中是否有现成的水或结晶水,脱水性的关键不是物质中有现成的水或结晶水,而是有氢和氧并按照水分子中氢和氧的比例关系脱去,强氧化性是指+6价的硫化合价降低得到相应的还原产物。
课后作业
作业:《课时作业》P36-37
