第1节 金属的性质和利用 :铁的氧化与还原 ——含铁物质的定量分析 (17张PPT)
文档属性
| 名称 | 第1节 金属的性质和利用 :铁的氧化与还原 ——含铁物质的定量分析 (17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-07 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
铁的氧化与还原
——含铁物质的定量分析
思考:铁会和哪些物质发生反应呢?
我们如何从自然界中获得铁呢?
温故知新
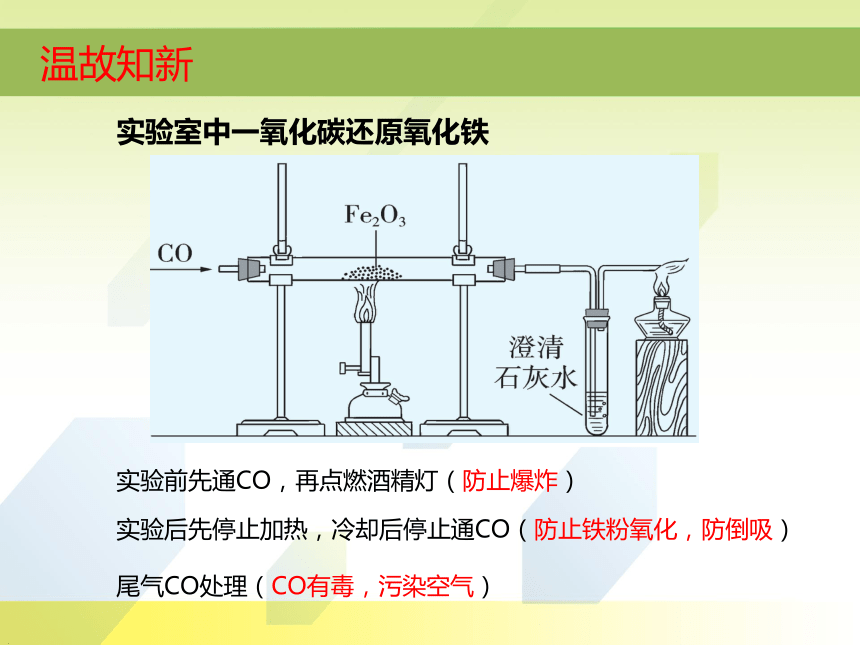
实验室中一氧化碳还原氧化铁
温故知新
实验前先通CO,再点燃酒精灯(防止爆炸)
实验后先停止加热,冷却后停止通CO(防止铁粉氧化,防倒吸)
尾气CO处理(CO有毒,污染空气)
1.铁的常见氧化物有哪些?
含铁量:FeO > Fe3O4 > Fe2O3
含氧量:Fe2O3 > Fe3O4 > FeO
分析与思考
2.将2.32克铁的氧化物在高温下用CO充分反应,得到1.76克CO2,则该铁的氧化物的化学式应该是( )
A.Fe2O3 B.Fe3O4 C.FeO D.无法确定
分析与思考
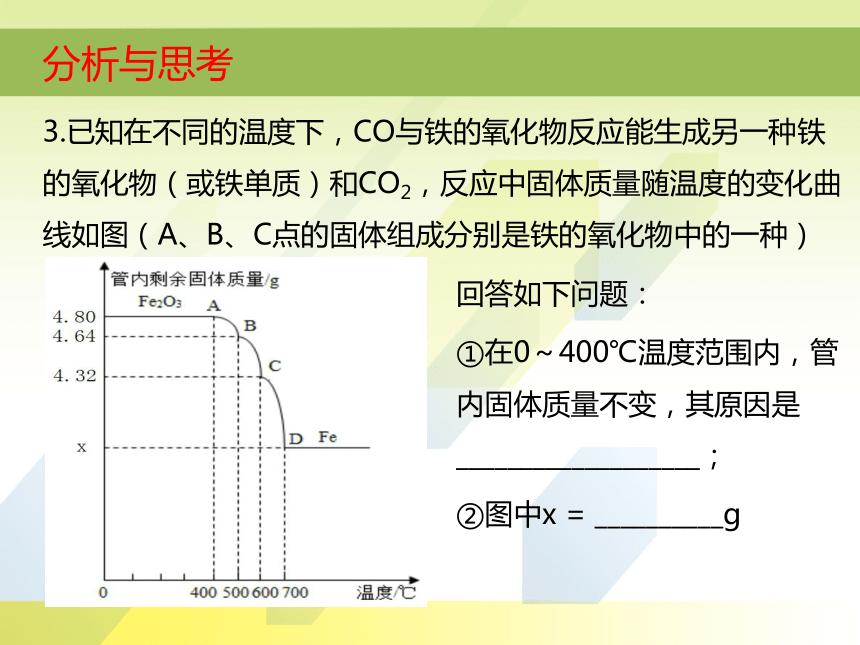
3.已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2,反应中固体质量随温度的变化曲线如图(A、B、C点的固体组成分别是铁的氧化物中的一种)
回答如下问题:
①在0~400℃温度范围内,管内固体质量不变,其原因是___________________;
②图中x = __________g
分析与思考
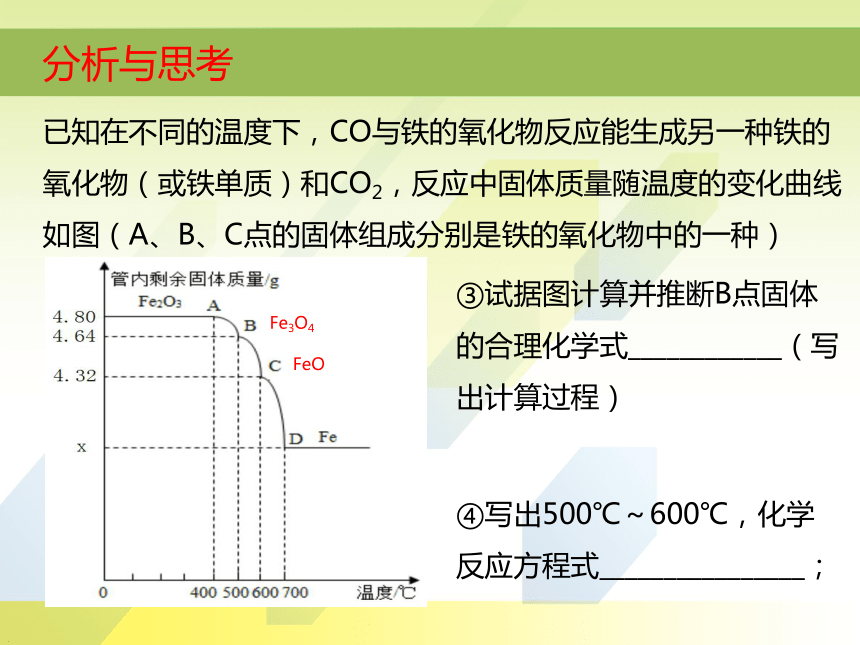
已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2,反应中固体质量随温度的变化曲线如图(A、B、C点的固体组成分别是铁的氧化物中的一种)
③试据图计算并推断B点固体的合理化学式____________(写出计算过程)
④写出500℃~600℃,化学反应方程式________________;
分析与思考
FeO
Fe3O4
已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2,反应中固体质量随温度的变化曲线如图(A、B、C点的固体组成分别是铁的氧化物中的一种)
⑤反应一段时间后,剩余固体质量为4.00g(含2种物质),写出2种物质的名称及质量为__________________。
分析与思考
4.00
3.32
FeO
Fe3O4
4.取25g足量的稀硫酸,加入到装有铁粉和铜粉的混合物共5g的烧杯中,用玻璃棒搅拌,充分反应后,过滤,得到滤液质量共27.7g,则混合物中铁粉的质量分数为 ( )
A.44% B.46% C.56% D.64%
练习与巩固
练习与巩固
5.为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(1)实验开始前,连接好仪器并______________________.
(2)实验中观察到 A 中的现象是_____________________________;
请指出该装置中有一处明显不足__________________________;
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
反应前(g) 反应后(g)
B 100 105.4
C 150 163.2
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(3)装置 C 的作用是___________________________.
装置 B 和 C 是否可以颠倒?________(填“是”或“否”).
写出 T3~T4 时间段发生的化学方程式____________________.
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(4)n 的值为___________
(写出计算过程).
反应前(g) 反应后(g)
B 100 105.4
C 150 163.2
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(4) 若没有装置 D,则 n 的值将___________
(填“偏大”或“偏小”或“无 影响”).
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(5)关系图中 m 的值为___________.
练习与巩固
一、铁的氧化
Fe → FexOy
(1)燃烧
(2)缓慢氧化(生锈,铁锈主要成分Fe2O3?nH2O)
二、铁的还原
FexOy → Fe
三、定量分析铁的氧化与还原
(固体中铁元素守恒,氧元素质量变化)
3Fe + 2O2 === Fe3O4
点燃
课堂总结
渺小的量变可积累惊人的质变,平凡的脚步可以丈量遥远的旅途。
结束语
Thanks
铁的氧化与还原
——含铁物质的定量分析
思考:铁会和哪些物质发生反应呢?
我们如何从自然界中获得铁呢?
温故知新
实验室中一氧化碳还原氧化铁
温故知新
实验前先通CO,再点燃酒精灯(防止爆炸)
实验后先停止加热,冷却后停止通CO(防止铁粉氧化,防倒吸)
尾气CO处理(CO有毒,污染空气)
1.铁的常见氧化物有哪些?
含铁量:FeO > Fe3O4 > Fe2O3
含氧量:Fe2O3 > Fe3O4 > FeO
分析与思考
2.将2.32克铁的氧化物在高温下用CO充分反应,得到1.76克CO2,则该铁的氧化物的化学式应该是( )
A.Fe2O3 B.Fe3O4 C.FeO D.无法确定
分析与思考
3.已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2,反应中固体质量随温度的变化曲线如图(A、B、C点的固体组成分别是铁的氧化物中的一种)
回答如下问题:
①在0~400℃温度范围内,管内固体质量不变,其原因是___________________;
②图中x = __________g
分析与思考
已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2,反应中固体质量随温度的变化曲线如图(A、B、C点的固体组成分别是铁的氧化物中的一种)
③试据图计算并推断B点固体的合理化学式____________(写出计算过程)
④写出500℃~600℃,化学反应方程式________________;
分析与思考
FeO
Fe3O4
已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2,反应中固体质量随温度的变化曲线如图(A、B、C点的固体组成分别是铁的氧化物中的一种)
⑤反应一段时间后,剩余固体质量为4.00g(含2种物质),写出2种物质的名称及质量为__________________。
分析与思考
4.00
3.32
FeO
Fe3O4
4.取25g足量的稀硫酸,加入到装有铁粉和铜粉的混合物共5g的烧杯中,用玻璃棒搅拌,充分反应后,过滤,得到滤液质量共27.7g,则混合物中铁粉的质量分数为 ( )
A.44% B.46% C.56% D.64%
练习与巩固
练习与巩固
5.为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(1)实验开始前,连接好仪器并______________________.
(2)实验中观察到 A 中的现象是_____________________________;
请指出该装置中有一处明显不足__________________________;
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
反应前(g) 反应后(g)
B 100 105.4
C 150 163.2
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(3)装置 C 的作用是___________________________.
装置 B 和 C 是否可以颠倒?________(填“是”或“否”).
写出 T3~T4 时间段发生的化学方程式____________________.
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(4)n 的值为___________
(写出计算过程).
反应前(g) 反应后(g)
B 100 105.4
C 150 163.2
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(4) 若没有装置 D,则 n 的值将___________
(填“偏大”或“偏小”或“无 影响”).
练习与巩固
为了 探究铁锈(Fe2O3?nH2O)的组成,称取 27g 这种部分锈蚀的铁粉样品(假设不含其他杂质),按如图1所示装置进行实验.
(5)关系图中 m 的值为___________.
练习与巩固
一、铁的氧化
Fe → FexOy
(1)燃烧
(2)缓慢氧化(生锈,铁锈主要成分Fe2O3?nH2O)
二、铁的还原
FexOy → Fe
三、定量分析铁的氧化与还原
(固体中铁元素守恒,氧元素质量变化)
3Fe + 2O2 === Fe3O4
点燃
课堂总结
渺小的量变可积累惊人的质变,平凡的脚步可以丈量遥远的旅途。
结束语
Thanks
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
