人教版化学九年级下册第八单元 金属和金属材料课题2 金属的化学性质 同步测试
文档属性
| 名称 | 人教版化学九年级下册第八单元 金属和金属材料课题2 金属的化学性质 同步测试 |  | |
| 格式 | zip | ||
| 文件大小 | 189.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-07 17:58:19 | ||
图片预览




文档简介
2019-2020学年人教版九年级下册化学 第八单元 课题2 金属的化学性质 课后习题
一、单选题
1.(2019·内蒙古)下列金属不能和FeSO4溶液反应的是( )
A.Zn B.Cu C.Mg D.Al
2.(2019·辽宁)有甲、乙、丙三种金属,若将甲、乙、丙分别放入一定质量的稀盐酸中,只有甲表面产生气泡;若将丙放入乙的盐溶液中丙表面无现象。则甲、乙、丙三种金属活动性顺序是( )
A.甲>乙>丙 B.丙>乙>甲 C.甲>丙>乙 D.乙>丙>甲
3.从化学的角度对下列词句进行解释,错误的是( )
A.金(即铜)柔锡柔,合两柔则为刚﹣﹣说明合金的熔点比组成它的纯金属高
B.真金不怕火炼﹣金(Au)化学性质不活泼
C.釜底抽薪﹣通过清除可燃物达到灭火的目的
D.百炼成钢﹣﹣使生铁中碳等杂质的含量降低,达到钢的标准
4.下列关于金属的说法正确的是( )
A.地壳中含量最多的金属是铁 B.钢是纯净物,生铁是混合物
C.用灼烧的方法可以鉴别黄金和假黄金(合金) D.用稀硫酸可以验证和的活动性
5.(2019·四川)向一定质量的AgNO3、Fe(NO3)2混合溶液中加入agZn粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得质量仍为ag。下列说法正确的是( )
A.滤液一定呈无色 B.滤液中一定含Fe(NO3)2和Zn(NO3)2
C.滤渣中一定含Fe D.滤渣滴加稀盐酸一定无气泡产生
6.金属M与Cu(NO3)2溶液发生反应:M+Cu(NO3)2=Cu+M(NO3)2,下列叙述不正确的是( )
A.金属M不可能是铝
B.M一定发生反应:M+2AgNO3=2Ag+M(NO3)2
C.若M为镁,恰好完全反应后,溶液质量较反应前减少
D.恰好完全反应后,M表面有红色固体析出,溶液一定由蓝色变为无色
7.(2019·江苏)一定质量的Zn加入到含有Fe(NO3)2和AgNO3两种物质的混合溶液中,充分反应后过滤液仍为浅绿色,下列叙述正确的是( )
①滤液中一定有Zn2+、Fe2+
②滤液中可能有Ag+
③滤渣中一定有Ag,可能有Fe
A.①② B.①③ C.②③ D.①②③
8.(2019·湖南)下列化学反应属于置换反应的是( )
A.2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
B.CaCO3+CO2+H2O=Ca(HCO3)2
C.2NaNO32NaNO2+O2↑
D.CuO+H2Cu+H2O
9.(2019·宁夏)金属钛被誉为21世纪的“明星”金属,具有很多优良性能,被广泛应用于各行各业。为探究钛与镁、铜金属活动性的强弱,选取的下列各组试剂中正确的是(提示:钛的活动性在镁和氢之间)( )
①钛 镁 铜 稀盐酸 ②镁 钛 硫酸铜溶液 ③镁 铜 氯化钛溶液 ④钛 铜 硫酸镁溶液 ⑤钛 硫酸镁溶液 硫酸铜溶液 ⑥铜 硫酸镁溶液 氯化钛溶液
A.①②③⑤ B.②③④⑥ C.①②⑤⑥ D.①③④⑤
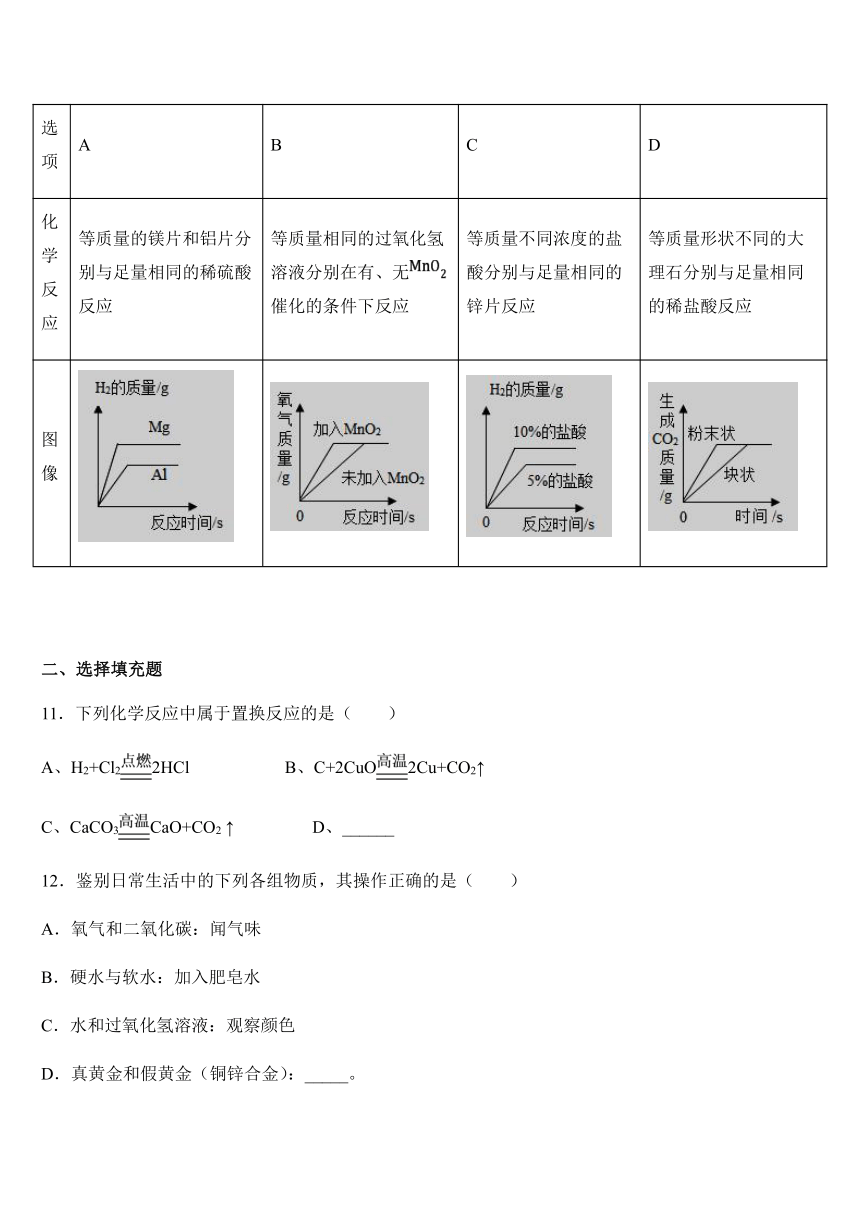
10.影响化学反应速率的因素很多。下列图像表达的化学反应过程,与实际情况不相符的是( )
选项 A B C D
化学反应 等质量的镁片和铝片分别与足量相同的稀硫酸反应 等质量相同的过氧化氢溶液分别在有、无催化的条件下反应 等质量不同浓度的盐酸分别与足量相同的锌片反应 等质量形状不同的大理石分别与足量相同的稀盐酸反应
图像
二、选择填充题
11.下列化学反应中属于置换反应的是( )
A、H2+Cl22HCl B、C+2CuO2Cu+CO2↑
C、CaCO3CaO+CO2 ↑ D、______
12.鉴别日常生活中的下列各组物质,其操作正确的是( )
A.氧气和二氧化碳:闻气味
B.硬水与软水:加入肥皂水
C.水和过氧化氢溶液:观察颜色
D.真黄金和假黄金(铜锌合金):_____。
13.将相同体积、相同溶质质量分数的稀盐酸,分别滴到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中,生成的质量与反应时间的关系如图所示。下列说法中正确的是( )
A.三种金属的活动性顺序为
B.相对原子质量由大到小的顺序为
C.产生氢气的速率顺序为
D.消耗稀盐酸的质量顺序为______
三、填空题
14.金属活动性顺序有着广泛的应用。
(1)铝比较活泼,但铝制品有较强的抗腐蚀性,原因是_______________;
(2)农业上不能用铁桶盛装波尔多液(含硫酸铜),用化学方程式表示为____________;
(3)将锌粉加入一定量的、、混合溶液中充分反应后过滤,向所得固体中加入盐酸有气泡产生,则滤液中含有的溶质是________________。
15.向一定量和的混合溶液中逐渐加入足量锌粒,如图是反应过程中氧化亚铁的质量变化情况:
(1)B点时,反应的化学方程式为________;
(2)C点时,溶液中的溶质有________;
(3)C点与A点相比,溶液质量________(填“增加”、“减小”或“不变”)。
16.金属钴(Co)与铁具有相似的化学性质。
(1)钴可形成化合价为+2和+3的两种氧化物,其化学式分别是_____、_____。
(2)已知CoCl2固体是蓝色的,CoCl2溶液是粉红色的。将金属钴投入稀盐酸中,发生置换反应,生成+2价钴的盐溶液和氢气,反应的化学方程式是_____,可观察到的现象是_____。
四、科学探究题
17.为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
(查阅资料)铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液。
(猜想)三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一 实验二 实验三
实验方案
实验现象 铬片表面产生气泡缓慢溶液变为蓝色 铝片表面产生气泡较快
结论 铬能和稀硫酸发生反应,反应速度较慢 铜不与稀硫酸反应
三种金属在金属活动性顺序中的相对位置关系是__________
(回答问题)(1)用砂纸打磨金属片的目的是___________________________。
(2)实验一所发生反应的化学方程式是________________________________。
(3)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是_______________________________。
18.小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
(查阅资料) 铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜,铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液。
(猜想与假设)三种金属在金属活动性顺序中的相对位置关系:
①Cr、 Al、 Cu ② Al、 Cr、 Cu ③ Al、 Cu、 Cr
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一 实验二 实验三
实验方案
实验现象 铬片表面产生气泡缓慢,溶液变蓝色 _______ 铝片表面产生气泡较快
结论 铬能和稀硫酸发生反应,反应速率较慢。 铜不与稀硫酸反应 _______
三种金属在金属活动性由强到弱的顺序是___________
(回答问题)(1)用砂纸打磨金属片的目的是_____________。
(2)实验一所发生反应的化学方程式是____________。
(3)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是___________。
(4)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是__________ 。
(归纳)比较金属活动性强弱的方法有①_____________ ;②______。
19.探究影响化学反应速率的因素。
(1)[发现和提出问题]
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是______。蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是______;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率。温度如何影响反应速率呢?
(2)[猜想与假设]
温度越高,反应速率越快。
(3)[收集证据]
实验药品:颗粒大小相同的锌粒:两份相同溶质质量分数、不同温度的稀硫酸(20℃、40℃)。
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支。
利用上述仪器和药品,补充完成下表的实验报告。
观察或测量的量 实验步骤 实验现象 实验结论
产生相同体积(一试管)的气体所需要的时间 ①分别取相同数量(或质量)锌粒于两套气体发生装置中②______③记录收集一试管气体所需的时间 ④______ 温度越高、反应速率越快反应的化学方程式是⑤______
(4)[结论与解释]
从微观的角度分析“温度越高,反应速率越快"的原因是___________。
(5)[拓展分析]
根据其他测定方法,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示。请据图分析:时间0-t内,反应速率逐渐加快的主要原因是________,时间t以后,反应速率逐渐减慢的主要原因是________________。
答案
1.B 2.A 3.A 4.C 5.C 6.D 7.D 8.D 9.A 10.A
11.B
12.B; 滴加稀盐酸或加热。
13.C
14.易与空气中氧气反应,生成一层致密的氧化铝薄膜 、
15. 、 增加
16.CoO Co2O3 Co+2HCl=CoCl2+H2↑ 有气泡产生,溶液由无色变为粉红色
17.Al、Cr、Cu 去掉金属表面的氧化膜 Al、CrSO4、Cu (或Al2(SO4)3 、Cr 、CuSO4)
18.无明显现象 铝能与稀硫酸发生反应,反应速率较快 Al、 Cr、 Cu 除去金属表面氧化物 Cr+H2SO4═CrSO4+H2↑ 无法比较铬和铝的金属活动性强弱 Al、CrSO4溶液、Cu 通过金属与酸反应判断金属活动性强弱 通过金属与盐溶液反应判断金属活动性强弱
19.反应物本身的性质 反应物的浓度(或氧气的浓度) 分别取相同体积、不同温度的稀硫酸加入到两套气体发生装置中 有气泡冒出,温度高的,收集一试管气体所需的时间短 Zn+H2SO4=ZnSO4+H2↑ 温度越高,微粒的运动速率加快,有效碰撞机会增多 反应放热,温度升高,反应速率加快 随着反应的进行,反应物的浓度减小,反应速率减慢
同课章节目录
