人教版九年级下册 第九单元 课题1 溶液形成 课件 (共28张PPT)
文档属性
| 名称 | 人教版九年级下册 第九单元 课题1 溶液形成 课件 (共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-08 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
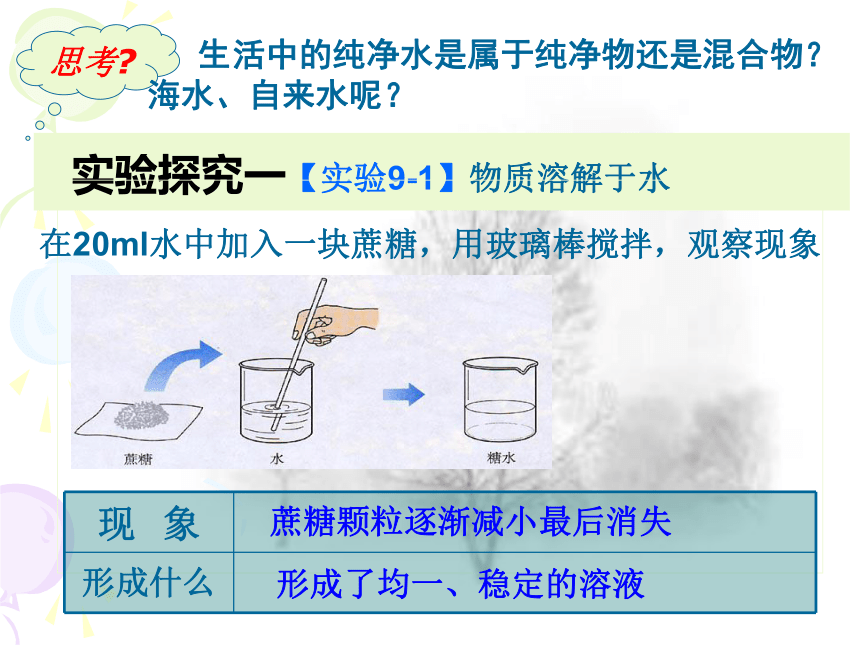
实验探究一【实验9-1】物质溶解于水
蔗糖颗粒逐渐减小最后消失
形成了均一、稳定的溶液
在20ml水中加入一块蔗糖,用玻璃棒搅拌,观察现象
思考?
生活中的纯净水是属于纯净物还是混合物? 海水、自来水呢?
现 象
形成什么
蔗糖与氯化钠两种物质在水中
怎样消失的呢?
蔗糖表面的分子在水分子的作用下,向水中扩散,在水中以分子形式分散在水分子的中间。
氯化钠在水分子的作用下,向水中扩散,在水中以离子形式(Na+、Cl-)存在于水分子的中间。
只要水分不被蒸发,温度不发生变化,蔗糖或氯化钠与水不会分离,且各组成部分相同。
友情提醒
一种或几种物质分散到另一种物质 里,形成均一的、稳定的混合物。
一、溶液
2、特征:
(1)均一性:
(2)稳定性:
1、定义:
是指溶液中各部分浓度、性质都相同。
是指外界条件(温度、压强等)不变时,溶液长期放置不会分层,也不会析出固体或放出气体。
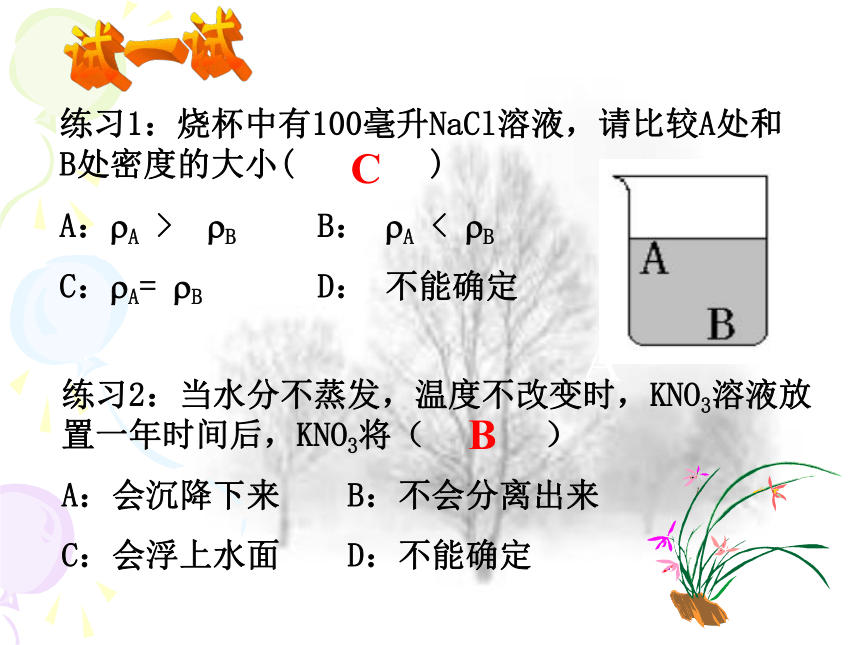
练习1:烧杯中有100毫升NaCl溶液,请比较A处和B处密度的大小( )
A:?A > ?B B: ?A < ?B
C:?A= ?B D: 不能确定
A
C
练习2:当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将( )
A:会沉降下来 B:不会分离出来
C:会浮上水面 D:不能确定
B
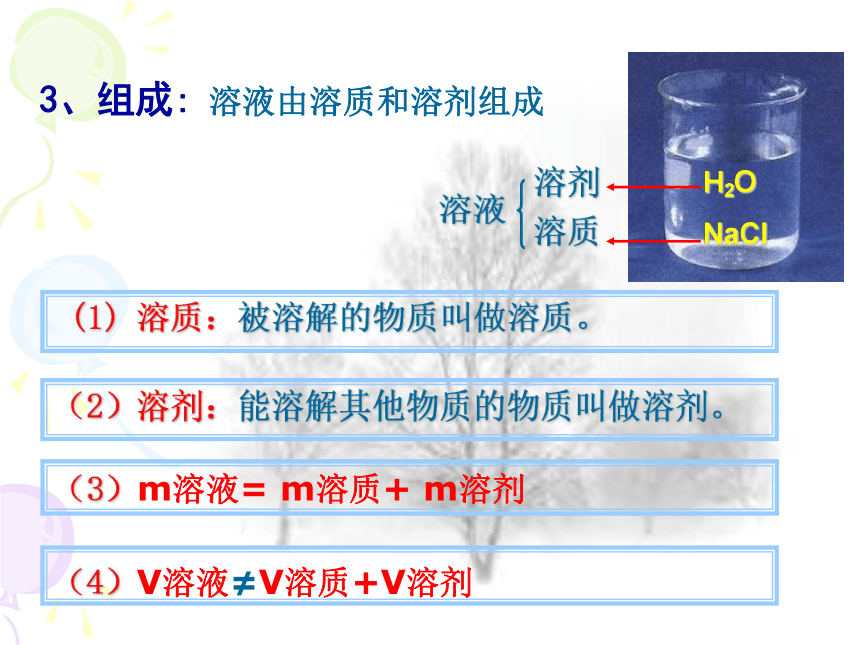
(2)溶剂:能溶解其他物质的物质叫做溶剂。
NaCl
溶质
H2O
溶剂
溶液
3、组成:
溶液由溶质和溶剂组成
(1) 溶质:被溶解的物质叫做溶质。
(3)m溶液= m溶质+ m溶剂
(4)V溶液≠V溶质+V溶剂
--关于溶液的认识
溶液是澄清、透明的,但不一定是无色,
如CuSO4溶液是蓝色的。
均一稳定的液体不一定是溶液,如水
是,溶液中的溶质,可以是一种或几种;
可以是分子,也可是离子。
不是,溶液中的溶质至少是一种,也可以是几种;
溶剂只能是一种。
(1)溶液一定是无色透明的吗?
(2)均一、稳定的液体一定是溶液吗?
(3)将蔗糖溶液和NaCl溶液混合后还是溶液吗?
(4)溶液里的溶质只能是一种物质吗?溶剂呢?
下列溶液中溶质、溶剂分别是什么?
蔗糖溶液、 食盐水、 CuSO4溶液、
Na2CO3溶液、 石灰水、 NaOH溶液
1、在蔗糖溶液和氯化钠溶液中,溶质是什么?
溶剂是什么?
讨论?
思考?
溶质是蔗糖、氯化钠,溶剂是水
水能溶解很多种物质,是一种最常用的溶剂。
水能溶解所有的物质吗? 除了水还有其他的溶剂吗?
结论:碘可以溶于汽油,几乎不溶于水;高锰酸钾
可以溶于水,几乎不溶于汽油。
实验探究二:溶质与溶剂的关系
[实验]9-2 不同的溶质在不同的溶剂中的溶解性
几乎不溶解 (溶液略显棕黄色)
溶解,溶液紫色
溶解,溶液棕色
几乎不溶解
实验现象记录
同一种物质在不同的溶剂中溶解能力不同;
不同的物质在同一种溶剂中的溶解能力也不同。
【结论】:
物质的溶解能力与溶质和溶剂的性质有关。
溶剂 溶质 现象
水 碘
水 高锰酸钾
汽油 碘
汽油 高锰酸钾
4、溶液中溶质与溶剂的判定:
(1)固体、气体溶于液体时:固体、气体为溶质,液体为溶剂;
(2)液体溶于液体时:无水,量多的为溶剂,量少的为溶质;
有水,则水是溶剂;其它为溶质;
(3)通常不指明溶剂的溶液,水是溶剂;
(4)根据名称:一般溶质在前,溶剂在后;如碘酒
(5)当物质溶解发生化学反应时,生成的新物质是溶质。
【说明】水是最常见的溶剂,酒精、汽油等物质也是常见的溶剂
1、判断下列说法是否正确,并说明判断理由。
(1)凡是均一、稳定的液体就是溶液。
(2)盐水是溶液,糖水是溶液,混合在一起,既有糖又有
盐则不是溶液了。
(3)溶液中只含有溶质分子、溶剂分子。
错
错
错
2、下列液体中属于溶液的是………………………( )
A.白醋 B.蒸馏水
C.无水乙醇 D.通入适量二氧化碳后的澄清石灰水
5、下列液体不属于溶液的是………………………( )
A.纯净水 B.矿泉水 C.冰水混合物 D.汽水
A
C
[能力提高] 1、将少量的氯化钠固体投入水中,形成的溶液中溶质是 ;将少量氧化钙投入水中,形成无色透明的溶液中,溶质是 .
2、将过量的石灰石投入稀盐酸中,充分反应后(杂质不与稀盐酸反应),过滤掉固体残渣,最终得到的溶液中溶质是________,溶剂是_______。
CaCl2
H2O
NaCl
Ca(OH)2
实验探究三:[实验9-3] 水和乙醇能够互溶吗?
分层
混合均匀
不分层
乙醇与水互溶
注意:乙醇能与水以任意比例互溶
溶剂 溶质 振荡前现象 振荡后现象 静置后现象 论结
水 乙醇
溶液在生产和科研中具有广泛的用途,与人们的生活息息相关。
1、我们在实验中曾用过哪些溶液?
2、据生活实例,你知道溶液哪些用途?
讨论?
在营养液中无土栽培的植物
5、溶液的用途(了解):
(1)在溶液中进行的化学反应,速率较快,可以宿短生产周期;
(2)溶液对动植物和人的生理活动有很重要的意义;
(3)医疗上用的很多注射液都是溶液。
现有试管、烧杯、玻璃棒、温度计等仪器和固态NaCl、NH4NO3、NaOH(你还可选用其他仪器和药品),试设计实验方案,探究它们溶解于水时是放出热量还是吸收热量。
1、实验方案:
(1)分别向三只烧杯中倒入一定质量的水,然后测出水温;
(2)分别将一定量的三种固体放入上述三只烧杯中,
搅拌并测出温度;
(3)比较前后温度变化;
活动与探究四
溶解时的吸热或放热现象
固体溶解
固体溶解
固体溶解
溶解时温度不变
溶解时吸收热量
溶解时放出热量
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度/℃
溶解现象
溶质溶解后水的温度/℃
结 论
二、溶解时的吸热或放热现象
1、溶解过程的两种变化:
吸收热量
(1)扩散过程:
(2)扩散过程:
溶质的分子(或离子)向水中扩散,
溶质的分子(或离子)和水分子作用,
生成水合分子(或水合离子),
放出热量
2、溶解过程的温度变化:
扩散过程吸收的热量小于水合过程放出的热量;
扩散过程吸收的热量大于水合过程放出的热量:
扩散过程吸收的热量等于水合过程放出的热量:
(1)温度升高:
(2)温度降低:
(3)温度不变:
如:浓硫酸、NaOH固体等溶于水
如:NH4NO3、 NH4Cl等溶于水
如:NaCl 、蔗糖等溶于水
3、加快物质溶解速度的方法:
(1)搅拌
(2)加热
(3)将固体研碎
浓硫酸、氢氧化钠固体溶于水温度会升高,其原理是什么?氧化钙固体投入水中温度也会升高,其原理是什么?
浓硫酸、氢氧化钠溶于水扩散过程吸收的热量小于水合过程放出的热量,所以温度升高;
氧化钙与水发生化学反应放热,所以温度升高.
【练习与巩固】:右图所示,向小试管中加入一 定量的下列物质,U形管液面右侧未发生改变,该物质是( )
U形管液面右侧升高,该物质是( )
U形管液面右侧降低,该物质是( )
A、浓硫酸 B、烧碱
C、生石灰 D、蔗糖
E、硝酸铵 F、氯化钠
DF
ABC
E
水和油 ( 加了洗涤剂)- 乳化
水和油 (没有加洗涤剂)
活动与探究五:植物油能溶于水吗?
洗涤剂在清洗油污时起的作用是什么?
实验现象记录:
分层
浑浊
分层
不干净
分层
浑浊
不分层
干净
思考?
植物油在水中形成的混合物的特点是什么?
为什么加了洗涤剂的乳浊液可以稳定存在?
试管内加入的物质 现象 把液体到掉后试管是否干净
振荡前 振荡后 静置后
水和植
物油
水和植物油及洗涤剂
三、乳化现象
(1)定 义:小液滴分散到液体里形成的混合物
(2)特 征:
不均一、不稳定(静置分层)
1、乳浊液
(3)用 途:
粉刷墙壁的乳胶漆是乳浊液;农业上,常把不溶于水的固体或液体农药配成悬浊液或乳浊液,用来喷洒受病虫害的农作物,以节约农药,提高药效。
如:油水、牛奶
分析:洗涤剂有乳化功能,它能使植物油分散成无数细小的液滴而不聚成大的油珠。这些细小的液滴能随水流走,这种现象称为洗涤剂的乳化作用。
洗涤剂在清洗油污时起的作用是什么?
想一想?
2、乳化现象
指洗涤剂能使植物油分散成无数细小的液滴,而不聚成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强。洗涤剂的这种作用叫乳化作用。
(2)应 用:
洗涤剂、农药的使用
(1)定 义:
修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污。这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同?
思考?
不 同
汽油去油污的原理是: 油污溶解在汽油中,
形成溶液,从而除去油污。
洗涤剂去油污的原理:洗涤剂是乳化剂,有乳化作用,能使油分散成无数细小的液滴而不聚成大的油珠。这些小液滴能随水流走。
溶质
被 溶 解
的 物 质
一种或几种
物质
分 散 到
另一种 物 质
溶剂
均一、稳 定
的 混 合 物
溶液
乳浊液
乳化现象
乳化剂
能溶解其他
物质的物质
一、溶液
二、溶解时的吸热和放热现象
物质在溶解过程中有的吸收热量,有的放出热量。
本节重点
实验探究一【实验9-1】物质溶解于水
蔗糖颗粒逐渐减小最后消失
形成了均一、稳定的溶液
在20ml水中加入一块蔗糖,用玻璃棒搅拌,观察现象
思考?
生活中的纯净水是属于纯净物还是混合物? 海水、自来水呢?
现 象
形成什么
蔗糖与氯化钠两种物质在水中
怎样消失的呢?
蔗糖表面的分子在水分子的作用下,向水中扩散,在水中以分子形式分散在水分子的中间。
氯化钠在水分子的作用下,向水中扩散,在水中以离子形式(Na+、Cl-)存在于水分子的中间。
只要水分不被蒸发,温度不发生变化,蔗糖或氯化钠与水不会分离,且各组成部分相同。
友情提醒
一种或几种物质分散到另一种物质 里,形成均一的、稳定的混合物。
一、溶液
2、特征:
(1)均一性:
(2)稳定性:
1、定义:
是指溶液中各部分浓度、性质都相同。
是指外界条件(温度、压强等)不变时,溶液长期放置不会分层,也不会析出固体或放出气体。
练习1:烧杯中有100毫升NaCl溶液,请比较A处和B处密度的大小( )
A:?A > ?B B: ?A < ?B
C:?A= ?B D: 不能确定
A
C
练习2:当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将( )
A:会沉降下来 B:不会分离出来
C:会浮上水面 D:不能确定
B
(2)溶剂:能溶解其他物质的物质叫做溶剂。
NaCl
溶质
H2O
溶剂
溶液
3、组成:
溶液由溶质和溶剂组成
(1) 溶质:被溶解的物质叫做溶质。
(3)m溶液= m溶质+ m溶剂
(4)V溶液≠V溶质+V溶剂
--关于溶液的认识
溶液是澄清、透明的,但不一定是无色,
如CuSO4溶液是蓝色的。
均一稳定的液体不一定是溶液,如水
是,溶液中的溶质,可以是一种或几种;
可以是分子,也可是离子。
不是,溶液中的溶质至少是一种,也可以是几种;
溶剂只能是一种。
(1)溶液一定是无色透明的吗?
(2)均一、稳定的液体一定是溶液吗?
(3)将蔗糖溶液和NaCl溶液混合后还是溶液吗?
(4)溶液里的溶质只能是一种物质吗?溶剂呢?
下列溶液中溶质、溶剂分别是什么?
蔗糖溶液、 食盐水、 CuSO4溶液、
Na2CO3溶液、 石灰水、 NaOH溶液
1、在蔗糖溶液和氯化钠溶液中,溶质是什么?
溶剂是什么?
讨论?
思考?
溶质是蔗糖、氯化钠,溶剂是水
水能溶解很多种物质,是一种最常用的溶剂。
水能溶解所有的物质吗? 除了水还有其他的溶剂吗?
结论:碘可以溶于汽油,几乎不溶于水;高锰酸钾
可以溶于水,几乎不溶于汽油。
实验探究二:溶质与溶剂的关系
[实验]9-2 不同的溶质在不同的溶剂中的溶解性
几乎不溶解 (溶液略显棕黄色)
溶解,溶液紫色
溶解,溶液棕色
几乎不溶解
实验现象记录
同一种物质在不同的溶剂中溶解能力不同;
不同的物质在同一种溶剂中的溶解能力也不同。
【结论】:
物质的溶解能力与溶质和溶剂的性质有关。
溶剂 溶质 现象
水 碘
水 高锰酸钾
汽油 碘
汽油 高锰酸钾
4、溶液中溶质与溶剂的判定:
(1)固体、气体溶于液体时:固体、气体为溶质,液体为溶剂;
(2)液体溶于液体时:无水,量多的为溶剂,量少的为溶质;
有水,则水是溶剂;其它为溶质;
(3)通常不指明溶剂的溶液,水是溶剂;
(4)根据名称:一般溶质在前,溶剂在后;如碘酒
(5)当物质溶解发生化学反应时,生成的新物质是溶质。
【说明】水是最常见的溶剂,酒精、汽油等物质也是常见的溶剂
1、判断下列说法是否正确,并说明判断理由。
(1)凡是均一、稳定的液体就是溶液。
(2)盐水是溶液,糖水是溶液,混合在一起,既有糖又有
盐则不是溶液了。
(3)溶液中只含有溶质分子、溶剂分子。
错
错
错
2、下列液体中属于溶液的是………………………( )
A.白醋 B.蒸馏水
C.无水乙醇 D.通入适量二氧化碳后的澄清石灰水
5、下列液体不属于溶液的是………………………( )
A.纯净水 B.矿泉水 C.冰水混合物 D.汽水
A
C
[能力提高] 1、将少量的氯化钠固体投入水中,形成的溶液中溶质是 ;将少量氧化钙投入水中,形成无色透明的溶液中,溶质是 .
2、将过量的石灰石投入稀盐酸中,充分反应后(杂质不与稀盐酸反应),过滤掉固体残渣,最终得到的溶液中溶质是________,溶剂是_______。
CaCl2
H2O
NaCl
Ca(OH)2
实验探究三:[实验9-3] 水和乙醇能够互溶吗?
分层
混合均匀
不分层
乙醇与水互溶
注意:乙醇能与水以任意比例互溶
溶剂 溶质 振荡前现象 振荡后现象 静置后现象 论结
水 乙醇
溶液在生产和科研中具有广泛的用途,与人们的生活息息相关。
1、我们在实验中曾用过哪些溶液?
2、据生活实例,你知道溶液哪些用途?
讨论?
在营养液中无土栽培的植物
5、溶液的用途(了解):
(1)在溶液中进行的化学反应,速率较快,可以宿短生产周期;
(2)溶液对动植物和人的生理活动有很重要的意义;
(3)医疗上用的很多注射液都是溶液。
现有试管、烧杯、玻璃棒、温度计等仪器和固态NaCl、NH4NO3、NaOH(你还可选用其他仪器和药品),试设计实验方案,探究它们溶解于水时是放出热量还是吸收热量。
1、实验方案:
(1)分别向三只烧杯中倒入一定质量的水,然后测出水温;
(2)分别将一定量的三种固体放入上述三只烧杯中,
搅拌并测出温度;
(3)比较前后温度变化;
活动与探究四
溶解时的吸热或放热现象
固体溶解
固体溶解
固体溶解
溶解时温度不变
溶解时吸收热量
溶解时放出热量
水中加入的溶质 NaCl NH4NO3 NaOH
加入溶质前水的温度/℃
溶解现象
溶质溶解后水的温度/℃
结 论
二、溶解时的吸热或放热现象
1、溶解过程的两种变化:
吸收热量
(1)扩散过程:
(2)扩散过程:
溶质的分子(或离子)向水中扩散,
溶质的分子(或离子)和水分子作用,
生成水合分子(或水合离子),
放出热量
2、溶解过程的温度变化:
扩散过程吸收的热量小于水合过程放出的热量;
扩散过程吸收的热量大于水合过程放出的热量:
扩散过程吸收的热量等于水合过程放出的热量:
(1)温度升高:
(2)温度降低:
(3)温度不变:
如:浓硫酸、NaOH固体等溶于水
如:NH4NO3、 NH4Cl等溶于水
如:NaCl 、蔗糖等溶于水
3、加快物质溶解速度的方法:
(1)搅拌
(2)加热
(3)将固体研碎
浓硫酸、氢氧化钠固体溶于水温度会升高,其原理是什么?氧化钙固体投入水中温度也会升高,其原理是什么?
浓硫酸、氢氧化钠溶于水扩散过程吸收的热量小于水合过程放出的热量,所以温度升高;
氧化钙与水发生化学反应放热,所以温度升高.
【练习与巩固】:右图所示,向小试管中加入一 定量的下列物质,U形管液面右侧未发生改变,该物质是( )
U形管液面右侧升高,该物质是( )
U形管液面右侧降低,该物质是( )
A、浓硫酸 B、烧碱
C、生石灰 D、蔗糖
E、硝酸铵 F、氯化钠
DF
ABC
E
水和油 ( 加了洗涤剂)- 乳化
水和油 (没有加洗涤剂)
活动与探究五:植物油能溶于水吗?
洗涤剂在清洗油污时起的作用是什么?
实验现象记录:
分层
浑浊
分层
不干净
分层
浑浊
不分层
干净
思考?
植物油在水中形成的混合物的特点是什么?
为什么加了洗涤剂的乳浊液可以稳定存在?
试管内加入的物质 现象 把液体到掉后试管是否干净
振荡前 振荡后 静置后
水和植
物油
水和植物油及洗涤剂
三、乳化现象
(1)定 义:小液滴分散到液体里形成的混合物
(2)特 征:
不均一、不稳定(静置分层)
1、乳浊液
(3)用 途:
粉刷墙壁的乳胶漆是乳浊液;农业上,常把不溶于水的固体或液体农药配成悬浊液或乳浊液,用来喷洒受病虫害的农作物,以节约农药,提高药效。
如:油水、牛奶
分析:洗涤剂有乳化功能,它能使植物油分散成无数细小的液滴而不聚成大的油珠。这些细小的液滴能随水流走,这种现象称为洗涤剂的乳化作用。
洗涤剂在清洗油污时起的作用是什么?
想一想?
2、乳化现象
指洗涤剂能使植物油分散成无数细小的液滴,而不聚成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强。洗涤剂的这种作用叫乳化作用。
(2)应 用:
洗涤剂、农药的使用
(1)定 义:
修汽车的工人,当他的手上沾满油污时,他常用汽油洗去手上的油污。这说明汽油与洗涤剂一样能去油污,那么二者去油污的原理是否相同?
思考?
不 同
汽油去油污的原理是: 油污溶解在汽油中,
形成溶液,从而除去油污。
洗涤剂去油污的原理:洗涤剂是乳化剂,有乳化作用,能使油分散成无数细小的液滴而不聚成大的油珠。这些小液滴能随水流走。
溶质
被 溶 解
的 物 质
一种或几种
物质
分 散 到
另一种 物 质
溶剂
均一、稳 定
的 混 合 物
溶液
乳浊液
乳化现象
乳化剂
能溶解其他
物质的物质
一、溶液
二、溶解时的吸热和放热现象
物质在溶解过程中有的吸收热量,有的放出热量。
本节重点
同课章节目录
