人教版化学必修第一册第三章 铁金属材料第一节 铁及其化合物 (课件 共22张PPT)
文档属性
| 名称 | 人教版化学必修第一册第三章 铁金属材料第一节 铁及其化合物 (课件 共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 900.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-09 15:44:02 | ||
图片预览








文档简介
(共22张PPT)
第一节 铁及其化合物
()
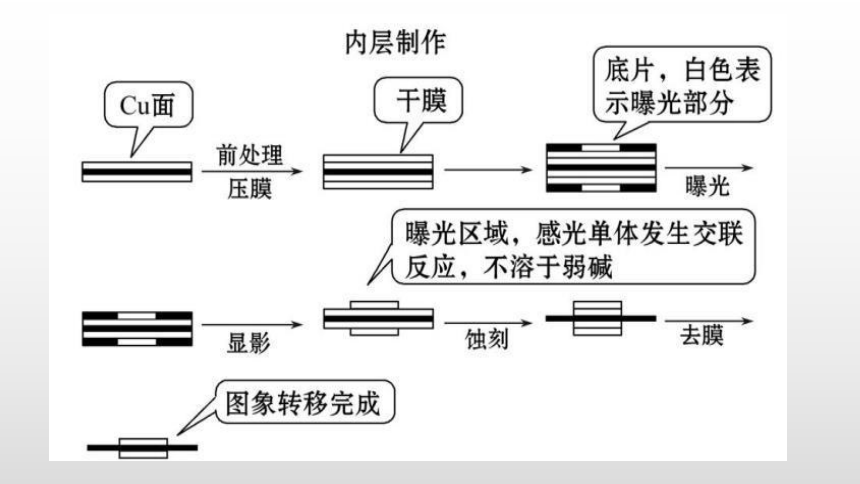
工业印刷电路板的制作流程如图所示,其中“蚀刻”所用的就是溶液FeCl3。
工业印刷电路板的制作流程
(1)FeCl3溶液蚀刻印刷铜板的原理是怎样的?
提示:2Fe3++Cu====2Fe2++Cu2+。
(2)由FeCl2生成Fe或FeCl3,你能写出其化学方程式吗?
提示:FeCl2+Zn====ZnCl2+Fe,2FeCl2+Cl2====2FeCl3。
(3)反应后的“蚀刻液”中含有哪些金属离子?如果要回收得到Cu和FeCl3,需要怎样设计回收方案?
提示:反应后的“蚀刻液”中含有Fe3+、Fe2+、Cu2+等金属离子。为从溶液中提取Cu,应向溶液中加入过量铁粉:Fe+Cu2+====Fe2++Cu、Fe+2Fe3+=3Fe2+;然后用盐酸溶解过量的铁粉:Fe+2HCl====FeCl2+H2↑;过滤后,得到Cu,再向滤液中加入新制氯水即可得到FeCl3:2FeCl2+Cl2====2FeCl3。
生活中的铁
1.人缺铁与贫血有何关系?
人体内的血红蛋白是含铁的化合物,它具有固定氧和输送氧的功能。人体若缺铁,血红蛋白含量会减少,易患缺铁性贫血,此时,可服含硫酸亚铁等药物或多食用含铁丰富的食物。
2.医疗上包扎伤口时为什么常涂抹FeCl3溶液?
因为Fe3+易水解生成氢氧化铁胶体,该胶体能使蛋白质迅速凝聚,具有止血作用。
3.为什么可用草酸溶液洗去衣服上的墨迹?
硫酸亚铁与鞣酸反应可生成易溶于水的鞣酸亚铁,由于它易被氧化成黑色的鞣酸铁,故可用来制蓝黑墨水。而鞣酸铁能氧化草酸,因此,可用草酸溶液洗去衣服上的墨迹。
4.砖的颜色为何不一样,有红砖与青砖呢?
将用黏土制成的砖坯置于窑内,先用大火将砖坯从外向里烧透,然后停火,使砖和窑体慢慢冷却下来,在这个过程中,由于空气充足,砖坯中的铁元素就被氧化成Fe2O3(棕红色)使砖呈现红色;如果在砖坯烧透之后,从窑顶向砖坯上淋水,使其迅速冷却,由于产生大量的CO和H2,氧化铁被还原为氧化亚铁和四氧化三铁,同时还有未烧的炭粒,使砖呈现青色。
5.热敷袋为什么能发热?
热敷袋的主要材料为发热剂,是用铁粉和添加剂制成的。铁粉表面未经氧化,平时要密封在塑料袋里,使用时接触空气,即会放出热量。这种由缓慢氧化放出的热量均匀、稳定,通过调节塑料袋的进气量,温度可以升高,也可以降低,一袋发热剂可连续使用近30 h。
1.某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知SCN-、Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,并结合已学的知识设计了如下实验; ①将药片除去糖衣研细后溶解、过滤。 ②取滤液分别加入两支试管中,在一支试管中加入酸性KMnO4溶液,在另一支试管中加入KSCN溶液。 请完成下列问题:
(1)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液后不变红,结论是____________。 (2)若滴入酸性KMnO4溶液后不褪色,滴入KSCN溶液变红,结论是____________。 (3)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液变红,结论是____________。 (4)________(填“能”或“不能”)将酸性KMnO4溶液和KSCN溶液滴入同一支试管中进行验证,原因是____________。
解析:加入酸性KMnO4溶液褪色说明含有Fe2+,而加入KSCN溶液变红则说明含有Fe3+,所以前三问的答案很容易得出。第(4)问中的原因可归纳为两条,一是酸性KMnO4溶液呈紫红色,影响Fe3+的检验;二是KSCN具有还原性,可以被酸性KMnO4溶液氧化,影响Fe2+的检验。
2.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。 (1)检验溶液中Fe3+存在的试剂是__________,证明Fe3+存在的现象是______________。 (2)写出FeCl3溶液与金属铜发生反应的化学方程式: ________________________________________________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
3.已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式:
A.________,C.________,F.________,G.________。?
(2)检验D中阳离子的方法______________。?
(3)保存C溶液时要加固体A的原因是____________。
(4)写出下列转化的离子方程式或化学方程式。
①A→C:____________________________;?
②C→D:____________________________。??
本题的突破口为:
(1)F是一种红褐色沉淀——F为氢氧化铁;
(2)B与盐酸反应生成两种盐,且通Cl2可以转化——含有变价金属,B为Fe3O4。
【解析】(1)A是一种常见金属,F是一种红褐色沉淀,由转化关系可知,F为Fe(OH)3,A为Fe,Fe与氧气反应生成的B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到的X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3;(2)D为FeCl3,含有的阳离子为Fe3+,检验Fe3+的方法为取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+;
(3)FeCl2易被空气中的氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧化;(4)①A→C反应的离子方程式为Fe+2H+====Fe2++H2↑,②C→D反应的离子方程式为2Fe2++Cl2====2Fe3++2Cl-。
答案:(1)Fe FeCl2 Fe(OH)3 Fe2O3
(2)取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+ (3)防止Fe2+被氧气氧化
(4)①Fe+2H+====Fe2++H2↑
②2Fe2++Cl2====2Fe3++2Cl-
4.某兴趣小组进行某补血剂中铁元素含量的测定实验流程如下:
下列说法不正确的是 ( )
A.步骤①研磨时需要在研钵中进行
B.步骤②加入氨水的作用是将Fe2+ 完全沉淀
C.步骤③多步操作为过滤、洗涤、灼烧至恒重、冷却、称重
D.每片补血剂中铁元素的质量为0.07w g
B
【解析】步骤①是将补血剂磨成细粉,便于溶解,研磨时需要在研钵中进行,A正确;步骤②中加入过氧化氢是将Fe2+氧化为Fe3+,然后用过量氨水将Fe3+完全沉淀为红褐色氢氧化铁,B错误;步骤③是将氢氧化铁沉淀转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,所以操作为过滤、洗涤、灼烧至恒重、冷却、称重,C正确;w g氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量为 =0.07w g,D正确。
第一节 铁及其化合物
()
工业印刷电路板的制作流程如图所示,其中“蚀刻”所用的就是溶液FeCl3。
工业印刷电路板的制作流程
(1)FeCl3溶液蚀刻印刷铜板的原理是怎样的?
提示:2Fe3++Cu====2Fe2++Cu2+。
(2)由FeCl2生成Fe或FeCl3,你能写出其化学方程式吗?
提示:FeCl2+Zn====ZnCl2+Fe,2FeCl2+Cl2====2FeCl3。
(3)反应后的“蚀刻液”中含有哪些金属离子?如果要回收得到Cu和FeCl3,需要怎样设计回收方案?
提示:反应后的“蚀刻液”中含有Fe3+、Fe2+、Cu2+等金属离子。为从溶液中提取Cu,应向溶液中加入过量铁粉:Fe+Cu2+====Fe2++Cu、Fe+2Fe3+=3Fe2+;然后用盐酸溶解过量的铁粉:Fe+2HCl====FeCl2+H2↑;过滤后,得到Cu,再向滤液中加入新制氯水即可得到FeCl3:2FeCl2+Cl2====2FeCl3。
生活中的铁
1.人缺铁与贫血有何关系?
人体内的血红蛋白是含铁的化合物,它具有固定氧和输送氧的功能。人体若缺铁,血红蛋白含量会减少,易患缺铁性贫血,此时,可服含硫酸亚铁等药物或多食用含铁丰富的食物。
2.医疗上包扎伤口时为什么常涂抹FeCl3溶液?
因为Fe3+易水解生成氢氧化铁胶体,该胶体能使蛋白质迅速凝聚,具有止血作用。
3.为什么可用草酸溶液洗去衣服上的墨迹?
硫酸亚铁与鞣酸反应可生成易溶于水的鞣酸亚铁,由于它易被氧化成黑色的鞣酸铁,故可用来制蓝黑墨水。而鞣酸铁能氧化草酸,因此,可用草酸溶液洗去衣服上的墨迹。
4.砖的颜色为何不一样,有红砖与青砖呢?
将用黏土制成的砖坯置于窑内,先用大火将砖坯从外向里烧透,然后停火,使砖和窑体慢慢冷却下来,在这个过程中,由于空气充足,砖坯中的铁元素就被氧化成Fe2O3(棕红色)使砖呈现红色;如果在砖坯烧透之后,从窑顶向砖坯上淋水,使其迅速冷却,由于产生大量的CO和H2,氧化铁被还原为氧化亚铁和四氧化三铁,同时还有未烧的炭粒,使砖呈现青色。
5.热敷袋为什么能发热?
热敷袋的主要材料为发热剂,是用铁粉和添加剂制成的。铁粉表面未经氧化,平时要密封在塑料袋里,使用时接触空气,即会放出热量。这种由缓慢氧化放出的热量均匀、稳定,通过调节塑料袋的进气量,温度可以升高,也可以降低,一袋发热剂可连续使用近30 h。
1.某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知SCN-、Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色,并结合已学的知识设计了如下实验; ①将药片除去糖衣研细后溶解、过滤。 ②取滤液分别加入两支试管中,在一支试管中加入酸性KMnO4溶液,在另一支试管中加入KSCN溶液。 请完成下列问题:
(1)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液后不变红,结论是____________。 (2)若滴入酸性KMnO4溶液后不褪色,滴入KSCN溶液变红,结论是____________。 (3)若滴入酸性KMnO4溶液后褪色,滴入KSCN溶液变红,结论是____________。 (4)________(填“能”或“不能”)将酸性KMnO4溶液和KSCN溶液滴入同一支试管中进行验证,原因是____________。
解析:加入酸性KMnO4溶液褪色说明含有Fe2+,而加入KSCN溶液变红则说明含有Fe3+,所以前三问的答案很容易得出。第(4)问中的原因可归纳为两条,一是酸性KMnO4溶液呈紫红色,影响Fe3+的检验;二是KSCN具有还原性,可以被酸性KMnO4溶液氧化,影响Fe2+的检验。
2.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。 (1)检验溶液中Fe3+存在的试剂是__________,证明Fe3+存在的现象是______________。 (2)写出FeCl3溶液与金属铜发生反应的化学方程式: ________________________________________________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
3.已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式:
A.________,C.________,F.________,G.________。?
(2)检验D中阳离子的方法______________。?
(3)保存C溶液时要加固体A的原因是____________。
(4)写出下列转化的离子方程式或化学方程式。
①A→C:____________________________;?
②C→D:____________________________。??
本题的突破口为:
(1)F是一种红褐色沉淀——F为氢氧化铁;
(2)B与盐酸反应生成两种盐,且通Cl2可以转化——含有变价金属,B为Fe3O4。
【解析】(1)A是一种常见金属,F是一种红褐色沉淀,由转化关系可知,F为Fe(OH)3,A为Fe,Fe与氧气反应生成的B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到的X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3;(2)D为FeCl3,含有的阳离子为Fe3+,检验Fe3+的方法为取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+;
(3)FeCl2易被空气中的氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧化;(4)①A→C反应的离子方程式为Fe+2H+====Fe2++H2↑,②C→D反应的离子方程式为2Fe2++Cl2====2Fe3++2Cl-。
答案:(1)Fe FeCl2 Fe(OH)3 Fe2O3
(2)取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,证明有Fe3+ (3)防止Fe2+被氧气氧化
(4)①Fe+2H+====Fe2++H2↑
②2Fe2++Cl2====2Fe3++2Cl-
4.某兴趣小组进行某补血剂中铁元素含量的测定实验流程如下:
下列说法不正确的是 ( )
A.步骤①研磨时需要在研钵中进行
B.步骤②加入氨水的作用是将Fe2+ 完全沉淀
C.步骤③多步操作为过滤、洗涤、灼烧至恒重、冷却、称重
D.每片补血剂中铁元素的质量为0.07w g
B
【解析】步骤①是将补血剂磨成细粉,便于溶解,研磨时需要在研钵中进行,A正确;步骤②中加入过氧化氢是将Fe2+氧化为Fe3+,然后用过量氨水将Fe3+完全沉淀为红褐色氢氧化铁,B错误;步骤③是将氢氧化铁沉淀转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量,所以操作为过滤、洗涤、灼烧至恒重、冷却、称重,C正确;w g氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量为 =0.07w g,D正确。
