科粤版九年级化学上 4.3 质量守恒定律 同步练习试题卷 含解析答案
文档属性
| 名称 | 科粤版九年级化学上 4.3 质量守恒定律 同步练习试题卷 含解析答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 184.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-11 00:00:00 | ||
图片预览




文档简介
4.3 质量守恒定律
一.选择题(共12小题)
1.在空气中完全燃烧4.6g某纯净物生成8.8gCO2和5.4gH2O,则该纯净物的组成中( )
A.只有C元素 B.只有C、H元素
C.只有C、H、O元素 D.都不正确
2.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后备物质的质量如下表:
物质
甲
乙
丙
丁
反应前质量/g
20
2
8
6
反应后质量/g
4
待测
28
2
对该反应,下列描述中正确的是( )
A.该反应可能是铜与氧气的反应
B.乙一定是该反应的催化剂
C.反应中甲和丙的质量比为1:7
D.丙一定是单质
3.在化学反应前后,下列各项肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥分子的种类 ⑦原子的质子数
A.只有②④⑤⑥ B.只有①③④⑦ C.只有①④⑥ D.只有①③⑤
4.用燃烧法测定某化合物的组成。现取1.6g某化合物在足量氧气中充分燃烧,生成4.4gCO2和3.6gH2O下列说法中错误的是( )
A.该化合物中含碳元素1.2g
B.该化合物中可能含氧元素
C.碳、氢原子个数比是1:4
D.该化合物只含有C、H两种元素,不含O元素
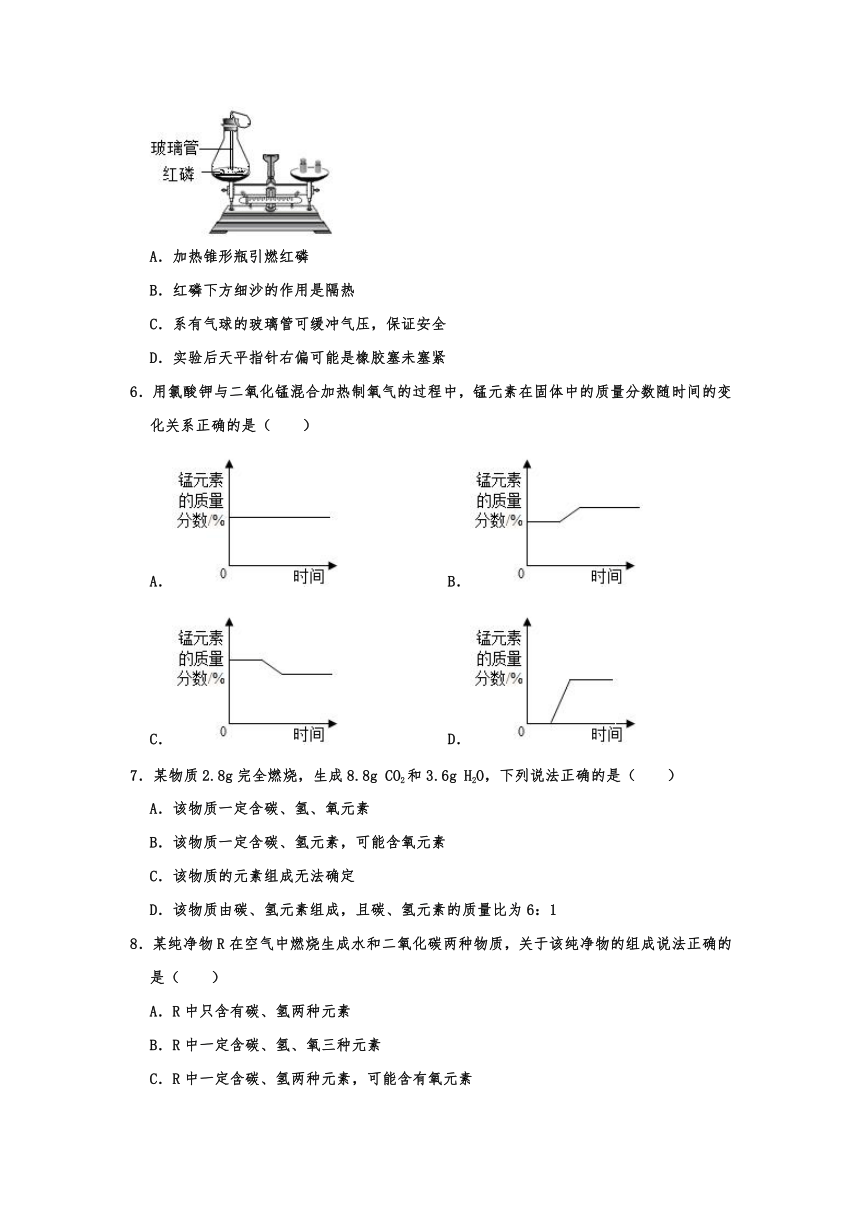
5.用如图装置测定红磷燃烧前后的质量关系,下列有关说法错误的是( )
A.加热锥形瓶引燃红磷
B.红磷下方细沙的作用是隔热
C.系有气球的玻璃管可缓冲气压,保证安全
D.实验后天平指针右偏可能是橡胶塞未塞紧
6.用氯酸钾与二氧化锰混合加热制氧气的过程中,锰元素在固体中的质量分数随时间的变化关系正确的是( )
A. B.
C. D.
7.某物质2.8g完全燃烧,生成8.8g CO2和3.6g H2O,下列说法正确的是( )
A.该物质一定含碳、氢、氧元素
B.该物质一定含碳、氢元素,可能含氧元素
C.该物质的元素组成无法确定
D.该物质由碳、氢元素组成,且碳、氢元素的质量比为6:1
8.某纯净物R在空气中燃烧生成水和二氧化碳两种物质,关于该纯净物的组成说法正确的是( )
A.R中只含有碳、氢两种元素
B.R中一定含碳、氢、氧三种元素
C.R中一定含碳、氢两种元素,可能含有氧元素
D.无法判断
9.有反应2A+5B=C+2D,A、B两种物质完全反应时的质量比为4:3,若生成C和D共280g,则反应消耗B的质量为( )
A.120g B.160g C.90g D.240g
10.点燃一条质量为N的镁带,燃烧后将生成物和未燃烧的部分收集起来,其质量为M,则N与M的大小关系是( )
A.N=M B.N<M C.N>M D.无法判断
11.在运输鱼的过程中,可以在水中加入过氧化钙(CaO2)作为制氧剂,它与水反应后的生成物可能是( )
A.CaCO3和H2 B.Ca(OH)2和O2
C.CaCl2和O2 D.Ca(NO3)2和CO2
12.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表所示,则以下判断错误的是( )
物质
甲
乙
丙
丁
反应前质量/g
64
10
1
16
反应后质量/g
0
42
1
a
A.甲有64克参加反应,一定是反应物
B.乙反应后质量增多,一定是生成物
C.丙反应前后质量不变,一定是催化剂
D.丁反应后的质量a=48克
二.实验探究题(共5小题)
13.初三某化学兴趣小组同学依据教材实验对化学反应前后质量变化进行了探究。
【查阅资料】碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体。
【实验装置设计】甲、乙、丙小组同学分别设计如图装置:
【讨论与探究】
(1)甲小组实验中,化学反应的方程式是: ,该实验可观察到现象是 如果玻璃管上端没有系小气球,将可能出现的后果是 。
(2)请根据乙组和丙组设计的““质量守恒定律””的实验装置进行探究,并按要求完成乙组和丙组。乙组实验可观察到天平的指针向 (填“左”或“右”)偏;请你解释产生该现象的原因是 。
丙组过氧化氢溶液分解反应前后各物质质量总和的测定,得出参加化学反应的各物质的质量总和 (填“大于”、“等于”或“小于”)反应后生成的各物质的质量总和。
(3)【实验分析】请从原子的角度解释化学反应前后质量守恒的原因 。
(4)【反思与交流】通过对以甲、乙、丙小组实验的探究,你得到的启示是 。
14.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图1)。
(1)请写出镁条与氧气反应的化学方程式 其基本反应类型 。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是 。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
【做出猜想】黄色固体为Mg3N2
【实验探究】
实验操作
实验现象及结论
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住
小烧杯A和B。
现象: 。
结论:燃烧产物中含Mg3N2
【反思与交流】
①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释。 。
②空气中N 2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释 。
【拓展延伸】
①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数 (填“大于”、“小于”或“等于”)。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量取值范围 。
15.在“质量守恒定律”的课堂教学中,老师引导同学们进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以A、B、C、D表示如图:
A、B、C、D四个实验分别由甲、乙、丙、丁四个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。请回答下列问题:
(1)A实验:锥形瓶底放一层细沙的目的是: ;导管口系小气球的作用是 ;实验中,看到白磷燃烧产生大量 ,气球先 后 。待锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。发生反应的化学方程式为 。
(2)B实验:由于产生 逸出烧杯,导致天平不再平衡。
(3)C实验:看到铁钉表面有 生成,同时溶液由 色变成 色。反应前后,天平保持平衡。发生反应的化学方程式为 。
(4)D实验:镁条在空气中点燃后,发出 ,生成白色固体。反应后称量,天平不平衡。反应的化学方程式为 。
(5)四位同学认真分析实验,一致认为有气体参加或有气体生成的反应,要验证质量守恒定律,实验必须在 中进行。
16.甲、乙、丙三组同学从不同的角度研究质量守恒定律。
(1)甲组研究反应:2H2+O22H2O,他们从该反应中获取的信息有:
①该反应的反应物是氢气和氧气;
②该化学反应的条件是点燃;
③在化学反应前后元素种类和原子个数不变;
④ ;⑤ 。
(2)乙、丙两组同学分别设计了如图实验,图中试剂混合前后物质的总质量分别表示为m(前)、m(后)。请根据图示回答:
①乙组实验中,m(前)>m(后),原因是 ,若所用试剂不变,改进的方法是 。
②丙组实验中的反应是否符合质量守恒定律? (填“符合”或“不符合”)。
③丙组实验中有时会岀现:红磷燃烧后,瓶塞突然“冲岀”瓶口,请你分析岀现此现象的可能原因,并对实验装置进行改进以避免这种现象发生。
可能原因: 。
改进实验装置: 。
17.为了验证质量守恒定律,同学们设计了“稀盐酸和碳酸钠粉末反应前后质量测定”实验,如图所示。请你和大家一起进行探究:
(1)按如图方式实验,将烧杯倾斜,使稀盐酸与碳酸钠粉末接触。该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是(填序号)。
A
B
C
D
稀盐酸加入碳酸钠粉末前称量/g
86.5
86.8
84.8
86.5
稀盐酸加入碳酸钠粉末后称量/g
86.5
81.6
79.7
87.8
(2)小华发现反应停止后天平指针向右偏转,请你帮助她分析原因可能是 ,该反应(填“遵守”或“不遵守”)质量守恒定律。
(3)在老师启发下,同学们认识到要通过该实验验证质量守恒定律,反应必须在 的容器中进行。
参考答案
一.选择题(共12小题)
1.【解答】解:8.8gCO2中含有碳元素的质量为:8.8g××100%=2.4g,5.4g水中含有氢元素的质量为:5.4g××100%=0.6g,生成物8.8g二氧化碳和5.4g水中所含碳、氢元素的质量和=2.4g+0.6g=3g,4.6g>3g,该物质中含氧元素的质量为:4.6g﹣3g=1.6g,则该物质中一定含有碳、氢、氧三种元素。
故选:C。
2.【解答】解:由表中数据分析可知,反应前后甲的质量减少了20g﹣4g=16g,故是反应物,参加反应的质量为16g;同理可以确定丙是生成物,生成的质量为28g﹣8g=20g;丁的质量减少,是反应物,参加反应的质量6g﹣2g=4g;由质量守恒定律,乙的质量应不变,可能作该反应的催化剂,也可能没有参加反应;故待测的数值为2g。
A、反应物的质量比为16g:4g=4:1,铜与氧气反应的化学方程式为2Cu+O22CuO,铜与氧气的质量比为128:32=4:1,该反应可能是铜与氧气的反应,故选项说法正确。
B、乙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
C、反应中甲和丙的质量比为16g:20g=4:5,故选项说法错误。
D、该反应的反应物为甲和丁,生成物是丙,符合“多变一”的形式,属于化合反应,丙是化合反应的生成物,一定是化合物,故选项说法错误。
故选:A。
3.【解答】解:化学变化有其它物质生成,则⑤物质的种类一定会发生变化。根据质量守恒定律可知,化学反应前后,④物质的质量总和不变。
化学变化的实质是分子分成原子,原子再重新组合成新的分子,则①原子的数目、⑦原子的质子数一定没有变化;在化学反应前后③元素的种类不变。⑥分子的种类一定会发生改变。②分子的数目可能发生改变,也可能不变。
故①③④⑦在化学反应前后,肯定没有变化。
故选:B。
4.【解答】解:4.4gCO2中含有碳元素的质量为:4.4g××100%=1.2g,1.8g水中含有氢元素的质量为:3.6g××100%=0.4g,生成物4.4g二氧化碳和3.6g水中所含碳、氢元素的质量和=1.2g+0.4g=1.6g,1.6g=1.6g,则该物质中一定含有碳、氢两种元素,一定不含氧元素。
A、由上述分析可知,该化合物中含碳元素1.2g,故选项说法正确。
B、由上述分析可知,该物质中一定不含氧元素,故选项说法错误。
C、碳、氢原子个数比是:=1:4,故选项说法正确。
D、由上述分析可知,该化合物只含有C、H两种元素,不含O元素,故选项说法正确。
故选:B。
5.【解答】解:A、不能加热锥形瓶引燃红磷,该选项说法不正确;
B、红磷下方细沙的作用是隔热,以防止锥形瓶炸裂,该选项说法正确;
C、系有气球的玻璃管可缓冲气压,以防止瓶塞飞出,保证安全,该选项说法正确;
D、实验后天平指针右偏,可能是橡胶塞未塞紧,红磷燃烧产生的白烟部分逸散出去了,该选项说法正确。
故选:A。
6.【解答】解:反应前一段时间锰元素在固体中的质量分数不变,反应后氯酸钾分解生成氯化钾和氧气,固体质量减小,锰元素质量不变,因此锰元素在固体中的质量分数增大,完全反应后固体质量不变,锰元素在固体中的质量分数不变,因此B选项锰元素在固体中的质量分数随时间的变化关系正确。
故选:B。
7.【解答】解:根据质量守恒定律可以判断在有机物中一定含有碳元素和氢元素,其中碳元素的质量为:8.8g×=2.4g;氢元素的质量为:3.6g×=0.4g,2.4g+0.4g=2.8g,与有机物的质量相等,所以该有机物中只含有碳元素和氢元素,没有氧元素,其中碳元素和氢元素的质量比为:2.4g:0.4g=6:1;
故选:D。
8.【解答】解:该物质燃烧能生成水和二氧化碳,根据质量守恒定律:化学反应前后元素的种类不变,故该物质中一定含有碳元素和氢元素,氧元素有可能来自于氧气。
故选:C。
9.【解答】解:有反应2A+5B=C+2D,A、B两种物质完全反应时的质量比为4:3,由质量守恒定律,参加反应的A和B的质量之和等于生成C和D的质量之和,则参加反应的A和B的质量之和为280g,反应消耗B的质量为280g×=120g。
故选:A。
10.【解答】解:镁燃烧时,和氧气反应生成氧化镁,生成物质量大于反应的镁的质量,因此N<M。
故选:B。
11.【解答】解:A、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,不含碳元素,不能生成碳酸钙,故选项错误。
B、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,可能生成Ca(OH)2和O2,故选项正确。
C、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,不含氯元素,不能生成氯化钙,故选项错误。
D、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,不含氮元素,不能生成Ca(NO3)2,故选项错误。
故选:B。
12.【解答】解:由表中数据分析可知,反应前后甲的质量减少了64g﹣0g=64g,故是反应物,参加反应的质量为64g;同理可以确定乙是生成物,生成的质量为42g﹣10g=32g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;由质量守恒定律,丁应是生成物,且生成的质量为64g﹣32g=32g,故a的数值为32g+16g=48g。
A、甲有64克参加反应,一定是反应物,故选项说法正确。
B、乙反应后质量增多,一定是生成物,故选项说法正确。
C、丙反应前后质量不变,可能能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
D、丁反应后的质量a=48克,故选项说法正确。
故选:C。
二.实验探究题(共5小题)
13.【解答】解:(1)甲小组实验中,红磷燃烧生成五氧化二磷,化学反应的方程式是:4P+5O22P2O5,该实验可观察到现象是白磷燃烧,产生白烟,小气球先胀大后缩得比原来更小,如果玻璃管上端没有系小气球,将可能出现的后果是瓶塞飞出。
故填:4P+5O22P2O5;白磷燃烧,产生白烟,小气球先胀大后缩得比原来更小;瓶塞飞出。
(2)乙组实验可观察到天平的指针向右偏,该现象的原因是碳酸钠和盐酸反应生成的二氧化碳逸出装置。
丙组过氧化氢溶液分解反应前后各物质质量总和的测定,得出参加化学反应的各物质的质量总和 等于反应后生成的各物质质量总和。
故填:右;碳酸钠和盐酸反应生成的二氧化碳逸出装置;等于。
(3)从原子的角度可知,化学反应前后质量守恒的原因是反应前后原子种类、个数、质量都不变。
故填:反应前后原子种类、个数、质量都不变。
(4)通过对以甲、乙、丙小组实验的探究,得到的启示是验证质量守恒定律时,如果有气体参加,应该在密闭容器中进行。
故填:验证质量守恒定律时,如果有气体参加,应该在密闭容器中进行。
14.【解答】解:(1)镁和氧气在点燃的条件下生成氧化镁,配平即可,属于化合反应;故答案为:2Mg+O22MgO;化合反应;
(2)镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是:部分生成的产物氧化镁散失到空气中;故答案为:部分生成的产物氧化镁散失到空气中;
(3)【实验探究】如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B;现象:A中酚酞溶液变红色;结论:燃烧产物中含Mg3N2;故答案为:A中酚酞溶液变红色;
【反思与交流】①在发生化学反应前后各物质的质量总和相等的原因是:化学反应的本质是原子重新组合的过程,反应前后原子种类、数目、质量不变;②空气中N 2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,因为氮气化学性质不如氧气活泼;故答案为:①化学反应的本质是原子重新组合的过程,反应前后原子种类、数目、质量不变;②氮气化学性质不如氧气活泼;
【拓展延伸】①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数大于五分之一,因为氮气参加的反应;②采用极限法,2.40g镁条在氧气中完全燃烧,生成氧化镁的质量是4g;2.40g镁条在氮气中完全燃烧,生成氮化镁的质量是3.33g;故答案为:①大于;②大于3.33g小于4g;
15.【解答】解:(1)白磷燃烧产生的热量使锥形瓶底部炸裂,因此锥形瓶底放层细沙;为防止白磷燃烧产生的热量把橡皮塞冲出,因此加一个小气球,起到缓冲的作用;因为白磷刚引燃时,装置内气体受热膨胀将气球胀大,冷却后气球缩小,化学方程式为:4P+5O22P2O5;
(2)B实验中碳酸钠与盐酸反应生成氯化钠、水和二氧化碳;由于产生二氧化碳气体逸出烧杯,导致天平不再平衡。
(3)在乙同学实验中观察到的现象是铁钉表面有一层红色物质,溶液由蓝色变成浅绿色,反应后,总质量不变,天平指针指向刻度盘的中间,铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
(4)由于镁条燃烧时发出耀眼的白光,产生的白烟扩散到空气中,剩余物的质量减少;化学方程式为:2Mg+O22MgO;
(5)在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在密闭装置中进行。
故答案为:(1)防止集气瓶底炸裂;平衡(或调节)压强的变化,防止实验中胶塞弹出来;白烟;胀大(膨胀);缩小;4P+5O22P2O5;
(2)气体(或二氧化碳气体)
(3)红色;蓝;浅绿色;Fe+CuSO4═FeSO4+Cu;(4)耀眼的白光;2Mg+O22MgO;
(5)密闭容器(或装置)
16.【解答】解:(1)根据化学方程式的含义可知,从化学方程式中还可以看出,④反应的生成物是水,⑤2个氢气分子和1个氧气分子化合生成2个水分子;
(2)①由于乙装置是敞口的装置,产生的二氧化碳从烧杯中逸散出去,总质量减少;改进此装置的方法是:将烧杯改成密闭容器;
②红磷和氧气在点燃的条件下生成五氧化二磷,化学反应前后,天平平衡,所以丙组实验中的反应符合质量守恒定律;
③红磷燃烧后,瓶塞突然“冲岀”瓶口,
可能原因:红磷燃烧放出热量,装置内的气压增大;
改进实验装置:在玻璃管上装一个气球。
故答案为:(1)④反应的生成物是水;
⑤2个氢气分子和1个氧气分子化合生成2个水分子;
(2)①二氧化碳气体逸出,将烧杯改成密闭容器;
②符合;
③红磷燃烧放出热量,装置内的气压增大;
在玻璃管上装一个气球。
17.【解答】解:(1)因为碳酸钠和稀盐酸反应生成二氧化碳、水和氯化钠,烧杯内剩余物质的质量应该减少,所以其中有问题的两组数据是AD;
(2)小华发现反应停止后天平指针向右偏转,原因是:左盘烧杯内碳酸钠和稀盐酸反应生成的二氧化碳散逸到空气中,使左盘质量减轻,该反应遵守质量守恒定律;
(3)在老师启发下,同学们认识到要通过该实验验证质量守恒定律,反应必须在密闭容器内进行。
故答案为:
(1)AD;
(2)生成气体逸散到空气中;遵守;
(3)密封。
一.选择题(共12小题)
1.在空气中完全燃烧4.6g某纯净物生成8.8gCO2和5.4gH2O,则该纯净物的组成中( )
A.只有C元素 B.只有C、H元素
C.只有C、H、O元素 D.都不正确
2.在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后备物质的质量如下表:
物质
甲
乙
丙
丁
反应前质量/g
20
2
8
6
反应后质量/g
4
待测
28
2
对该反应,下列描述中正确的是( )
A.该反应可能是铜与氧气的反应
B.乙一定是该反应的催化剂
C.反应中甲和丙的质量比为1:7
D.丙一定是单质
3.在化学反应前后,下列各项肯定不会变化的是( )
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥分子的种类 ⑦原子的质子数
A.只有②④⑤⑥ B.只有①③④⑦ C.只有①④⑥ D.只有①③⑤
4.用燃烧法测定某化合物的组成。现取1.6g某化合物在足量氧气中充分燃烧,生成4.4gCO2和3.6gH2O下列说法中错误的是( )
A.该化合物中含碳元素1.2g
B.该化合物中可能含氧元素
C.碳、氢原子个数比是1:4
D.该化合物只含有C、H两种元素,不含O元素
5.用如图装置测定红磷燃烧前后的质量关系,下列有关说法错误的是( )
A.加热锥形瓶引燃红磷
B.红磷下方细沙的作用是隔热
C.系有气球的玻璃管可缓冲气压,保证安全
D.实验后天平指针右偏可能是橡胶塞未塞紧
6.用氯酸钾与二氧化锰混合加热制氧气的过程中,锰元素在固体中的质量分数随时间的变化关系正确的是( )
A. B.
C. D.
7.某物质2.8g完全燃烧,生成8.8g CO2和3.6g H2O,下列说法正确的是( )
A.该物质一定含碳、氢、氧元素
B.该物质一定含碳、氢元素,可能含氧元素
C.该物质的元素组成无法确定
D.该物质由碳、氢元素组成,且碳、氢元素的质量比为6:1
8.某纯净物R在空气中燃烧生成水和二氧化碳两种物质,关于该纯净物的组成说法正确的是( )
A.R中只含有碳、氢两种元素
B.R中一定含碳、氢、氧三种元素
C.R中一定含碳、氢两种元素,可能含有氧元素
D.无法判断
9.有反应2A+5B=C+2D,A、B两种物质完全反应时的质量比为4:3,若生成C和D共280g,则反应消耗B的质量为( )
A.120g B.160g C.90g D.240g
10.点燃一条质量为N的镁带,燃烧后将生成物和未燃烧的部分收集起来,其质量为M,则N与M的大小关系是( )
A.N=M B.N<M C.N>M D.无法判断
11.在运输鱼的过程中,可以在水中加入过氧化钙(CaO2)作为制氧剂,它与水反应后的生成物可能是( )
A.CaCO3和H2 B.Ca(OH)2和O2
C.CaCl2和O2 D.Ca(NO3)2和CO2
12.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下发生反应,测得反应前后各物质的质量如下表所示,则以下判断错误的是( )
物质
甲
乙
丙
丁
反应前质量/g
64
10
1
16
反应后质量/g
0
42
1
a
A.甲有64克参加反应,一定是反应物
B.乙反应后质量增多,一定是生成物
C.丙反应前后质量不变,一定是催化剂
D.丁反应后的质量a=48克
二.实验探究题(共5小题)
13.初三某化学兴趣小组同学依据教材实验对化学反应前后质量变化进行了探究。
【查阅资料】碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体。
【实验装置设计】甲、乙、丙小组同学分别设计如图装置:
【讨论与探究】
(1)甲小组实验中,化学反应的方程式是: ,该实验可观察到现象是 如果玻璃管上端没有系小气球,将可能出现的后果是 。
(2)请根据乙组和丙组设计的““质量守恒定律””的实验装置进行探究,并按要求完成乙组和丙组。乙组实验可观察到天平的指针向 (填“左”或“右”)偏;请你解释产生该现象的原因是 。
丙组过氧化氢溶液分解反应前后各物质质量总和的测定,得出参加化学反应的各物质的质量总和 (填“大于”、“等于”或“小于”)反应后生成的各物质的质量总和。
(3)【实验分析】请从原子的角度解释化学反应前后质量守恒的原因 。
(4)【反思与交流】通过对以甲、乙、丙小组实验的探究,你得到的启示是 。
14.某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图1)。
(1)请写出镁条与氧气反应的化学方程式 其基本反应类型 。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是 。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
【做出猜想】黄色固体为Mg3N2
【实验探究】
实验操作
实验现象及结论
如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住
小烧杯A和B。
现象: 。
结论:燃烧产物中含Mg3N2
【反思与交流】
①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释。 。
②空气中N 2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释 。
【拓展延伸】
①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数 (填“大于”、“小于”或“等于”)。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量取值范围 。
15.在“质量守恒定律”的课堂教学中,老师引导同学们进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以A、B、C、D表示如图:
A、B、C、D四个实验分别由甲、乙、丙、丁四个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。请回答下列问题:
(1)A实验:锥形瓶底放一层细沙的目的是: ;导管口系小气球的作用是 ;实验中,看到白磷燃烧产生大量 ,气球先 后 。待锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。发生反应的化学方程式为 。
(2)B实验:由于产生 逸出烧杯,导致天平不再平衡。
(3)C实验:看到铁钉表面有 生成,同时溶液由 色变成 色。反应前后,天平保持平衡。发生反应的化学方程式为 。
(4)D实验:镁条在空气中点燃后,发出 ,生成白色固体。反应后称量,天平不平衡。反应的化学方程式为 。
(5)四位同学认真分析实验,一致认为有气体参加或有气体生成的反应,要验证质量守恒定律,实验必须在 中进行。
16.甲、乙、丙三组同学从不同的角度研究质量守恒定律。
(1)甲组研究反应:2H2+O22H2O,他们从该反应中获取的信息有:
①该反应的反应物是氢气和氧气;
②该化学反应的条件是点燃;
③在化学反应前后元素种类和原子个数不变;
④ ;⑤ 。
(2)乙、丙两组同学分别设计了如图实验,图中试剂混合前后物质的总质量分别表示为m(前)、m(后)。请根据图示回答:
①乙组实验中,m(前)>m(后),原因是 ,若所用试剂不变,改进的方法是 。
②丙组实验中的反应是否符合质量守恒定律? (填“符合”或“不符合”)。
③丙组实验中有时会岀现:红磷燃烧后,瓶塞突然“冲岀”瓶口,请你分析岀现此现象的可能原因,并对实验装置进行改进以避免这种现象发生。
可能原因: 。
改进实验装置: 。
17.为了验证质量守恒定律,同学们设计了“稀盐酸和碳酸钠粉末反应前后质量测定”实验,如图所示。请你和大家一起进行探究:
(1)按如图方式实验,将烧杯倾斜,使稀盐酸与碳酸钠粉末接触。该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是(填序号)。
A
B
C
D
稀盐酸加入碳酸钠粉末前称量/g
86.5
86.8
84.8
86.5
稀盐酸加入碳酸钠粉末后称量/g
86.5
81.6
79.7
87.8
(2)小华发现反应停止后天平指针向右偏转,请你帮助她分析原因可能是 ,该反应(填“遵守”或“不遵守”)质量守恒定律。
(3)在老师启发下,同学们认识到要通过该实验验证质量守恒定律,反应必须在 的容器中进行。
参考答案
一.选择题(共12小题)
1.【解答】解:8.8gCO2中含有碳元素的质量为:8.8g××100%=2.4g,5.4g水中含有氢元素的质量为:5.4g××100%=0.6g,生成物8.8g二氧化碳和5.4g水中所含碳、氢元素的质量和=2.4g+0.6g=3g,4.6g>3g,该物质中含氧元素的质量为:4.6g﹣3g=1.6g,则该物质中一定含有碳、氢、氧三种元素。
故选:C。
2.【解答】解:由表中数据分析可知,反应前后甲的质量减少了20g﹣4g=16g,故是反应物,参加反应的质量为16g;同理可以确定丙是生成物,生成的质量为28g﹣8g=20g;丁的质量减少,是反应物,参加反应的质量6g﹣2g=4g;由质量守恒定律,乙的质量应不变,可能作该反应的催化剂,也可能没有参加反应;故待测的数值为2g。
A、反应物的质量比为16g:4g=4:1,铜与氧气反应的化学方程式为2Cu+O22CuO,铜与氧气的质量比为128:32=4:1,该反应可能是铜与氧气的反应,故选项说法正确。
B、乙的质量不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
C、反应中甲和丙的质量比为16g:20g=4:5,故选项说法错误。
D、该反应的反应物为甲和丁,生成物是丙,符合“多变一”的形式,属于化合反应,丙是化合反应的生成物,一定是化合物,故选项说法错误。
故选:A。
3.【解答】解:化学变化有其它物质生成,则⑤物质的种类一定会发生变化。根据质量守恒定律可知,化学反应前后,④物质的质量总和不变。
化学变化的实质是分子分成原子,原子再重新组合成新的分子,则①原子的数目、⑦原子的质子数一定没有变化;在化学反应前后③元素的种类不变。⑥分子的种类一定会发生改变。②分子的数目可能发生改变,也可能不变。
故①③④⑦在化学反应前后,肯定没有变化。
故选:B。
4.【解答】解:4.4gCO2中含有碳元素的质量为:4.4g××100%=1.2g,1.8g水中含有氢元素的质量为:3.6g××100%=0.4g,生成物4.4g二氧化碳和3.6g水中所含碳、氢元素的质量和=1.2g+0.4g=1.6g,1.6g=1.6g,则该物质中一定含有碳、氢两种元素,一定不含氧元素。
A、由上述分析可知,该化合物中含碳元素1.2g,故选项说法正确。
B、由上述分析可知,该物质中一定不含氧元素,故选项说法错误。
C、碳、氢原子个数比是:=1:4,故选项说法正确。
D、由上述分析可知,该化合物只含有C、H两种元素,不含O元素,故选项说法正确。
故选:B。
5.【解答】解:A、不能加热锥形瓶引燃红磷,该选项说法不正确;
B、红磷下方细沙的作用是隔热,以防止锥形瓶炸裂,该选项说法正确;
C、系有气球的玻璃管可缓冲气压,以防止瓶塞飞出,保证安全,该选项说法正确;
D、实验后天平指针右偏,可能是橡胶塞未塞紧,红磷燃烧产生的白烟部分逸散出去了,该选项说法正确。
故选:A。
6.【解答】解:反应前一段时间锰元素在固体中的质量分数不变,反应后氯酸钾分解生成氯化钾和氧气,固体质量减小,锰元素质量不变,因此锰元素在固体中的质量分数增大,完全反应后固体质量不变,锰元素在固体中的质量分数不变,因此B选项锰元素在固体中的质量分数随时间的变化关系正确。
故选:B。
7.【解答】解:根据质量守恒定律可以判断在有机物中一定含有碳元素和氢元素,其中碳元素的质量为:8.8g×=2.4g;氢元素的质量为:3.6g×=0.4g,2.4g+0.4g=2.8g,与有机物的质量相等,所以该有机物中只含有碳元素和氢元素,没有氧元素,其中碳元素和氢元素的质量比为:2.4g:0.4g=6:1;
故选:D。
8.【解答】解:该物质燃烧能生成水和二氧化碳,根据质量守恒定律:化学反应前后元素的种类不变,故该物质中一定含有碳元素和氢元素,氧元素有可能来自于氧气。
故选:C。
9.【解答】解:有反应2A+5B=C+2D,A、B两种物质完全反应时的质量比为4:3,由质量守恒定律,参加反应的A和B的质量之和等于生成C和D的质量之和,则参加反应的A和B的质量之和为280g,反应消耗B的质量为280g×=120g。
故选:A。
10.【解答】解:镁燃烧时,和氧气反应生成氧化镁,生成物质量大于反应的镁的质量,因此N<M。
故选:B。
11.【解答】解:A、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,不含碳元素,不能生成碳酸钙,故选项错误。
B、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,可能生成Ca(OH)2和O2,故选项正确。
C、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,不含氯元素,不能生成氯化钙,故选项错误。
D、过氧化钙(CaO2)与水中含有钙、氧、氢三种元素,不含氮元素,不能生成Ca(NO3)2,故选项错误。
故选:B。
12.【解答】解:由表中数据分析可知,反应前后甲的质量减少了64g﹣0g=64g,故是反应物,参加反应的质量为64g;同理可以确定乙是生成物,生成的质量为42g﹣10g=32g;丙的质量不变,可能作该反应的催化剂,也可能没有参加反应;由质量守恒定律,丁应是生成物,且生成的质量为64g﹣32g=32g,故a的数值为32g+16g=48g。
A、甲有64克参加反应,一定是反应物,故选项说法正确。
B、乙反应后质量增多,一定是生成物,故选项说法正确。
C、丙反应前后质量不变,可能能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
D、丁反应后的质量a=48克,故选项说法正确。
故选:C。
二.实验探究题(共5小题)
13.【解答】解:(1)甲小组实验中,红磷燃烧生成五氧化二磷,化学反应的方程式是:4P+5O22P2O5,该实验可观察到现象是白磷燃烧,产生白烟,小气球先胀大后缩得比原来更小,如果玻璃管上端没有系小气球,将可能出现的后果是瓶塞飞出。
故填:4P+5O22P2O5;白磷燃烧,产生白烟,小气球先胀大后缩得比原来更小;瓶塞飞出。
(2)乙组实验可观察到天平的指针向右偏,该现象的原因是碳酸钠和盐酸反应生成的二氧化碳逸出装置。
丙组过氧化氢溶液分解反应前后各物质质量总和的测定,得出参加化学反应的各物质的质量总和 等于反应后生成的各物质质量总和。
故填:右;碳酸钠和盐酸反应生成的二氧化碳逸出装置;等于。
(3)从原子的角度可知,化学反应前后质量守恒的原因是反应前后原子种类、个数、质量都不变。
故填:反应前后原子种类、个数、质量都不变。
(4)通过对以甲、乙、丙小组实验的探究,得到的启示是验证质量守恒定律时,如果有气体参加,应该在密闭容器中进行。
故填:验证质量守恒定律时,如果有气体参加,应该在密闭容器中进行。
14.【解答】解:(1)镁和氧气在点燃的条件下生成氧化镁,配平即可,属于化合反应;故答案为:2Mg+O22MgO;化合反应;
(2)镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是:部分生成的产物氧化镁散失到空气中;故答案为:部分生成的产物氧化镁散失到空气中;
(3)【实验探究】如图,取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B;现象:A中酚酞溶液变红色;结论:燃烧产物中含Mg3N2;故答案为:A中酚酞溶液变红色;
【反思与交流】①在发生化学反应前后各物质的质量总和相等的原因是:化学反应的本质是原子重新组合的过程,反应前后原子种类、数目、质量不变;②空气中N 2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,因为氮气化学性质不如氧气活泼;故答案为:①化学反应的本质是原子重新组合的过程,反应前后原子种类、数目、质量不变;②氮气化学性质不如氧气活泼;
【拓展延伸】①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数大于五分之一,因为氮气参加的反应;②采用极限法,2.40g镁条在氧气中完全燃烧,生成氧化镁的质量是4g;2.40g镁条在氮气中完全燃烧,生成氮化镁的质量是3.33g;故答案为:①大于;②大于3.33g小于4g;
15.【解答】解:(1)白磷燃烧产生的热量使锥形瓶底部炸裂,因此锥形瓶底放层细沙;为防止白磷燃烧产生的热量把橡皮塞冲出,因此加一个小气球,起到缓冲的作用;因为白磷刚引燃时,装置内气体受热膨胀将气球胀大,冷却后气球缩小,化学方程式为:4P+5O22P2O5;
(2)B实验中碳酸钠与盐酸反应生成氯化钠、水和二氧化碳;由于产生二氧化碳气体逸出烧杯,导致天平不再平衡。
(3)在乙同学实验中观察到的现象是铁钉表面有一层红色物质,溶液由蓝色变成浅绿色,反应后,总质量不变,天平指针指向刻度盘的中间,铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
(4)由于镁条燃烧时发出耀眼的白光,产生的白烟扩散到空气中,剩余物的质量减少;化学方程式为:2Mg+O22MgO;
(5)在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在密闭装置中进行。
故答案为:(1)防止集气瓶底炸裂;平衡(或调节)压强的变化,防止实验中胶塞弹出来;白烟;胀大(膨胀);缩小;4P+5O22P2O5;
(2)气体(或二氧化碳气体)
(3)红色;蓝;浅绿色;Fe+CuSO4═FeSO4+Cu;(4)耀眼的白光;2Mg+O22MgO;
(5)密闭容器(或装置)
16.【解答】解:(1)根据化学方程式的含义可知,从化学方程式中还可以看出,④反应的生成物是水,⑤2个氢气分子和1个氧气分子化合生成2个水分子;
(2)①由于乙装置是敞口的装置,产生的二氧化碳从烧杯中逸散出去,总质量减少;改进此装置的方法是:将烧杯改成密闭容器;
②红磷和氧气在点燃的条件下生成五氧化二磷,化学反应前后,天平平衡,所以丙组实验中的反应符合质量守恒定律;
③红磷燃烧后,瓶塞突然“冲岀”瓶口,
可能原因:红磷燃烧放出热量,装置内的气压增大;
改进实验装置:在玻璃管上装一个气球。
故答案为:(1)④反应的生成物是水;
⑤2个氢气分子和1个氧气分子化合生成2个水分子;
(2)①二氧化碳气体逸出,将烧杯改成密闭容器;
②符合;
③红磷燃烧放出热量,装置内的气压增大;
在玻璃管上装一个气球。
17.【解答】解:(1)因为碳酸钠和稀盐酸反应生成二氧化碳、水和氯化钠,烧杯内剩余物质的质量应该减少,所以其中有问题的两组数据是AD;
(2)小华发现反应停止后天平指针向右偏转,原因是:左盘烧杯内碳酸钠和稀盐酸反应生成的二氧化碳散逸到空气中,使左盘质量减轻,该反应遵守质量守恒定律;
(3)在老师启发下,同学们认识到要通过该实验验证质量守恒定律,反应必须在密闭容器内进行。
故答案为:
(1)AD;
(2)生成气体逸散到空气中;遵守;
(3)密封。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
