沪教版九年级化学上册 第4章复习—质量守恒定律及其应用(课件)(共19张PPT)
文档属性
| 名称 | 沪教版九年级化学上册 第4章复习—质量守恒定律及其应用(课件)(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 8.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-11 00:00:00 | ||
图片预览





文档简介
课件19张PPT。以不变应万变
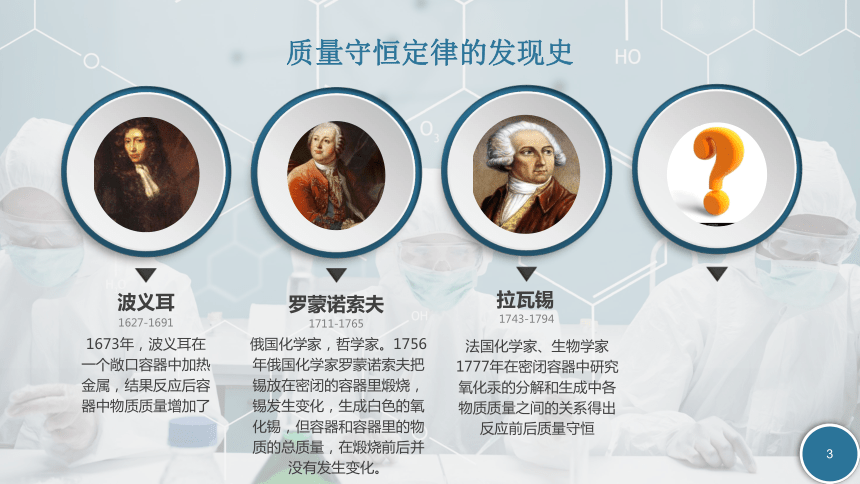
——质量守恒定律及应用发现史内容理解应用质量守恒定律波义耳1627-16911673年,波义耳在一个敞口容器中加热金属,结果反应后容器中物质质量增加了罗蒙诺索夫1711-1765俄国化学家,哲学家。1756年俄国化学家罗蒙诺索夫把锡放在密闭的容器里煅烧,锡发生变化,生成白色的氧化锡,但容器和容器里的物质的总质量,在煅烧前后并没有发生变化。拉瓦锡1743-1794法国化学家、生物学家1777年在密闭容器中研究氧化汞的分解和生成中各物质质量之间的关系得出反应前后质量守恒质量守恒定律的发现史内容参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和元素种类元素质量物质总质量原子种类原子数目原子质量宏观质量守恒定律的理解(反应前后六个一定不变)微观思考:你还知道反应前后两个一定改变吗?物质的种类
分子的种类物质的成分或化学式的推断------元素种类和质量“不变”据化学方程式推断未知物质X
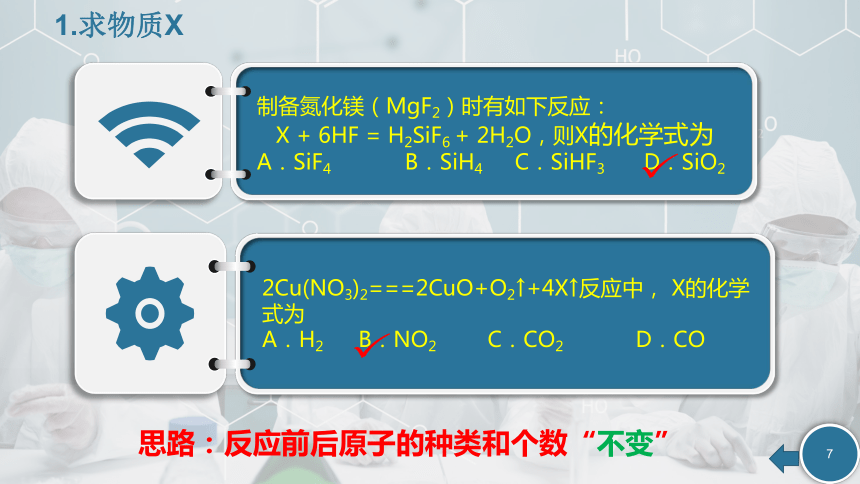
----反应前后原子的种类和个数“不变”综合计算质量守恒定律的应用微观示意图------反应前后原子的种类数目“不变”1.求物质X制备氮化镁(MgF2)时有如下反应:
X + 6HF = H2SiF6 + 2H2O,则X的化学式为
A.SiF4 B.SiH4 C.SiHF3 D.SiO22Cu(NO3)2===2CuO+O2↑+4X↑反应中, X的化学式为
A.H2 B.NO2 C.CO2 D.CO思路:反应前后原子的种类和个数“不变”2.微观示意图某反应前后现象的描述正确的是A.反应物与生成物共有3种物质
B.反应后原子个数增多
C.该图可示意CO与O2反应 D.反应物中元素的化合价都为02.微观示意图已知反应前后分子变化的微观示意图如下所示。下列说法正确的是A.此反应中有三种氧化物
B.此反应中反应物的质量比是1:2
C.该反应是置换反应
D.反应前后原子的种类和个数都不变思路:1.分子由原子构成
2.反应前后原子的种类和个数不变
3.若给出了具体的原子种类,先写出对应
的化学方程式,再进行正确的判断 3.物质的成分或化学式的推断某温度下,Fe(OH)3分解得到一种铁、氧质量比为21∶8的氧化物,该氧化物的化学式是 六硅酸镁可表示为aMgO·6SiO2·bH2O。确定六硅酸镁组成的方法是:取10.6 g六硅酸镁,充分加热失水后,得固体8.8 g;另取相同质量的六硅酸镁加入足量盐酸,充分反应后,经处理得SiO2固体7.2 g。下列说法正确的是
A.a = 2 B.a = 3 C.b = 5 D.b = 7Fe3O4将一定量xFeSO4?y(NH4)2SO4?6H2O晶体加入到过量NaOH溶液中,加热生成NH30.85g(假如生成NH3的全部逸出),过滤、洗涤、灼烧,得Fe2O3固体2.0g.则x,y的关系正确的是( )A.x:y=1:1 B.x:y=1:2 C.x:y=1:4 D.x:y=2:1 1.元素或物质的组成
2.根据质量关系(守恒)求出元素或物质
质量
3.根据元素质量比求出不同原子的个数比
或据 物质的质量比求出计量数之比 判断物质的化学式或求计量数之比的常见思路4.综合计算Fe2O3、ZnO、CuO的固体混合粉末a g,在加热条件下用足量的CO还原,得到金属粉末混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀,则a的数值为( )
A 7.41 B 3.59 C 3.21 D 2.46 其实汗水和收获也是“守恒”的,付出与回报总是“平衡”的。只要善于发现生活和学习的”美”,不断努力,一定会实现自己的目标!结束语 质量守恒定律的题型多样,但无论怎么变化,只要我们抓住“守恒”,找到正确的质量关系就能“以不变应万变”。
已知铁元素与氧元素 mFe:mO=21:8
该氧化物的化学式为Fe3O4解析过程则Fe原子、O原子的个数比:
解题思路aMgO·6SiO2·bH2O①取10.6 g六硅酸镁,充分加热失水后,得固体8.8 g
可得其中mH2O=(10.6g - 8.8g)=1.8g②另取10.6g六硅酸镁加入足量盐酸,充分反应后,经处理得SiO2固体7.2 g 可得其中mSiO2=7.2g③晶体中mMgO=(10.6g-1.8g-7.2g)=1.6g④
则a:b=?Fe2O3、ZnO、CuOCO金属粉末2.41g a思路某实验过程如下:取ag锡粉置于密闭容器中,称得容器和固体的总质量为bg,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为cg;取出所有固体,称得固体为dg ,则c等于
A.d+b+a B.d-b-a C.d-b+a D.d+b-a同学们,你们知道选择哪个答案吗?
——质量守恒定律及应用发现史内容理解应用质量守恒定律波义耳1627-16911673年,波义耳在一个敞口容器中加热金属,结果反应后容器中物质质量增加了罗蒙诺索夫1711-1765俄国化学家,哲学家。1756年俄国化学家罗蒙诺索夫把锡放在密闭的容器里煅烧,锡发生变化,生成白色的氧化锡,但容器和容器里的物质的总质量,在煅烧前后并没有发生变化。拉瓦锡1743-1794法国化学家、生物学家1777年在密闭容器中研究氧化汞的分解和生成中各物质质量之间的关系得出反应前后质量守恒质量守恒定律的发现史内容参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和元素种类元素质量物质总质量原子种类原子数目原子质量宏观质量守恒定律的理解(反应前后六个一定不变)微观思考:你还知道反应前后两个一定改变吗?物质的种类
分子的种类物质的成分或化学式的推断------元素种类和质量“不变”据化学方程式推断未知物质X
----反应前后原子的种类和个数“不变”综合计算质量守恒定律的应用微观示意图------反应前后原子的种类数目“不变”1.求物质X制备氮化镁(MgF2)时有如下反应:
X + 6HF = H2SiF6 + 2H2O,则X的化学式为
A.SiF4 B.SiH4 C.SiHF3 D.SiO22Cu(NO3)2===2CuO+O2↑+4X↑反应中, X的化学式为
A.H2 B.NO2 C.CO2 D.CO思路:反应前后原子的种类和个数“不变”2.微观示意图某反应前后现象的描述正确的是A.反应物与生成物共有3种物质
B.反应后原子个数增多
C.该图可示意CO与O2反应 D.反应物中元素的化合价都为02.微观示意图已知反应前后分子变化的微观示意图如下所示。下列说法正确的是A.此反应中有三种氧化物
B.此反应中反应物的质量比是1:2
C.该反应是置换反应
D.反应前后原子的种类和个数都不变思路:1.分子由原子构成
2.反应前后原子的种类和个数不变
3.若给出了具体的原子种类,先写出对应
的化学方程式,再进行正确的判断 3.物质的成分或化学式的推断某温度下,Fe(OH)3分解得到一种铁、氧质量比为21∶8的氧化物,该氧化物的化学式是 六硅酸镁可表示为aMgO·6SiO2·bH2O。确定六硅酸镁组成的方法是:取10.6 g六硅酸镁,充分加热失水后,得固体8.8 g;另取相同质量的六硅酸镁加入足量盐酸,充分反应后,经处理得SiO2固体7.2 g。下列说法正确的是
A.a = 2 B.a = 3 C.b = 5 D.b = 7Fe3O4将一定量xFeSO4?y(NH4)2SO4?6H2O晶体加入到过量NaOH溶液中,加热生成NH30.85g(假如生成NH3的全部逸出),过滤、洗涤、灼烧,得Fe2O3固体2.0g.则x,y的关系正确的是( )A.x:y=1:1 B.x:y=1:2 C.x:y=1:4 D.x:y=2:1 1.元素或物质的组成
2.根据质量关系(守恒)求出元素或物质
质量
3.根据元素质量比求出不同原子的个数比
或据 物质的质量比求出计量数之比 判断物质的化学式或求计量数之比的常见思路4.综合计算Fe2O3、ZnO、CuO的固体混合粉末a g,在加热条件下用足量的CO还原,得到金属粉末混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀,则a的数值为( )
A 7.41 B 3.59 C 3.21 D 2.46 其实汗水和收获也是“守恒”的,付出与回报总是“平衡”的。只要善于发现生活和学习的”美”,不断努力,一定会实现自己的目标!结束语 质量守恒定律的题型多样,但无论怎么变化,只要我们抓住“守恒”,找到正确的质量关系就能“以不变应万变”。
已知铁元素与氧元素 mFe:mO=21:8
该氧化物的化学式为Fe3O4解析过程则Fe原子、O原子的个数比:
解题思路aMgO·6SiO2·bH2O①取10.6 g六硅酸镁,充分加热失水后,得固体8.8 g
可得其中mH2O=(10.6g - 8.8g)=1.8g②另取10.6g六硅酸镁加入足量盐酸,充分反应后,经处理得SiO2固体7.2 g 可得其中mSiO2=7.2g③晶体中mMgO=(10.6g-1.8g-7.2g)=1.6g④
则a:b=?Fe2O3、ZnO、CuOCO金属粉末2.41g a思路某实验过程如下:取ag锡粉置于密闭容器中,称得容器和固体的总质量为bg,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为cg;取出所有固体,称得固体为dg ,则c等于
A.d+b+a B.d-b-a C.d-b+a D.d+b-a同学们,你们知道选择哪个答案吗?
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
