苏教版化学必修1专题4 硫、氮和可持续发展第一单元 含硫化合物的性质和应用 (课件 共19张PPT)
文档属性
| 名称 | 苏教版化学必修1专题4 硫、氮和可持续发展第一单元 含硫化合物的性质和应用 (课件 共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-09 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
我国古代制硫酸的方法:
?
+
+
3
2
2
SO
SO
3
O
Fe
△
4
2FeSO
?
+
3
SO
CuO
4
CuSO
△
SO3 + H2O = H2SO4
↑
↑
↑
一、硫酸的工业制法----接触法
(1)三种原料:
硫磺或含硫矿石(如:二硫化亚铁FeS2)
空气
98.3﹪的浓H2SO4
(2)三个步骤
H2SO4
SO3
SO2
S
硫化物
如 FeS2
SO3 + H2O===H2SO4
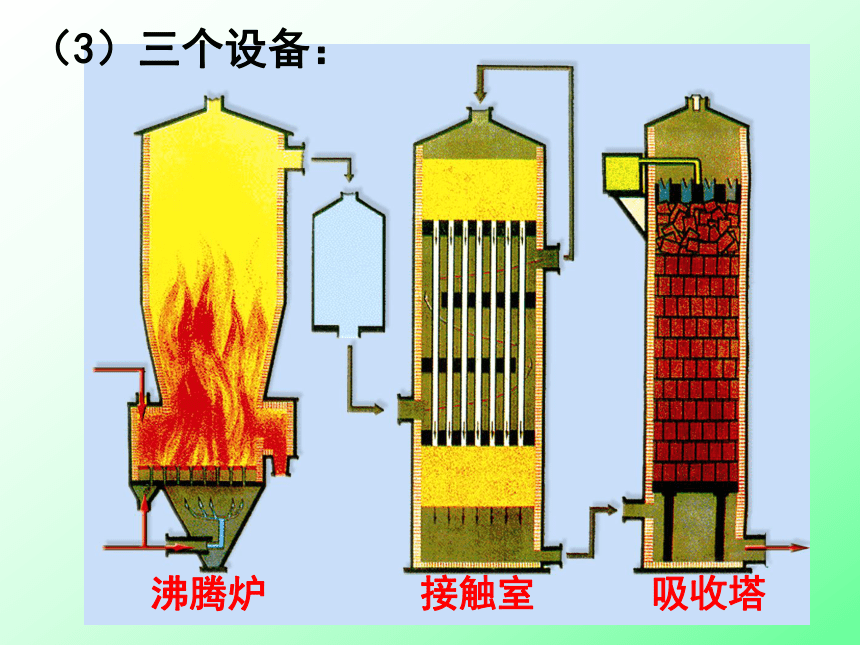
(3)三个设备:
二、硫酸的性质
(一)物理性质:
1)色味态:
2)密度:
3)溶解性:
4)沸点:
无色、无味、粘稠的油状液体
比水大
与水任意比互溶。
高(难挥发)
注:一高:
三大:
沸点
密度、溶解度、稀释放热
思考:浓硫酸的稀释?
(1)稀硫酸的化学性质——酸的通性
①与指示剂反应:
使紫色石蕊试液变红
②与H前的活泼金属反应置换出氢气:
Fe+H2SO4=FeSO4+H2↑
③与碱性氧化物反应生成盐和水:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
④与碱反应生成盐和水:
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
⑤与盐反应生成新的盐和新的酸:
BaCl2+H2SO4=BaSO4↓+2HCl
(二)硫酸的化学性质
(2)浓硫酸的特性
(2)浓硫酸的特性
1.吸水性
现象:
由蓝色晶体变为白色粉末
应用:作气体干燥剂(氯气、氢气、二氧化碳等)
注:
浓H2SO4 不可干燥 NH3、 H2S 、 SO3等
CuSO4.5H2o ===== CuSO4 + 5H2O
浓H2SO4
现象:
4)生成刺激性气味的气体。
反应:
结论:
体现出浓硫酸的脱水性和强氧化性
2H2SO4 (浓) + C == CO2↑ + 2SO2↑ + 2H2O
△
1)蔗糖变黑
2)体积膨胀
3)放出大量热
在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。
2.脱水性
3.强氧化性
(1)与非金属反应
思考?如何验证产物?
体现浓硫酸的强氧化性
(2)与金属反应
①常温:遇铁、铝钝化
②加热:与绝大多数金属反应
[实验] 在试管中放入一块铜片,加热。将生成的气体通入到品红溶液,然后加热品红溶液,把试管中反应后的溶液倒在水中稀释。
现象:
1)生成气体、品红溶液褪色,加热,恢复红色
2)试管中溶液稀释后呈蓝色
反应:
表现强氧化性、
酸性
(3)与某些化合物反应
H2SO4(浓)+H2S S + 2H2O + SO2
体现浓硫酸的强氧化性
◎硫酸在下列用途或反应中表现的性质是:
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(1)实验室制取氢气;
(2)可用作H2、SO2、Cl2等气体的干燥剂;
(3)铝制容器可盛放浓硫酸;
(4)浓硫酸能使湿润的蓝色石蕊试纸变红,后来 又变黑;
(5)浓硫酸与金属铜加热反应;
(6)将浓H2S04滴加到浓盐酸中产生白雾。
练一练
三、几种重要的硫酸盐
1、硫酸钙:石膏(或生石膏)---CaSO4·2H2O
熟石膏---2CaSO4·H2O
2、硫酸钡:俗称“重晶石”、“钡餐”、
白色颜料······
3、硫酸亚铁:FeSO4·7H2O 俗称“绿矾”
难挥发性:
用于制挥发性强酸(盐酸、硝酸)
我国古代制硫酸的方法:
?
+
+
3
2
2
SO
SO
3
O
Fe
△
4
2FeSO
?
+
3
SO
CuO
4
CuSO
△
SO3 + H2O = H2SO4
↑
↑
↑
一、硫酸的工业制法----接触法
(1)三种原料:
硫磺或含硫矿石(如:二硫化亚铁FeS2)
空气
98.3﹪的浓H2SO4
(2)三个步骤
H2SO4
SO3
SO2
S
硫化物
如 FeS2
SO3 + H2O===H2SO4
(3)三个设备:
二、硫酸的性质
(一)物理性质:
1)色味态:
2)密度:
3)溶解性:
4)沸点:
无色、无味、粘稠的油状液体
比水大
与水任意比互溶。
高(难挥发)
注:一高:
三大:
沸点
密度、溶解度、稀释放热
思考:浓硫酸的稀释?
(1)稀硫酸的化学性质——酸的通性
①与指示剂反应:
使紫色石蕊试液变红
②与H前的活泼金属反应置换出氢气:
Fe+H2SO4=FeSO4+H2↑
③与碱性氧化物反应生成盐和水:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
④与碱反应生成盐和水:
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
⑤与盐反应生成新的盐和新的酸:
BaCl2+H2SO4=BaSO4↓+2HCl
(二)硫酸的化学性质
(2)浓硫酸的特性
(2)浓硫酸的特性
1.吸水性
现象:
由蓝色晶体变为白色粉末
应用:作气体干燥剂(氯气、氢气、二氧化碳等)
注:
浓H2SO4 不可干燥 NH3、 H2S 、 SO3等
CuSO4.5H2o ===== CuSO4 + 5H2O
浓H2SO4
现象:
4)生成刺激性气味的气体。
反应:
结论:
体现出浓硫酸的脱水性和强氧化性
2H2SO4 (浓) + C == CO2↑ + 2SO2↑ + 2H2O
△
1)蔗糖变黑
2)体积膨胀
3)放出大量热
在烧杯中放入少量蔗糖,用少量水调成糊状,注入浓硫酸,用玻棒搅拌。
2.脱水性
3.强氧化性
(1)与非金属反应
思考?如何验证产物?
体现浓硫酸的强氧化性
(2)与金属反应
①常温:遇铁、铝钝化
②加热:与绝大多数金属反应
[实验] 在试管中放入一块铜片,加热。将生成的气体通入到品红溶液,然后加热品红溶液,把试管中反应后的溶液倒在水中稀释。
现象:
1)生成气体、品红溶液褪色,加热,恢复红色
2)试管中溶液稀释后呈蓝色
反应:
表现强氧化性、
酸性
(3)与某些化合物反应
H2SO4(浓)+H2S S + 2H2O + SO2
体现浓硫酸的强氧化性
◎硫酸在下列用途或反应中表现的性质是:
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(1)实验室制取氢气;
(2)可用作H2、SO2、Cl2等气体的干燥剂;
(3)铝制容器可盛放浓硫酸;
(4)浓硫酸能使湿润的蓝色石蕊试纸变红,后来 又变黑;
(5)浓硫酸与金属铜加热反应;
(6)将浓H2S04滴加到浓盐酸中产生白雾。
练一练
三、几种重要的硫酸盐
1、硫酸钙:石膏(或生石膏)---CaSO4·2H2O
熟石膏---2CaSO4·H2O
2、硫酸钡:俗称“重晶石”、“钡餐”、
白色颜料······
3、硫酸亚铁:FeSO4·7H2O 俗称“绿矾”
难挥发性:
用于制挥发性强酸(盐酸、硝酸)
