2019——2020山东省平邑县地方二中初中化学课题3 溶液的浓度巩固试卷
文档属性
| 名称 | 2019——2020山东省平邑县地方二中初中化学课题3 溶液的浓度巩固试卷 |  | |
| 格式 | zip | ||
| 文件大小 | 309.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-11 23:26:33 | ||
图片预览

文档简介
2019——2020山东省平邑县地方二中初中化学《溶液的浓度》巩固试卷
一、单选题(共18题;共36分)
1.化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是()
A.?从性质上看:丁烷具有可燃性
B.?从变化上看:丁烷完全燃烧只生成水
C.?从组成上看:丁烷由碳、氢两种元素组成
D.?从结构上看:一个丁烷分子由4个碳原子、10个氢原子构成
2.地球深处的水处于超临界状态,称为超临界水,如图为某压强下CaCl2和NaCl在超临界水中的溶解度曲线,该压强下,下列说法正确的是(?? )
A.?在超临界水中,NaCl的溶解度大于CaCl2的溶解度
B.?在超临界水中,2种物质的溶解度都随温度升高而增大
C.?450℃时,NaCl在超临界水中的溶解度为0.04g
D.?450℃时,可得到0.04%的CaCl2的超临界水溶液
3.如图分别与相应的操作过程相对应,其中正确的是(?? )
A.?向一接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化)
B.?向等质量、等溶质质量分数的稀硫酸中分别加入足量的镁片和锌片
C.?向 pH=10 的氢氧化钙溶液中不断加水稀释
D.?向含有硫酸的硫酸铜溶液中加入过量的氢氧化钠溶液
4.一定温度下,将少量氧化钙固体加入到一定量的饱和石灰水中,甲、乙、丙三位同学分别作出图象甲、乙和丙,则其中图象丙中反映的情况是(?? )
A.?溶质的质量与时间的关系????????????????????????????????????B.?溶剂的质量与时间的关系
C.?溶质的溶解度与时间的关系????????????????????????????????D.?溶质的质量分数与时间的关系
5.如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是(?? )
A.?只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.?t1℃~t3℃,MgSO4的溶解度随温度升高而增大
C.?在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.?把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
6.关于100克5%的氯化钠溶液,下列叙述正确的是(?? )
A.?100克水中溶有5克氯化钠???????????????????????????????????B.?5克氯化钠溶于95克水中
C.?溶液中氯化钠与水的质量比为1:20???????????????????D.?溶液中氯化钠与水的质量比为19:1
7.将金属钠投入水中会发生反应(2Na+2H2O═2NaOH+H2↑),现将4.6g钠投入95.4g水中充分反应后,溶液中溶质质量分数(?? )
A.?等于4.6%??????????????????????????B.?等于8.0%??????????????????????????C.?大于8.0%??????????????????????????D.?小于8.0%
8.传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日爆晒蒸发醋中的水分,以提高醋的品质.假设用醋酸的质量分数为2%的半成醋,生产500g 4%的优质醋,过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为( )
A.?300g???????????????????????????????????B.?400g???????????????????????????????????C.?500g???????????????????????????????????D.?600g
9.下列说法中正确的是(? )
A.?碳酸钠溶液能使无色酚酞溶液变蓝
B.?打开成浓盐酸的试剂瓶,瓶口会产生白雾
C.?浓盐酸露置于空气中,溶质的质量分数变大
D.?长期露置于空气中的氢氧化钠固体,其成分不会发生变化
10.下列关于溶液的说法中错误的是(??? )
A.?饱和溶液析出晶体后,其溶质的质量分数可能不变
B.?在溶液里进行的化学反应,通常比较快
C.?同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D.?不饱和溶液转化为饱和溶液,溶质质量分数可能不变
11.如图是a,b,c三种物质的溶解度曲线,下列分析不正确的是(?? )
A.?t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c
B.?t2℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液
C.?t1℃时 a,b,c三种物质的溶液中溶质质量分数关系是b>a=c
D.?除去a中少量的c,可采用降温结晶的方法
12.啤酒是一种碳酸饮料,当你打开瓶盖时,你会发现啤酒中有大量气泡冒出,当你快速喝了两口啤酒后又常常打嗝.下列对以上现象的解释中正确的是(?? )
A.?压强增大,气体的溶解度增大?????????????????????????????B.?压强减小,气体的溶解度增大
C.?温度升高,气体的溶解度增大?????????????????????????????D.?温度降低,气体的溶解度减小
13.在20℃时,刘冰同学向100g水中依次加入NaCl固体,充分溶解,实验过程如图所示。下列说法错误的是()
A.?图②中的溶液是不饱和溶液????????????????????????????????B.?图③中的溶液是饱和溶液
C.?图③中溶液的溶质质量为40g??????????????????????????????D.?图③和图④中NaCl溶液的溶质质量分数相等
14.关于如图所示过氧化氢溶液说法错误的是()
A.?500g溶液中含溶质30g???????????????????????????????????????B.?500mL溶液的质量为550g
C.?500mL溶液中溶质与溶剂的质量比为3:7??????????D.?取出50mL溶液,溶质质量分数仍为
15.M是硝酸钾或氯化钠中的一种。硝酸钾和氯化钠的溶解度曲线如图1所示。某化学兴趣小组用物质M进行了如图2所示实验。下列说法不正确的是( ??)
A.?物质M是硝酸钾
B.?烧杯②中溶液的溶质质量分数为37.5%
C.?烧杯①②③中,溶液的溶质质量分数的关系是②>③>①
D.?烧杯①中溶液为不饱和溶液,烧杯②和③中溶液为饱和溶液
16.下列图像变化与对应的实验操作一致的是(? ?)
A.?将足量的氯化钠饱和溶液恒温蒸发少量水??????????B.?等质量的铁片和镁条分别与足量的稀盐酸反应
C.?向装有稀硫酸的小烧杯中,逐滴滴加氢氧化钡溶液至过量??????????D.?向氢氧化钠与硝酸钡的混合溶液中,逐滴滴加稀硫酸至过量
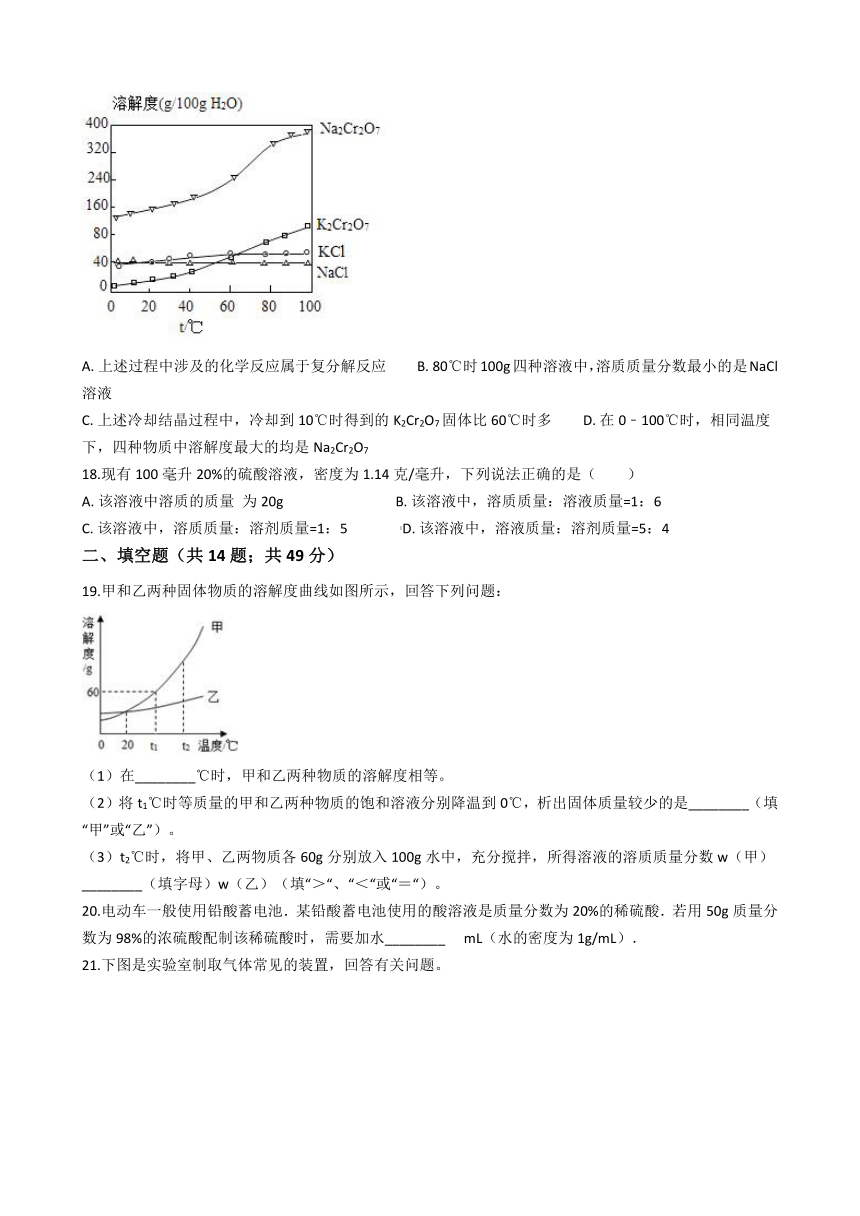
17.如图为四种物质的溶解度曲线。向Na2Cr2O7溶液中加入适量KC1,经蒸发浓缩,冷却结晶,过滤之后得K2Cr2O7固体,下列有关说法错误的是( )
A.?上述过程中涉及的化学反应属于复分解反应?????????B.?80℃时100g四种溶液中,溶质质量分数最小的是NaCl溶液
C.?上述冷却结晶过程中,冷却到10℃时得到的K2Cr2O7固体比60℃时多?????????D.?在0﹣100℃时,相同温度下,四种物质中溶解度最大的均是Na2Cr2O7
18.现有100毫升20%的硫酸溶液,密度为1.14克/毫升,下列说法正确的是( )
A.?该溶液中溶质的质量 为20g????????????????????????????????B.?该溶液中,溶质质量:溶液质量=1:6
C.?该溶液中,溶质质量:溶剂质量=1:5???????????????D.?该溶液中,溶液质量:溶剂质量=5:4
二、填空题(共14题;共49分)
19.甲和乙两种固体物质的溶解度曲线如图所示,回答下列问题:
(1)在________℃时,甲和乙两种物质的溶解度相等。
(2)将t1℃时等质量的甲和乙两种物质的饱和溶液分别降温到0℃,析出固体质量较少的是________(填“甲”或“乙”)。
(3)t2℃时,将甲、乙两物质各60g分别放入100g水中,充分搅拌,所得溶液的溶质质量分数w(甲)________(填字母)w(乙)(填“>“、“<“或“=“)。
20.电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.若用50g质量分数为98%的浓硫酸配制该稀硫酸时,需要加水________? mL(水的密度为1g/mL).
21.下图是实验室制取气体常见的装置,回答有关问题。
(1)写出编号仪器的名称:a.________;
写出实验室用A装置制氧气的化学方程式________。
(2)下列四种途径都可以得到二氧化碳:
Ⅰ. 写出甲途径生成二氧化碳的化学方程式________,把产生的二氧化碳通入紫色石蕊试液中,溶液呈________色。
Ⅱ. 甲乙途径都能用石灰石生成二氧化碳,主要因为这种原料含有________元素,而且来源非常广泛。实验室不用丙丁途径制取二氧化碳的主要理由是________。
Ⅲ. 写出实验室用乙途径制取二氧化碳,且能控制反应的发生和停止的装置组合(填序号)________。
(3)乙途径中用12.5g石灰石(纯度为80%)与73g未知浓度的盐酸溶液,恰好完全反应。求:
Ⅰ. 石灰石中碳酸钙物质的量是________mol。
Ⅱ. 该盐酸溶液的溶质质量分数。(根据化学方程式列式计算)________
22.NaOH、Na2CO3、NaCl在不同溶剂中的溶解度如下表所示.
表1? NaOH、Na2CO3、NaCl分别在水中的溶解度(S/g)
t/℃ NaOH Na2CO3 NaCl
0 42 7.1 35.7
10 51 12.2 35.8
20 109 21.8 36.0
30 119 39.7 36.3
表2? 常温下,NaOH、Na2CO3、NaCl分别在乙醇中的溶解度(S/g)
NaOH Na2CO3 NaCl
17.3 <0.01 0.1
根据表1和表2提供的数据回答下列问题:
(1)NaOH在水中的溶解度随温度升高而________(填“增大”或“减小”);
(2)20℃时,饱和食盐水中溶质的质量分数为 ________?(计算结果精确到0.1%);
(3)为证明CO2能与NaOH发生反应,小明同学将CO2通入饱和NaOH的乙醇溶液中.请推测该实验可观察到的现象________ , 推测依据是________ .
23.如图是由A、B两个注射器组成的密闭系统,其中存有50mL空气,给装有螺旋细铜丝的玻璃管加热,同时交替推动两个注射器的活塞,目的是________,玻璃管中的现象是________,发生反应的符号表达式为________;停止加热后冷却至室温,将气体全部推至B注射器中,则注射器B中的气体约为________?mL(玻璃管的体积可以不考虑)
24.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是(________)
A.甲的溶解度大于乙的溶解度
B.t℃时,甲、乙饱和溶液中溶质的质量分数相等
C.10℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
D.用________方法能使接近饱和的甲溶液变为饱和溶液
25.1mL98%的浓硫酸(密度为1.84g·cm-3)跟5mL水混合,所得稀硫酸溶液溶质的质量分数为________.
26.人体所需的维生素C(化学式为C6H8O6)主要从蔬菜、水果中摄取.请计算:
(1)维生素C中碳元素、氢元素、氧元素的质量的最简整数比为________?.
(2)若要配制溶质质量分数为0.3%的维生素C溶液1000g,需要维生素C的质量为________? g,水的质量为________?g.
27.下表为两种物质在不同温度时的溶解度
温度/℃ 0 20 40 60 80 100
溶解度/g KCl 27.6 34.0 40.0 45.5 51.1 56.7
KNO3 13.3 31.6 63.9 110 169 246
请回答:
(1)60℃时,KCl的溶解度是________? g;
(2)40℃时,将30g KCl加入到50g水中,充分溶解后所得溶液是________?溶液(填写“饱和”或“不饱和”);
(3)将20℃时KNO3和KCl的两种饱和溶液升温至60℃,则两种溶液的溶质质量分数大小关系是:KNO3________? KCl(填写“>”、“<”或“=”).
28.①60℃时,将24gKNO3溶于96g水中,所得溶液的质量分数为________,现此溶液等分为四份。
②第一份溶液中溶质的质量分数为________;
③取第二份溶液,将其温度升到100℃,此时溶液中溶质的质量分数为________ ;
④取第三份,使其溶质的质量分数变为原来的2倍,需加KNO固体________ g;
⑤取第四份,使其溶质的质量分数变为原来的一半,需加入水________ g.
29.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂.
(1)小明配制了5%的双氧水600g,则600g溶液中溶质为________?克,溶剂为________?克.
(2)小明倒出了300g双氧水溶液进行消毒,则剩下的溶液中溶质的质量分数为 ________?.
30.如图是A、B的溶解度曲线.t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出固体质量A________B(填“>”、“<”或“=”);把t2℃时150gA的饱和溶液稀释为20%,需加水________g.
31.以下物质:①金刚石 ②石油 ③干冰 ④一氧化碳 ⑤石墨
(1)可用于人工降雨的是________?(填序号,下同);(2)可用来切割玻璃的是________?;(3)具有毒性的气体是________?;(4)能做润滑剂固体单质是________?.
32.实验室若配制50g质量分数3%的NaCl溶液,则需6%的NaCl溶液________g.
三、计算题(共2题;共20分)
33.已知14g含有杂质的Fe与100g稀硫酸恰好完全反应(杂质不与稀硫酸反应,也不溶于水),放出0.4g气体.
求①该Fe的纯度.
②稀硫酸的溶质质量分数.
③反应后所得溶液溶质质量分数.
34.实验室有一瓶硫酸溶液,老师请小红同学设计方案测定该废液中硫酸的质量分数.小红同学先取一洁净小烧杯,称其质量为18.2g,然后往其中倒入少量硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去铁锈)放入该小烧杯中反应,待铁钉表面不再有气泡产生后,再次称量,总质量为43.9g.请回答下列问题:
(1)反应中产生的气体的质量是________.
(2)计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数).
(3)若铁钉的铁锈(主要成分为氧化铁)未除净,对计算结果的影响是________(选“偏大”、“偏小”、“无影响”),所对应的反应方程式为________.
四、实验探究题(共1题;共4分)
35.多角度认识溶液,有助于我们更好地了解其在生产生活中的重要作用。
(1)溶液的形成
①将适量调味品加入水中,充分搅拌后不能形成溶液的是________(填标号)。
A.食盐???? B.蔗糖 ?????C.花生油?????? D.味精
②将生石灰和足量的水充分搅拌后静置,取上层清液即为澄清石灰水。写出生石灰与水
反应的化学方程式________。
(2)溶液的性质
① 关于溶液的说法正确的有________(填标号)。
A.溶液是纯净物??????????????????? B.溶液是均一、稳定的
C.溶液的酸碱度可用石蕊溶液测定??? D.饱和溶液不一定是浓溶液
②实验测得下列四种溶液的pH如图所示,其中溶液呈碱性的是________
(3)物质的溶解性
①下图是X、Y、Z三种物质的溶解度曲线,
a.t1℃ 时溶解等质量的X、Y、Z三种物质,所消耗的水最多的是 ________;
b.将t2℃ 时 X、Y、Z三种物质的饱和溶液升温到t3℃,所得溶液仍是饱和溶液的是________
②常温下,将某固态物质A溶于水,形成饱和溶液I(如下图),进行以下实验。回答下列问题:
a.物质A的溶解度随温度的升高而________(填“增大”或“减小”)。
b.往溶液Ⅱ中加入少量高锰酸钾完全溶解,溶液呈紫红色。据此现象说明在某物质的饱和溶液中________“能”或“不能”)继续溶解其他物质。
③常温时,某物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示。
a.常温时,该物质的溶解度是________。
b.A点时,该溶液的溶质质量分数为________。
C.图中A、B、C、D四个点表示的溶液中溶质质量分数从大到小的关系是________。
五、综合题(共1题;共11分)
36.我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗34.7g,放出的气体在常温下体积为1.1L.
(1)常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为________?g.
(2)如石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数).
答案解析部分
一、单选题
1.【答案】 B
2.【答案】C
3.【答案】B
4.【答案】 A
5.【答案】C
6.【答案】 B
7.【答案】C
8.【答案】C
9.【答案】 B
10.【答案】 C
11.【答案】C
12.【答案】A
13.【答案】 C
14.【答案】 A
15.【答案】 C
16.【答案】 D
17.【答案】 B
18.【答案】 D
二、填空题
19.【答案】 (1)20
(2)乙
(3)>
20.【答案】195
21.【答案】 (1)试管;2H2O2 2H2O+ O2↑
(2)CaCO3 CaO+CO2↑;红;碳、氧;得到的二氧化碳纯度不高;B、F
(3)0.1;解:设HCl的物质的量为xmol
CaCO3+ 2HCl→ CaCl2+H2O+ CO2↑
1 2
0.1 x
x=0.2mol
0.2×36.5 /73=0.1(或10%)
22.【答案】增大;26.5%;溶液变浑浊;碳酸钠在乙醇中的溶解度很小
23.【答案】 使铜丝与氧气充分反应;红色逐渐变为黑色;2Cu+O2 CuO;40
24.【答案】B;加入物质甲或降低温度或恒温蒸发溶剂
25.【答案】 26.4%
26.【答案】9:1:12
;3
;997
27.【答案】45.5
;饱和
;<
28.【答案】20%;20%;20%;10;30
29.【答案】30;570;5%
30.【答案】>;100
31.【答案】③
;①
;④
;⑤
32.【答案】解:设需6%的NaCl溶液的质量为x,
则50×3%=6%x,
x=25g.
故答案是:25
三、计算题
33.【答案】解:设参加反应的铁的质量为x,硫酸质量为y,生成硫酸亚铁质量为z
Fe+H2SO4═FeSO4+H2↑
56? 98??? 152? 2
x??? y????? z? 0.4g
x=11.2g
y=19.6g
z=30.4g
所以①铁的纯度为: ×100%=80%;
②稀硫酸的溶质质量分数为: ×100%=19.6%;
③反应后所得溶液溶质质量分数为: ×100%=27.4%.
34.【答案】(1)0.1g
(2)解:设与铁反应的硫酸的质量为x,
烧杯中稀硫酸废液的质量为:33.2g﹣18.2g=15.0g
Fe+H2SO4═FeSO4+ H2↑
??? 98 2
???? x 0.1g
x=4.9g
该废液中硫酸的质量分数为: 100%=32.7%
答:废液中硫酸的质量分数是32.7%.
(3)偏小;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
四、实验探究题
35.【答案】(1)C;CaO + H2O → Ca(OH)2
(2)B;D
(3)碳酸钠;X,Z
;减小;能;40g
;20%(1/5);C = D > A > B
五、综合题
36.【答案】(1)2.2
(2)解:设:石灰石中碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl= CaCl2+H2O+ CO2↑
100 111 44
x y 2.2g
x=5g???? y=5.55g
≈66.7%
=14.8%
答:石灰石中CaCO3的质量分数为66.7%;
反应所得溶液中溶质的质量分数为14.8%
同课章节目录
