鲁科版高一化学必修一3.2氮的循环课件(共35张PPT)
文档属性
| 名称 | 鲁科版高一化学必修一3.2氮的循环课件(共35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-10 00:00:00 | ||
图片预览











文档简介
(共35张PPT)
加工过程暗藏“玄机”, 加工金银谨防上当
某日,江西宜丰县城某金银加工店在为消费者黎某加工金戒指时,暗中截取黄金1.6克,被消费者当场揭穿。原来,消费者黎某多次在该金银加工店将自己的金戒指变样打造,加工了几次后戒指却越来越小,黎某便多了个心眼,最终将偷金的经营户当场抓获。县工商局接到投诉,经过调查,经营者在清洗用久了有污垢的首饰,不是在浓度低的盐酸溶液中清洗,而是使用王水,清洗中表层黄金能溶于王水,经营者则可以从王水中加工提炼。而王水的主要成分之一就是“硝酸”。
一、物理性质
无色 有刺激性气味 液体 密度比水大 可溶于水 易挥发
颜色: 气味: 状态: 密度: 溶解性: 挥发性:
它能以______溶解于___常用浓HNO3的质量分数大约___。质量分数为____以上的浓硝酸在空气里由于硝酸的挥发而产生“发烟”的现象,通常叫________。“发烟”的原因是___________________________________
任意比
水
69%
98%
发烟硝酸
硝酸里放出的硝酸蒸气遇到空气里的水蒸气生成了极微
小的硝酸液滴的缘故。
实验:硝酸的分解
1、为什么浓硝酸会变黄色?
2、如果是有NO2生成,那么硝酸的分解产物还应有 什么物质生成?
参考:可能有NO2(红棕色)产生,NO2溶于硝酸而变黄。
实验分析
3、此实验说明硝酸有什么性质?
参考:不稳定性
二、化学性质
1、不稳定性
4HNO3 2H2O + 4NO2 + O2
保存:保存在棕色试剂瓶中避光、低温保存,
不能用橡皮塞。
常见的需要放在棕色瓶中的试剂有哪些?
浓HNO3 、AgNO3 、氯水、溴水、氨水等。
下列物质的溶液在长期放置的过程中因被氧化而成黄色的是 ( )
A. 浓硝酸 B. 工业盐酸
C. 氯化亚铁 D. 浓溴水
E. KI溶液
CE
讨 论
教材上采用的上图所示的装置来做浓硝酸与铜反应实验的,请问此装置设计是否严谨?若不严谨你认为问题出在哪里?
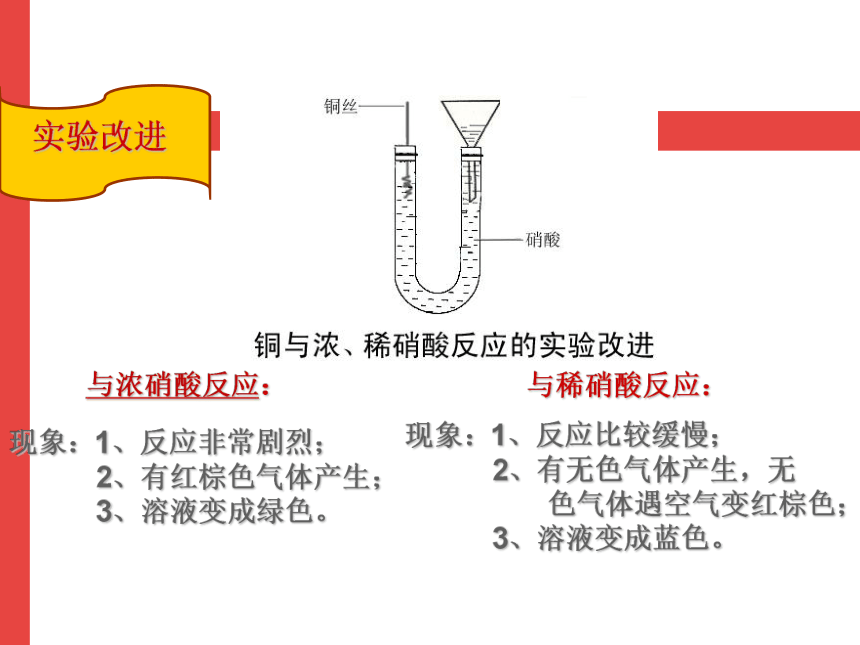
实验改进
现象:1、反应非常剧烈; 2、有红棕色气体产生; 3、溶液变成绿色。
现象:1、反应比较缓慢; 2、有无色气体产生,无 色气体遇空气变红棕色; 3、溶液变成蓝色。
与浓硝酸反应:
与稀硝酸反应:
2、强氧化性
Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2O
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O
①与金属反应
结论:硝酸具有强氧化性,几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。
玻尔巧藏“诺贝尔金质奖章”的故事
玻尔(1885—1962) 丹麦物理学家
在“量子力学”的建立中有重大贡献
玻尔与爱因斯坦
玻尔巧藏诺贝尔金质奖章
? 玻尔是丹麦著名的物理学家,曾获得诺贝尔奖。第二次世界大战中,玻尔被迫离开将要被德国占领的祖国。为了表示他一定要返回祖国的决心,他决定将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。这是一个多么聪明的办法啊!战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。新铸成的奖章显得更加灿烂夺目,因为,它凝聚着玻尔对祖国无限的热爱和无穷的智慧。
那么,玻尔是用什么溶液使金质奖章溶解呢?原来他用的溶液叫王水。王水是浓硝酸和浓盐酸按1:3的体积比配制成的的混和溶液。
王水的氧化能力比硝酸强,不溶于硝酸的金,却可以溶解在王水中。
小知识
1体积浓硝酸与3体积浓盐酸的混合物叫做王水,它的氧化能力更强,金(Au )和 铂(Pt )不溶于硝酸,但溶于王水。
帮
你
记
忆
思考:既然浓硝酸的氧化性这么强,那么我们在运 输的时候采用什么样的容器来盛装呢?
常温下,浓硝酸使铁铝等金属钝化
注
意
⑵常温下,浓硝酸使铁铝等金属钝化
⑶ 氧化性:浓硝酸>稀硝酸
⑷ 一般情况:浓硝酸被还原为NO2
稀硝酸被还原为NO
⑴ 硝酸与金属反应不放出氢气
硝酸与金属反应的规律:
⑸.Mg、Zn、Fe等较活泼的金属与稀HNO3反应根据稀HNO3的浓度不同可得NO、N2O、 N2、NH4NO3等不同产物。
⑹.硝酸与变价金属(如Fe)反应,根据硝酸的量的多少分别得到低价、高价或两种价态共存的混合物。
⑺.与金属反应硝酸既起氧化剂的作用,
又起酸的作用所以硝酸发生化学反应时要特别关注H+的浓度。
1、请写出铜与两种硝酸反应的离子方程式。
2、某溶液中含有H2SO40.03mol、HNO30.04
mol,若投入1.92gCu粉微热,反应后放出
NO气体约( )
A 0.02mol B 0.01mol
C 0.015mol D 无法计算
A
3、请写出铁(少量、过量)在一定条件下与
HNO3(浓、稀)反应的化学方程式。
硝酸能使许多非金属(如碳、硫、磷)氧化不生成最高价氧化物或含氧酸,也能使某些有机物(如松节油,锯末等)及还原剂(如H2S, HI, HBr, SO2, Na2SO3等)氧化。
②与非金属的反应
B
C
P
S
I2
H3BO3
CO2
H3PO4
H2SO4
HIO3
+ HNO3(浓)
+ NO2
如含S2- 、SO32- 、Fe2+ 、I-等的化合物反应。
3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O
3H2S+2HNO3(稀)=3S↓+2NO↑+4H2O
③
3SO32-+2NO3-+2H+=3SO42-+2NO ↑+H2O
[思考对比]:浓硫酸和硝酸氧化性比较
Mg Cu Fe/Al(常温) C
浓硫酸 MgSO4、SO2 CuSO4、SO2 钝化 CO2、SO2
浓硝酸 Mg(NO3) 2、NO2 Cu(NO3)2、NO2 钝化 CO2、NO2
稀硝酸 Mg(NO3) 2、NO Cu(NO3)2、NO 剧烈反应
3、酸的通性
HNO3 = H+ + NO3-
(1)与指示剂作用
稀硝酸与石蕊试液变红,加热不褪色,
浓硝酸与石蕊试液变红,加热褪色
(2)与活泼金属反应不产生H2
(3)与碱和碱性氧化物反应:比较与CuO、FeO的反应
(4)与盐反应:比较与Na2CO3、Na2SO3 的反应
[思考比较] :氯水、过氧化钠加入紫色石蕊试液中现象
氯水加入紫色石蕊试液中现象:先变红后褪色
过氧化钠加入紫色石蕊试液中现象:先变蓝后褪色
三、硝酸的用途
在工业上,硝酸是一种重要的化工原料,用于制氮肥、硝酸盐、王水、炸药等,在有机合成中,用来制取硝酸甘油、硝基苯、苦味酸、梯恩梯以及硝化纤维素等。在实验室里,它是一种重要的化学试剂。
四、硝酸盐
1、均为易溶于水的离子晶体
2、一般受热易分解,应低温、避光保存
硝酸盐的分解规律:
2KNO3=2KNO2+O2↑
2Mg(NO3)2=2MgO+4NO2 ↑ +O2 ↑
Cu(NO3)2=Cu+2NO2 ↑ +O2 ↑
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
△
△
△
五、硝酸的制法
工业:NH3 NO NO2 HNO3
实验室:
NaNO3+H2SO4=NaHSO4+HNO3 ↑
尾气处理:
NO+NO2+2NaOH=2NaNO2+H2O
(固)
(浓)
△
足量的Cu中加入少量的浓硝酸,可能会发生什么反应?
反应停止后,如果在溶液中再加入足量盐酸, 会出现什么情况?
溶液中存在NO3-,它遇到H+后,会继续氧化铜。
讨 论
1.常温下能用铝制容器盛放的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.稀硝酸
练一练
BC
2.下列关于硝酸正确的是( )
A.稀硝酸能与Fe反应,而浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D. 稀硝酸与Cu反应,生成NO2,而浓硝
酸与Cu反应只生成NO,稀硝酸得电子
更多,故稀硝酸氧化性大于浓硝酸
B
3、取三张蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加浓硝酸,浓硫酸、和新制的氯水,三张试纸最终呈现的颜色是:( )
A、白、红、白 B、红、黑、红 C、红、红、红 D、白、黑、白
D
4.某单质跟浓硝酸反应时参加反应的单质与硝酸的物质的量之比为1:4则该单质被氧化后元素化合价可能为( )
A.+1 B.+2 C.+3 D.+4
BD
5、下列关于硝酸的叙述正确的是 ( )
A、稀硝酸是弱酸,浓硝酸是强酸
B、铜与浓硝酸和稀硝酸都能反应生成二氧化氮
C、浓硝酸和稀硝酸都是强氧化剂
D、稀硝酸与活泼金属反应主要放出氢气,而
浓硝酸则使金属钝化
C
6、用下列三种途径来制取相同质量的硝酸铜:
A、铜与浓硝酸反应
B、铜与稀硝酸反应
C、铜与氧气反应生成CuO,CuO再与稀 硝酸反应最佳方案是什么?为什么?
加工过程暗藏“玄机”, 加工金银谨防上当
某日,江西宜丰县城某金银加工店在为消费者黎某加工金戒指时,暗中截取黄金1.6克,被消费者当场揭穿。原来,消费者黎某多次在该金银加工店将自己的金戒指变样打造,加工了几次后戒指却越来越小,黎某便多了个心眼,最终将偷金的经营户当场抓获。县工商局接到投诉,经过调查,经营者在清洗用久了有污垢的首饰,不是在浓度低的盐酸溶液中清洗,而是使用王水,清洗中表层黄金能溶于王水,经营者则可以从王水中加工提炼。而王水的主要成分之一就是“硝酸”。
一、物理性质
无色 有刺激性气味 液体 密度比水大 可溶于水 易挥发
颜色: 气味: 状态: 密度: 溶解性: 挥发性:
它能以______溶解于___常用浓HNO3的质量分数大约___。质量分数为____以上的浓硝酸在空气里由于硝酸的挥发而产生“发烟”的现象,通常叫________。“发烟”的原因是___________________________________
任意比
水
69%
98%
发烟硝酸
硝酸里放出的硝酸蒸气遇到空气里的水蒸气生成了极微
小的硝酸液滴的缘故。
实验:硝酸的分解
1、为什么浓硝酸会变黄色?
2、如果是有NO2生成,那么硝酸的分解产物还应有 什么物质生成?
参考:可能有NO2(红棕色)产生,NO2溶于硝酸而变黄。
实验分析
3、此实验说明硝酸有什么性质?
参考:不稳定性
二、化学性质
1、不稳定性
4HNO3 2H2O + 4NO2 + O2
保存:保存在棕色试剂瓶中避光、低温保存,
不能用橡皮塞。
常见的需要放在棕色瓶中的试剂有哪些?
浓HNO3 、AgNO3 、氯水、溴水、氨水等。
下列物质的溶液在长期放置的过程中因被氧化而成黄色的是 ( )
A. 浓硝酸 B. 工业盐酸
C. 氯化亚铁 D. 浓溴水
E. KI溶液
CE
讨 论
教材上采用的上图所示的装置来做浓硝酸与铜反应实验的,请问此装置设计是否严谨?若不严谨你认为问题出在哪里?
实验改进
现象:1、反应非常剧烈; 2、有红棕色气体产生; 3、溶液变成绿色。
现象:1、反应比较缓慢; 2、有无色气体产生,无 色气体遇空气变红棕色; 3、溶液变成蓝色。
与浓硝酸反应:
与稀硝酸反应:
2、强氧化性
Cu+4HNO3(浓) = Cu(NO3)2+2NO2 ↑+2H2O
3Cu+8HNO3(稀) =3Cu(NO3)2+2NO ↑+4H2O
①与金属反应
结论:硝酸具有强氧化性,几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。
玻尔巧藏“诺贝尔金质奖章”的故事
玻尔(1885—1962) 丹麦物理学家
在“量子力学”的建立中有重大贡献
玻尔与爱因斯坦
玻尔巧藏诺贝尔金质奖章
? 玻尔是丹麦著名的物理学家,曾获得诺贝尔奖。第二次世界大战中,玻尔被迫离开将要被德国占领的祖国。为了表示他一定要返回祖国的决心,他决定将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。这是一个多么聪明的办法啊!战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。新铸成的奖章显得更加灿烂夺目,因为,它凝聚着玻尔对祖国无限的热爱和无穷的智慧。
那么,玻尔是用什么溶液使金质奖章溶解呢?原来他用的溶液叫王水。王水是浓硝酸和浓盐酸按1:3的体积比配制成的的混和溶液。
王水的氧化能力比硝酸强,不溶于硝酸的金,却可以溶解在王水中。
小知识
1体积浓硝酸与3体积浓盐酸的混合物叫做王水,它的氧化能力更强,金(Au )和 铂(Pt )不溶于硝酸,但溶于王水。
帮
你
记
忆
思考:既然浓硝酸的氧化性这么强,那么我们在运 输的时候采用什么样的容器来盛装呢?
常温下,浓硝酸使铁铝等金属钝化
注
意
⑵常温下,浓硝酸使铁铝等金属钝化
⑶ 氧化性:浓硝酸>稀硝酸
⑷ 一般情况:浓硝酸被还原为NO2
稀硝酸被还原为NO
⑴ 硝酸与金属反应不放出氢气
硝酸与金属反应的规律:
⑸.Mg、Zn、Fe等较活泼的金属与稀HNO3反应根据稀HNO3的浓度不同可得NO、N2O、 N2、NH4NO3等不同产物。
⑹.硝酸与变价金属(如Fe)反应,根据硝酸的量的多少分别得到低价、高价或两种价态共存的混合物。
⑺.与金属反应硝酸既起氧化剂的作用,
又起酸的作用所以硝酸发生化学反应时要特别关注H+的浓度。
1、请写出铜与两种硝酸反应的离子方程式。
2、某溶液中含有H2SO40.03mol、HNO30.04
mol,若投入1.92gCu粉微热,反应后放出
NO气体约( )
A 0.02mol B 0.01mol
C 0.015mol D 无法计算
A
3、请写出铁(少量、过量)在一定条件下与
HNO3(浓、稀)反应的化学方程式。
硝酸能使许多非金属(如碳、硫、磷)氧化不生成最高价氧化物或含氧酸,也能使某些有机物(如松节油,锯末等)及还原剂(如H2S, HI, HBr, SO2, Na2SO3等)氧化。
②与非金属的反应
B
C
P
S
I2
H3BO3
CO2
H3PO4
H2SO4
HIO3
+ HNO3(浓)
+ NO2
如含S2- 、SO32- 、Fe2+ 、I-等的化合物反应。
3FeO+10HNO3(稀)=3Fe(NO3)3+NO↑+5H2O
3H2S+2HNO3(稀)=3S↓+2NO↑+4H2O
③
3SO32-+2NO3-+2H+=3SO42-+2NO ↑+H2O
[思考对比]:浓硫酸和硝酸氧化性比较
Mg Cu Fe/Al(常温) C
浓硫酸 MgSO4、SO2 CuSO4、SO2 钝化 CO2、SO2
浓硝酸 Mg(NO3) 2、NO2 Cu(NO3)2、NO2 钝化 CO2、NO2
稀硝酸 Mg(NO3) 2、NO Cu(NO3)2、NO 剧烈反应
3、酸的通性
HNO3 = H+ + NO3-
(1)与指示剂作用
稀硝酸与石蕊试液变红,加热不褪色,
浓硝酸与石蕊试液变红,加热褪色
(2)与活泼金属反应不产生H2
(3)与碱和碱性氧化物反应:比较与CuO、FeO的反应
(4)与盐反应:比较与Na2CO3、Na2SO3 的反应
[思考比较] :氯水、过氧化钠加入紫色石蕊试液中现象
氯水加入紫色石蕊试液中现象:先变红后褪色
过氧化钠加入紫色石蕊试液中现象:先变蓝后褪色
三、硝酸的用途
在工业上,硝酸是一种重要的化工原料,用于制氮肥、硝酸盐、王水、炸药等,在有机合成中,用来制取硝酸甘油、硝基苯、苦味酸、梯恩梯以及硝化纤维素等。在实验室里,它是一种重要的化学试剂。
四、硝酸盐
1、均为易溶于水的离子晶体
2、一般受热易分解,应低温、避光保存
硝酸盐的分解规律:
2KNO3=2KNO2+O2↑
2Mg(NO3)2=2MgO+4NO2 ↑ +O2 ↑
Cu(NO3)2=Cu+2NO2 ↑ +O2 ↑
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
△
△
△
五、硝酸的制法
工业:NH3 NO NO2 HNO3
实验室:
NaNO3+H2SO4=NaHSO4+HNO3 ↑
尾气处理:
NO+NO2+2NaOH=2NaNO2+H2O
(固)
(浓)
△
足量的Cu中加入少量的浓硝酸,可能会发生什么反应?
反应停止后,如果在溶液中再加入足量盐酸, 会出现什么情况?
溶液中存在NO3-,它遇到H+后,会继续氧化铜。
讨 论
1.常温下能用铝制容器盛放的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.稀硝酸
练一练
BC
2.下列关于硝酸正确的是( )
A.稀硝酸能与Fe反应,而浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D. 稀硝酸与Cu反应,生成NO2,而浓硝
酸与Cu反应只生成NO,稀硝酸得电子
更多,故稀硝酸氧化性大于浓硝酸
B
3、取三张蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加浓硝酸,浓硫酸、和新制的氯水,三张试纸最终呈现的颜色是:( )
A、白、红、白 B、红、黑、红 C、红、红、红 D、白、黑、白
D
4.某单质跟浓硝酸反应时参加反应的单质与硝酸的物质的量之比为1:4则该单质被氧化后元素化合价可能为( )
A.+1 B.+2 C.+3 D.+4
BD
5、下列关于硝酸的叙述正确的是 ( )
A、稀硝酸是弱酸,浓硝酸是强酸
B、铜与浓硝酸和稀硝酸都能反应生成二氧化氮
C、浓硝酸和稀硝酸都是强氧化剂
D、稀硝酸与活泼金属反应主要放出氢气,而
浓硝酸则使金属钝化
C
6、用下列三种途径来制取相同质量的硝酸铜:
A、铜与浓硝酸反应
B、铜与稀硝酸反应
C、铜与氧气反应生成CuO,CuO再与稀 硝酸反应最佳方案是什么?为什么?
