2019——2020山东省平邑县地方二中初中化学《生活中常见的盐》平行试题 (含答案)
文档属性
| 名称 | 2019——2020山东省平邑县地方二中初中化学《生活中常见的盐》平行试题 (含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 151.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-12 11:33:42 | ||
图片预览




文档简介
2019——2020山东省平邑县地方二中初中化学《生活中常见的盐》平行试题
一、单选题(共18题;共36分)
1.物质性质决定用途,下列说法不正确的是(?? )
A.?氢氧化钠具有碱性,可用于治疗胃酸过多???????????B.?硫酸铜能使蛋白质变性,但可用于游泳池水消毒
C.?镁能在空气中燃烧发出耀眼的白光,可用于制造照明弹?????????D.?食醋具有酸性,可用于减轻松花蛋中所含碱性物质的涩味
2.粗盐提纯的实验中,没有涉及的操作是(?? )
A.?溶解????????????????????????????????B.?过滤????????????????????????????????C.?蒸发结晶????????????????????????????????D.?降温结晶
3.”国富民强”,我国制碱工业的先驱—侯德榜,在积贫积弱的旧中国与诺贝尔奖无缘。“侯氏制碱”制得的是(?? ) ?
A.?NaOH????????????????????????????B.?NaHCO3????????????????????????????C.?Na2CO3?? ????????????????????????????D.?Ca(OH)2
4.分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是(??? )
A.?MgCl2? NaOH? H2SO4??????????????????????????????????????B.?Ba(NO3)2? K2SO4? HCl
C.?KOH? CuSO4? H2SO4?????????????????????????????????????????D.?AgNO3? KCl ? HNO3
5.有碳酸钠、硝酸银、氯化钡及稀盐酸四瓶失去标签的溶液,为鉴别它们设计实验如下:用三支试管各取少量其中的三种溶液,再分别加入少量剩下的最后一种溶液。下列推测的现象或结论中,错误的是(?? )
A.?若三支试管中都出现白色沉淀,则最后加入的是硝酸银溶液
B.?若两支试管中出现气泡,一支试管中出现白色沉淀,则最后加入的是碳酸钠溶液
C.?若三支试管中的现象分别为出现气泡、白色沉淀、无明显变化,则最后加入的是稀盐酸
D.?若两支试管中出现白色沉淀,一支试管中无明显变化,则最后加入的是氯化钡溶液
6.用下列溶液能鉴别NaOH溶液、Ca(OH)2溶液、稀H2SO4 的是(? )
A.?FeCl2溶液??????????????????????B.?KNO3溶液??????????????????????C.?Na2CO3溶液??????????????????????D.?无色酚酞试液
7.下列各组物质充分混合,所得溶液质量比比反应前溶液总质量减小的是(?? )
A.?石灰石和稀盐酸???????????B.?铝和硫酸???????????C.?硝酸钾溶液和氯化钠溶液???????????D.?铜片和硝酸银溶液
8.归纳总结是学习化学的常用方法,下列总结的规律正确的是(? )
A.?含氧的化合物都是氧化物????????????????????????????????????B.?化学反应伴随着能量变化
C.?带电的粒子都是离子???????????????????????????????????????????D.?酸、碱、盐中都含有金属元素
9.下表列出了除去物质中所含少量杂质的方法,其中错误的是(?? )
选项 物质 所含物质 除去杂质的方法
A 氧化铜 铜 在空气中充分加热
B 氧化钙 碳酸钙 充分高温煅烧
C 铜 生铁 加入足量稀盐酸、过滤、洗涤、干燥
D 硫酸钠 碳酸钠 加入适量的稀硫酸、蒸发结晶
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
10.下列关于物质用途的描述中,正确的是(?? )
A.?氧气用于灭火???????????B.?二氧化碳作燃料???????????C.?碳酸钙作补钙剂???????????D.?烧碱用于改良酸性土壤
11.某同学想用实验证明CuSO4溶液显蓝色不是由SO42-造成的,下列实验操作中,无意义的是(? ?)
A.?观察Na2SO4溶液,溶液没有颜色
B.?向CuSO4溶液中滴加足量氯化钡溶液,充分反应后,溶液颜色未消失
C.?对比不同浓度的CuSO4溶液的颜色差异,浓度小的溶液颜色较浅
D.?向CuSO4溶液中滴加足量氢氧化钠溶液,充分反应后,溶液颜色消失
12.去年在福岛核辐射时曾发生过一次全国性的抢盐事件,无独有偶,在今年4月3日到7日,兰州市再次爆发食盐抢购闹剧.食盐的主要成分是( )
A.?氯化钠??????????????????????????????B.?苛性钠????????????????????????????????C.?亚硝酸钠??????????????????????????????D.?碳酸钠
13.粗盐中除含有少量不溶性杂质外,还含有MaCl2、CaCl2和Na2SO4等可溶性杂质,要除去上述可溶性杂质,下列所选试剂及操作顺序都正确的是(?? )
A.?过量BaCl2溶液、过量NaOH溶液、过量Na2CO3溶液、过滤,适量稀盐酸
B.?过量Na2CO3溶液、过量BaCl2溶液、过量NaOH溶液、过滤,适量稀盐酸
C.?过量NaOH溶液、过量Na2CO3溶液、过量BaCl2溶液、适量稀盐酸,过滤
D.?过量BaCl2溶液、过量Na2CO3溶液、过量NaOH溶液、适量稀盐酸,过滤
14.分别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是(? ?? )
A.?NaNO3?? NaCl?? H2SO4?????????????????????????????????????B.?CaCO3?? NaOH?? Na2SO4
C.?BaCl2?? NaNO3?? CuSO4????????????????????????????????????D.?AgNO3?? Na2SO4?? NaCl
15.下列各组离子在溶液中一定能大量共存的是( )
A.?H+、OH﹣、Na+??????B.?Ca2+、OH﹣、CO32﹣??????C.?Na+、K+、Cl﹣??????D.?H+、NO3﹣、CO32﹣
16.某粗盐固体样品中含有少量CaCl2、MgCl2、Na2SO4、MgSO4和泥沙,进行以下操作可得到纯净的NaCl晶体:①加过量的NaOH溶液;②加H2O溶解;③加过量的BaCl2溶液;④过滤;⑤蒸发;⑥加过量的Na2CO3溶液;⑦加适量的稀盐酸,则正确的操作顺序是( )
A.?②③①⑥④⑦⑤??????????????B.?②①⑥③④⑦⑤????????????C.?①⑥②③④⑤⑦?????????????D.?②①③⑥⑦④⑤
17.鉴别下列物质,采用的方法和依据的现象有错误的是(??? )???
选项 待鉴别物质 鉴别的方法和现象
A 氯化铵和氯化钾 加熟石灰研磨,是否有氨味
B 碳酸钠溶液和氢氧化钠溶液 加入酚酞溶液,观察溶液是否变色
C 浓盐酸和稀盐酸 打开试剂瓶塞,观察是否有白雾
D 水和过氧化氢溶液 加入二氧化锰,观察是否产生气泡
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
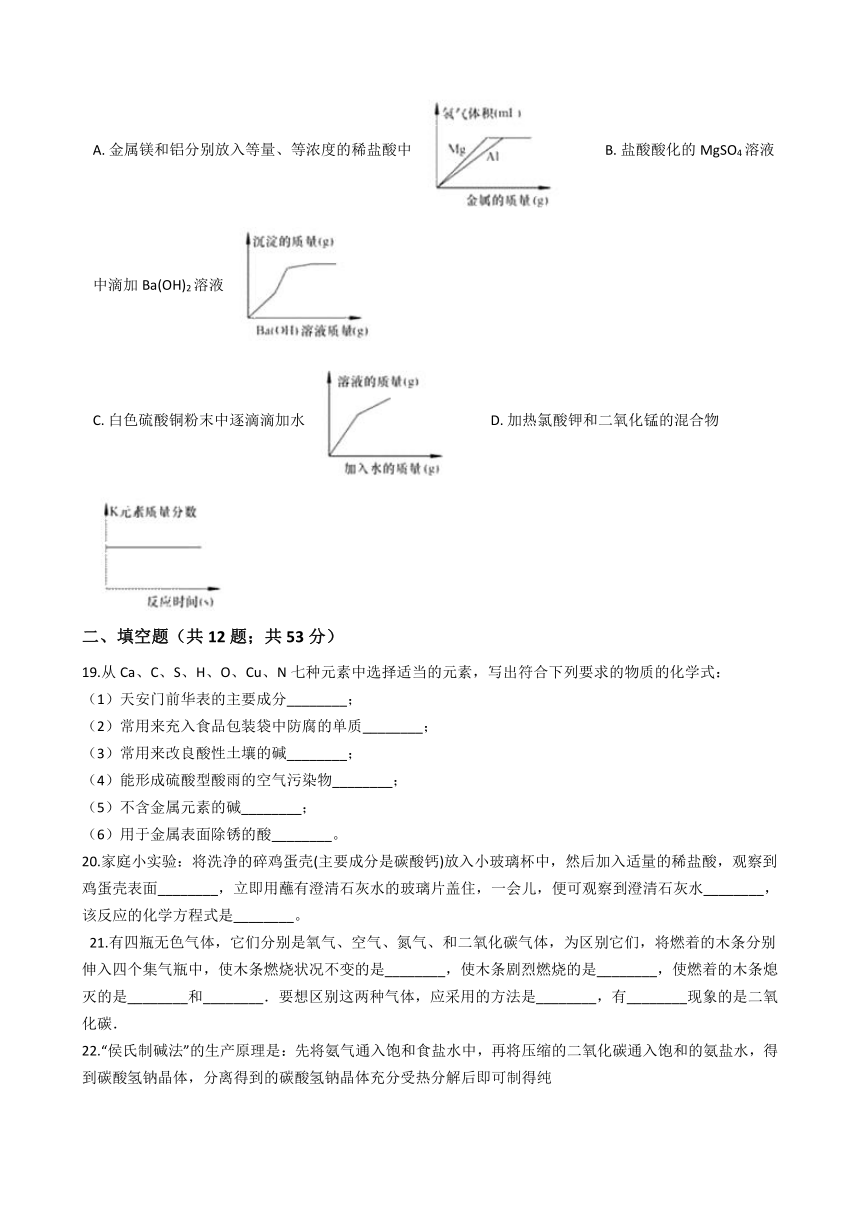
18.下列图像与对应的表述一致的是(?? )
A.?金属镁和铝分别放入等量、等浓度的稀盐酸中 ??????????B.?盐酸酸化的MgSO4溶液中滴加Ba(OH)2溶液
C.?白色硫酸铜粉末中逐滴滴加水 ??????????D.?加热氯酸钾和二氧化锰的混合物
二、填空题(共12题;共53分)
19.从Ca、C、S、H、O、Cu、N七种元素中选择适当的元素,写出符合下列要求的物质的化学式:
(1)天安门前华表的主要成分________;
(2)常用来充入食品包装袋中防腐的单质________;
(3)常用来改良酸性土壤的碱________;
(4)能形成硫酸型酸雨的空气污染物________;
(5)不含金属元素的碱________;
(6)用于金属表面除锈的酸________。
20.家庭小实验:将洗净的碎鸡蛋壳(主要成分是碳酸钙)放入小玻璃杯中,然后加入适量的稀盐酸,观察到鸡蛋壳表面________,立即用蘸有澄清石灰水的玻璃片盖住,一会儿,便可观察到澄清石灰水________,该反应的化学方程式是________。
21.有四瓶无色气体,它们分别是氧气、空气、氮气、和二氧化碳气体,为区别它们,将燃着的木条分别伸入四个集气瓶中,使木条燃烧状况不变的是________,使木条剧烈燃烧的是________,使燃着的木条熄灭的是________和________.要想区别这两种气体,应采用的方法是________,有________现象的是二氧化碳.
22.“侯氏制碱法”的生产原理是:先将氨气通入饱和食盐水中,再将压缩的二氧化碳通入饱和的氨盐水,得到碳酸氢钠晶体,分离得到的碳酸氢钠晶体充分受热分解后即可制得纯碱.
NaCl和NH4Cl的溶解度表:
温度(℃) 0 10 20 30 40 50
溶解度
(g/100g水) NaCl 35.7 35.8 36.0 36.3 36.6 37
NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4
请根据提供的信息,回答问题:
①10℃时,NaCl的溶解度是________;
②图中,表示NH4Cl的溶解度曲线是________(填“A”或“B”)
③常温20℃时,配制的饱和食盐水的质量分数为________,将食盐水的温度提高,溶液中溶质的质量分数也将提高,而实际生产中往往在常温下进行,这样做的理由是________;
④若NaCl和NH4Cl溶液溶质质量分数相同,表示其饱和状态的点在图中可能位于的区域是________(选填 I、II、III、IV);
⑤生产中通入氨气及二氧化碳,若要提高这些气体的溶解度,下列做法可行的是________(选填编号)
A.增大压强????? B.升高温度????? C.增加水量.
23.粗盐提纯的步骤是________、________、________.在实验过程中可能使用到的仪器: ①铁架台②烧杯③量筒④试管夹⑤石棉网⑥集气瓶⑦药匙⑧胶头滴管⑨托盘天平⑩砝码.在这10种仪器中,实验中一定不需要是(填编号)________;需要增加的仪器是________.
24.目前世界上60%的镁是从海水中提取的.海水提镁的主要流程如下:
(1)向海水中加入石灰乳的作用是________ .
(2)从充分利用海洋化学资源、提高经济效益的角度,生产生石灰的主要原料来源于海洋中的贝壳,生石灰和水反应的化学方程式是________ .
(3)操作A是________ , 加入的足量试剂a是________(填化学式).
(4)已知MgCl2的溶解度随温度的升高而增大.下列各图是某MgCl2饱和溶液的浓度随温度升高而变化的图象(不考虑溶剂的质量变化),其中正确的是________
(5)海水提镁的过程中,将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁的原因是:________
(6)试剂a具有刺激性气味,我们刚进实验室就能闻到这种气味,说明分子的性质是:________?.
25.A,B,C,D,E为初中化学常见五种不同类别的物质,它们之间的关系如图所示(部分物质和反应条件已略去).A,B,C均含有同种金属元素,B→C反应放出大量热,E是相对分子质量最小的单质,则:A的化学式为________;反应①和②的化学方程式分别为:________、________.
26.甲、乙、丙、丁是常见的化合物,它们有如图所示转化关系(部分物质已略去)。甲是天然气的主要成分;乙是相对分子质量最小的氧化物;丁是大理石的主要成分。则:甲的化学式为________;①和②的化学方程式分别为________、________。
27.只用Na、S、O、H四种元素的一种或几种,按要求填空:
各写出一个化学式:①氧化物________②酸________③碱________④盐________
28.下列物质中属于氧化物的是________,属于盐的是________。(填序号)
①冰水共存物?? ②液氧?? ③空气?? ④纯碱?? ⑤硫酸?? ⑥火碱?? ⑦过氧化氢?? ⑧高锰酸钾
29.请选择鉴别下列各组中两种固体物质的试剂或者方法.
AgCl和BaCO3________、Cu粉和CuO________、KMnO4和MnO2________.
30.某化学活动小组以“酸碱盐的性质”为主题进行探究性学习,请你作为该小组成员一起来解决下列问题:
(1)小红同学从某一欠收农田里取回一份土壤样品,如果检测结果呈酸性,从经济和可行方面考虑,那么要改良此土壤的酸性,应向农田里施加?________(填化学式)。
(2)小红同学用右图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
I.为了验证反应①,小红将无色酚酞试液滴入NaOH溶液中,溶液由无色变成________。
II.依据反应④说明NaOH必须密封保存,否则在空气中要变质,其化学反应方程式为:________。
III.为了验证反应③能够发生,你选择的物质是________。
a.Na2CO3?????????b.HCl????????c.CuSO4????????? d.Ba(NO3)2
(3)请你设计一个实验除去FeCl2溶液中少量的CuCl2 , 写出化学方程式:________。
三、计算题(共2题;共10分)
31.鸡蛋壳主要成分是碳酸钙。某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15 g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80 g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半。试计算(计算结果保留1位小数):(盐酸是HCl溶于水形成的溶液,反应中水不参加反应)
(1)产生CO2的质量为__________ g;
(2)该鸡蛋壳中CaCO3的质量分数。
(3)所用稀盐酸中所参加反应的HCl的质量。??
32.?28.7g的氯化钠和硝酸钠的混合物,溶于100g水中,向所得溶液中加入134g的硝酸银溶液,恰好完全反应,得到溶液的质量是234g。计算:原混合物中钠元素的质量分数。(已知:AgNO3 + NaCl =AgCl↓+NaNO3;计算结果精确到1%)
四、实验探究题(共2题;共17分)
33.某研究性学习小组为了探究一瓶久置的氢氧化钠溶液是否变质,就从该瓶中分别取适量溶液于A、B两支试管,进行实验探究.
①向A试管中滴入无色酚酞试液,根据实验现象,有同学认为原NaOH溶液没有变质;
②向B试管中加入足量的稀盐酸,根据实验现象,有同学认为原NaOH溶液已经变质.
【实验分析】:
(1)根据同学们的实验结论,应观察到的实验现象分别是:A试管________ , B试管________?.
(2)显然,他们的实验结论是矛盾的.实验中,根据试管________?(填A或B)的现象作出的结论肯定是错误的,原因是________?.
(3)小明是个爱思考的学生,他又有一个新的疑问:试液中真是没有NaOH了吗?他又和同学们继续探究:
【猜想】:________?
【实验验证】: 实验操作:________?
实验现象:________?
实验结论:________?(要求写出操作、现象及结论).
(4)通过上述探究,同学们明白氢氧化钠溶液暴露在空气中会变质,故应________?保存.??
34.化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)下列实验仪器中不能用于加热的是________(填字母代号)。
a烧杯??????? b量筒?????? c试管????? d蒸发皿
(2)某化学小组用如图所示装置制取O2。
①写出A装置中发生反应的化学方程式________。
②A装置中长颈漏斗下端浸没在液面以下的原因是什么________?
③用A装置还可以制取CO2 , 写出反应的化学方程式________。
④若用B装置采用排空气法收集氧气,请将B装置中导管补画完整________。
(3)向某盐酸和氯化镁的混合溶液中加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。
①可用________测a点溶液的酸碱度。
②bc段(不含b点) 反应的化学方程式为________。
(4)加热15 g 氯酸钾和二氧化锰的固体混合物制取氧气,待反应完全后,可以得到10.2 g 固体物质。请计算原固体混合物中氯酸钾的质量________。
五、综合题(共1题;共4分)
35.已知甲、乙、丙是初中化学常见的三种物质,且三种物质中均含有相同的某种元素。它们的转化关系如图所示(“→”表示一种物质能转化为另一种物质,部分反应物、生成物及反应条件已略去)
(1)若乙、丙是组成元素相同的气体,且丙是有毒气体,则甲可能是________(填化学式),写出乙转化为丙的化学方程式________。
(2)若丙是相同条件下密度最小的气体,则乙是________(填化学式),甲转化成丙的基本反应类型是________。
答案解析部分
一、单选题
1.【答案】A
2.【答案】D
3.【答案】C
4.【答案】 A
5.【答案】 B
6.【答案】 C
7.【答案】D
8.【答案】 B
9.【答案】 C
10.【答案】 C
11.【答案】 C
12.【答案】 A
13.【答案】A
14.【答案】 A
15.【答案】 C
16.【答案】 A
17.【答案】 B
18.【答案】 B
二、填空题
19.【答案】 (1)CaCO3
(2)N2
(3)Ca(OH)2
(4)SO2
(5)NH3.H2O
(6)H2SO4
20.【答案】有气泡产生
;变浑浊
;Ca(OH)2+CO2═CaCO3↓+H2O
21.【答案】 空气;氧气;氮气;二氧化碳;分别加入石灰水;浑浊
22.【答案】35.8g;A;26.5%;温度升高食盐的溶解度升高不多,因此质量分数也提高不多,而耗能大;III和IV;A
23.【答案】溶解;过滤;蒸发;③④⑥⑧⑨⑩;玻璃棒、漏斗、蒸发皿
24.【答案】使Mg2+形成Mg(OH)2沉淀;CaO+H2O═Ca(OH)2;过滤;HCl;C;海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低.;分子在永不停息地做无规律运动
25.【答案】CaCO3;Ca(OH)2+CO2=CaCO3↓+H2O;2HCl+Zn=ZnCl2+H2↑
26.【答案】CH4
;CH4+ 2O2 CO2 + 2H2 O
;Ca(OH) 2 + CO2 =CaCO3↓+ H2 O
27.【答案】Na2O(SO2H2O);H2SO4;NaOH;Na2SO4
28.【答案】 ①⑦④;⑧
29.【答案】稀盐酸
;稀硫酸或观察颜色
;双氧水或观察颜色
30.【答案】Ca(OH)2;红色;CO2+2NaOH=Na2CO3+H2O;C;CuCl2+Fe=FeCl2+Cu
三、计算题
31.【答案】1、反应生成二氧化碳的质量为:95-90.6=4.4g;
2、解:设CaCO3的质量分数为x%,所用稀盐酸中所参加反应的HCl的质量为y。
CaCO3+2HCl=++ CO2↑
100?? ? ?? 73???????????? ? ? ? ? ? ? ? ?? ?? 44
15x%?? ?? y???????? ? ? ? ? ? ? ? ?? ?????? 4.4g
100:44=15x%:4.4g????????????? 73:44=y:4.4g
X%=66.6%??????????????????? y=7.3g
答:CaCO3的质量分数为66.6%;所用稀盐酸中所参加反应的HCl的质量为7.3g。
32.【答案】 解:由题意可知,反应生成沉淀的质量是:(28.7g +100g +134g)﹣234g = 28.7g,解:设混合物中氯化钠的质量是x
NaCl + AgNO3 =? AgCl↓+? NaNO3
58.5?????? ? ? ? ? ?? ?? 143.5
x?????????? ? ? ? ? ? ? ?? 28.7 g
58.5:143.5=x:28.7g
X=11.7g
则硝酸钠的质量为28.7g-11.7g=17g
设氯化钠中钠元素质量为y ;硝酸钠中钠元素的质量为z
NaCl?? ~?? Na?????????
58.5???? ?? 23?????????
11.7g???? ? y??????????
58.5:23=11.7g:y
y=4.6g
NaNO3????~????Na?
85??????? ? ? ? ? 23
17g?????? ? ? ? ? z
85:23=17g:z
z=4.6g
故,混合物中钠元素的质量分数==32%
答:混合物中钠元素的质量分数为32%。
四、实验探究题
33.【答案】 (1)酚酞试液变红色
;产生气泡
(2)A
;碳酸钠溶液显碱性,能使酚酞试液变红色
(3)溶液中含有氢氧化钠
;取溶液适量于试管中,滴加过量的氯化钙溶液,再滴加酚酞试液;
;产生白色沉淀,酚酞试液变红色
;溶液中仍然含有氢氧化钠
(4)密封
34.【答案】 (1)b
(2)2H2O2 ?2H2O+O2↑;防止氧气从长颈漏斗中逸出;2HCl+CaCO3=CaCl2+H2O+CO2↑;
(3)pH试纸或pH计;MgCl2+2NaOH=2NaCl+Mg(OH)2↓
(4)12.25 g
五、综合题
35.【答案】(1)C或O2;CO2+C 2CO
(2)H2O;置换反应
同课章节目录
