鲁科版高一化学必修一3.3硫的转化课件(共23张PPT)
文档属性
| 名称 | 鲁科版高一化学必修一3.3硫的转化课件(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 16.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2019-12-10 15:36:42 | ||
图片预览







文档简介
(共23张PPT)
【学习目标】
(1)了解二氧化硫的物理性质。
(2)掌握二氧化硫的化学性质及其用途。
(3)了解二氧化硫对人类的功与过和环境保护的知识。
【重点】二氧化硫的化学性质,
【难点】 二氧化硫的漂白性。
有的放矢
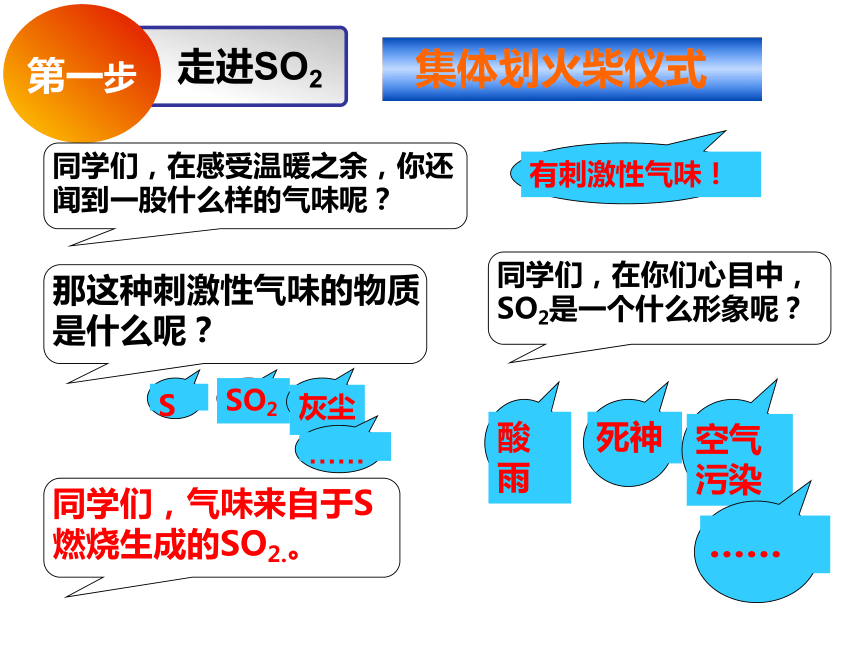
集体划火柴仪式
二氧化硫的物理性质
结合视频 、观察思考、交流分享
装满SO2的矿泉水瓶
颜色
状态
气味
密度
无色
气体
刺激性、有毒
比空气大
SO2的水溶性怎么样呢?如果溶于水又是否能与水反应呢?
学生分组讨论设计实验证明SO2能与水反应。
设计思路:可操作性强,环保,贴近生活
方案一课本实验
方案二创新实验
√
展:一瓶SO2,用注射器注水
观:瓶子变瘪
问:瓶子变瘪原因
思:SO2溶于水
展:SO2溶解度表
答:SO2易溶于水
引:还可能有其他原因吗?
思:SO2与水反应
问:若SO2和水反应产物是?
思:H2SO3或H2SO4
启:类比CO2和水反应
答:价态不变 H2SO3
学生展
示实验
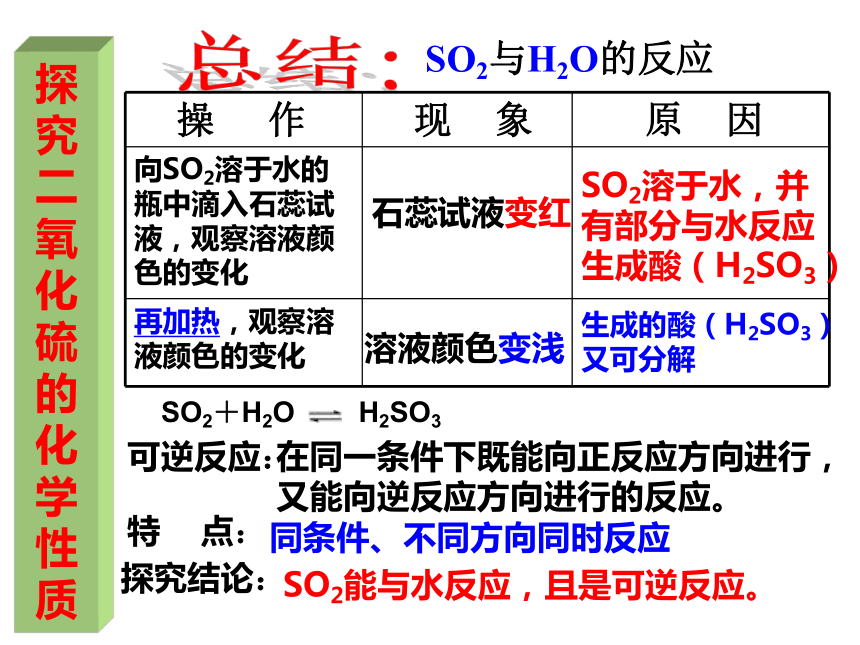
石蕊试液变红
溶液颜色变浅
SO2溶于水,并有部分与水反应生成酸(H2SO3)
生成的酸(H2SO3)
又可分解
可逆反应:
在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
特 点:
同条件、不同方向同时反应
探究结论:
SO2能与水反应,且是可逆反应。
探 究二氧化硫的化学性质
操 作 现 象 原 因
向SO2溶于水的瓶中滴入石蕊试液,观察溶液颜色的变化
再加热,观察溶液颜色的变化
SO2为什么能用作葡萄酒的配料?
阅读以下资料,分组讨论设计实验快速证明SO2具有还原性。
酸性KMnO4
装置优点:封闭环境,药品用量少,现象明显,可操作性强
创新实验
创新实验
*
对比观察
SO2具有还原性
SO2? +? Br2? +? 2 H2O = H2SO4? +? 2HBr
5SO2 + 2 KMnO4 +2H2O = K2SO4 + 2MnSO4 +2 H2SO4
因为Br2水和酸性KMnO4溶液均具有较强的氧化性
KMnO4溶液褪色,加热不恢复
拓展:
SO2能使Br2水褪色,加热不恢复
操 作 现 象 原 因
用硫酸酸化的KMnO4溶液与SO2反应,观察现象?加热如何?
体验SO2的漂白性。
失去SO2
观看视频
SO2具有漂白性
(有选择的暂时的化合漂白)
结论:
二氧化硫性质总结
生活中的二氧化硫
巩固应用
万物都是发展的和矛盾的。认识物质也一样,必须认识到它的两面性,有功的地方,我们大加利用,有过的地方,需加以抑制。
使用SO2时需注意两个方面:
(1)合理地控制其使用对象,不能用于食物
(2)合理控制使用剂量
【问题探究1】 SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗?
知能转化
不同。前者缘于SO2的还原性,发生的是氧化还原反应。后者缘于其漂白性,发生的是非氧化还原反应.
【问题探究2】SO2具有漂白性,氯水有漂白性,如果将二者等物质的量混合,有漂白性吗?
知能转化
联系实际----学以致用
1.鉴别SO2与CO2最好选用的化学试剂是 ( )
A.紫色的石蕊试液 B.品红溶液
C.澄清的石灰水 D.氢氧化钠溶液
B
2.下列各组气体中均能造成大气污染的是 ( )
A.CO2、O2 B.N2、CO
C.Cl2、N2 D.NO2、SO2
D
作业布置:必做和选做
目的:根据学生的个体差异,让学有余的学生有更多的发挥空间
【学习目标】
(1)了解二氧化硫的物理性质。
(2)掌握二氧化硫的化学性质及其用途。
(3)了解二氧化硫对人类的功与过和环境保护的知识。
【重点】二氧化硫的化学性质,
【难点】 二氧化硫的漂白性。
有的放矢
集体划火柴仪式
二氧化硫的物理性质
结合视频 、观察思考、交流分享
装满SO2的矿泉水瓶
颜色
状态
气味
密度
无色
气体
刺激性、有毒
比空气大
SO2的水溶性怎么样呢?如果溶于水又是否能与水反应呢?
学生分组讨论设计实验证明SO2能与水反应。
设计思路:可操作性强,环保,贴近生活
方案一课本实验
方案二创新实验
√
展:一瓶SO2,用注射器注水
观:瓶子变瘪
问:瓶子变瘪原因
思:SO2溶于水
展:SO2溶解度表
答:SO2易溶于水
引:还可能有其他原因吗?
思:SO2与水反应
问:若SO2和水反应产物是?
思:H2SO3或H2SO4
启:类比CO2和水反应
答:价态不变 H2SO3
学生展
示实验
石蕊试液变红
溶液颜色变浅
SO2溶于水,并有部分与水反应生成酸(H2SO3)
生成的酸(H2SO3)
又可分解
可逆反应:
在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。
特 点:
同条件、不同方向同时反应
探究结论:
SO2能与水反应,且是可逆反应。
探 究二氧化硫的化学性质
操 作 现 象 原 因
向SO2溶于水的瓶中滴入石蕊试液,观察溶液颜色的变化
再加热,观察溶液颜色的变化
SO2为什么能用作葡萄酒的配料?
阅读以下资料,分组讨论设计实验快速证明SO2具有还原性。
酸性KMnO4
装置优点:封闭环境,药品用量少,现象明显,可操作性强
创新实验
创新实验
*
对比观察
SO2具有还原性
SO2? +? Br2? +? 2 H2O = H2SO4? +? 2HBr
5SO2 + 2 KMnO4 +2H2O = K2SO4 + 2MnSO4 +2 H2SO4
因为Br2水和酸性KMnO4溶液均具有较强的氧化性
KMnO4溶液褪色,加热不恢复
拓展:
SO2能使Br2水褪色,加热不恢复
操 作 现 象 原 因
用硫酸酸化的KMnO4溶液与SO2反应,观察现象?加热如何?
体验SO2的漂白性。
失去SO2
观看视频
SO2具有漂白性
(有选择的暂时的化合漂白)
结论:
二氧化硫性质总结
生活中的二氧化硫
巩固应用
万物都是发展的和矛盾的。认识物质也一样,必须认识到它的两面性,有功的地方,我们大加利用,有过的地方,需加以抑制。
使用SO2时需注意两个方面:
(1)合理地控制其使用对象,不能用于食物
(2)合理控制使用剂量
【问题探究1】 SO2能使溴水、KMnO4溶液褪色与SO2使品红褪色,实质相同吗?
知能转化
不同。前者缘于SO2的还原性,发生的是氧化还原反应。后者缘于其漂白性,发生的是非氧化还原反应.
【问题探究2】SO2具有漂白性,氯水有漂白性,如果将二者等物质的量混合,有漂白性吗?
知能转化
联系实际----学以致用
1.鉴别SO2与CO2最好选用的化学试剂是 ( )
A.紫色的石蕊试液 B.品红溶液
C.澄清的石灰水 D.氢氧化钠溶液
B
2.下列各组气体中均能造成大气污染的是 ( )
A.CO2、O2 B.N2、CO
C.Cl2、N2 D.NO2、SO2
D
作业布置:必做和选做
目的:根据学生的个体差异,让学有余的学生有更多的发挥空间
